
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Обязательные разделы пояснительной запискиСтр 1 из 2Следующая ⇒
 Содержание разделов пояснительной записки представлено ниже. 1. Введение В этом разделе дается краткая характеристика объекта: вида выпускаемой продукции (полимерной системы), её классификация, состав. Указывается актуальность и практическая значимость темы курсовой работы. Приводится статистика пожаров (аварий) с участием полимерных систем, приводятся отдельные примеры пожаров, возникших аварийных ситуаций. Изложение данного вида информации лучше сопровождать: графиками, рисунками, фотографиями, другим иллюстрационным материалом. Формулируются цели и задачи проводимой работы. Краткое теоретическое содержание раздела Современная жизнь общества тесно связана с материалами и продуктами химической промышленности. Химическими предприятиями синтезируются и выпускаются сотни тысяч простых и сложных веществ, используемых в быту, на объектах общественного назначения, на производстве. Так в настоящее время почти в каждой отрасли промышленности используют пластические массы и химические волокна. Распространение синтетических материалов обуславливается их ценными свойствами: высокой механической прочностью, эластичностью, сопротивляемостью истиранию, химической стойкостью к действию агрессивных сред и т.п. Однако почти все получаемые синтетические полимерные системы являются горючими материалами, не обладающие высокой термической стойкостью. Большая часть этих систем при воздействии тепла плавится и разлагается, выделяя пожароопасные и токсичные пары и газы (приложение Х). Процессы производства пластических масс и химических волокон многостадийны, сложны и почти все пожаро- и взрывоопасны. Это объясняется тем, что сырьем и вспомогательными веществами, при их производстве, являются пожароопасные газы ( например: этилен, ацетилен, бензол, бензин, циклогексан, алифатические спирты и др). Для данных химических реакций используют катализаторы и инициаторы. Они представляют собой взрывоопасные, воспламеняющиеся на воздухе вещества (металлорганические катализаторы) или сильные окислители, способные разлагаться с взрывом и вызывать воспламенение других веществ (порофоры, перекиси и т.п.). В процессе переработки используемое сырье претерпевает многообразные превращения и видоизменения, образуя промежуточные соединения, представляющие собой в большинстве случаев также взрывоопасные газы и легковоспламеняющие жидкости. Процесс получения полимеров (синтез полимеров) связан с осуществлением реакции полимеризации или поликонденсации, протекающих при повышенной температуре и в некоторых случаях при высоком давлении. Высокая температура процесса вызывает необходимость использования специальных теплоносителей, которые являются также горючими жидкостями. Высокотемпературные органические теплоносители (ВОТ), находясь в рубашках и змеевиках аппаратов, будут увеличивать общее количество горючих веществ в цехе. ВОТ часто сами, являются причиной пожаров и взрывов. Наличие в цехах значительного количества горючих веществ, разветвленной сети трубопроводов с обращающимися жидкостями и газами, технологических проемов в строительных конструкциях, сложных систем пневматической транспортировки порошковой продукции и вентиляционных устройств создает благоприятную возможность для развития пожара. Пожар по своей химической сущности представляет окислительно-восстановительный процесс (процесс горения). Окисление горючего вещества в условиях реального пожара, чаще всего происходит окислителем воздуха. Чтобы пожар возник и стал распространяться, необходимы определенные условия: наличие горючего вещества и его взаимодействие с воздухом (в некоторых случаях окислительно-восстановительные процессы протекают и без кислорода воздуха), взаимодействие их с источником тепла, способного разогреть горючее вещество до температуры, при которой оно может самовоспламениться и устойчиво гореть. Кроме всего прочего, начавшийся пожар может развиваться и причинять значительный ущерб, если имеются пути для его распространения (скопление твердых горючих материалов, разлив жидкости, сгораемые строительные конструкции, незащищенные проемы, перекрытия, отсутствие преград на производственных коммуникациях, воздуховодах и т.п.). Таким образом, оценивая пожарную опасность технологического процесса производства полимерных систем, в каждом отдельном случае устанавливают, при каких условиях в аппаратах, производственных помещениях или на открытых производственных площадках может образовываться горючая среда, по каким причинам появляются источники воспламенения и каковы пути вероятного распространения пожара. Основной задачей МЧС России является обеспечение безопасности каждого человека нашего общества, снижение рисков на стадиях получения и обращения химических веществ и материалов. Рассмотрим использование базовых положений дисциплины «Химия» для формирования умений и навыков, которыми необходимо использоваться при анализе пожарной опасности технологических процессов. Из нормативных документов () известно, что анализ пожарной опасности производственных объектов предусматривает: 1) анализ пожарной опасности технологических сред и параметров технологических процессов; 2) оценку пожарной опасности технологических сред, которая состоит в определении комплекса показателей. Перечень которых зависит от агрегатного состояния технологической среды, параметров состояния системы, особенностей технологического процесса; 3) определение перечня возможных пожароопасных ситуаций и параметров технологического процесса; 4) определение перечня причин, возникновение которых позволит охарактеризовать ситуацию как пожароопасную, для каждого химического процесса (каждой стадии); 5) построение сценариев возникновения и развития пожаров, повлекших за собой гибель людей, Идентификацию характерных опасностей стадии (процесса) проводят на основе анализа возможностей протекания основных и вспомогательных химических процессов, вероятность протекания которых по предложенному сценарию возможна. Результатом идентификации опасностей, как правило, являются: - изучение и реализация общих принципов построения технологического процесса; - анализ пожарной опасности предложенной стадии технологического процесса, включающий определение пожарной опасности использующихся в этой стадии веществ и материалов; - определение возможности образования горючей среды в предложенных условиях внутри помещения (аппарата, трубопровода и т.п.); - определение возможности образования в горючей среде источников тепла и .т.п.; - описание источников опасности, условий возникновения и развития возможных взрывопожароопасных и пожароопасных аварийных ситуаций. На основании выше изложенного рассмотрим основные понятия, законы, положения с которыми придется встретиться при выполнении курсовой работы по дисциплине «Химия». Явления - это изменения, происходящие в окружающем нас материальном мире. Явления, сопровождающиеся изменением формы, вида, состояния вещества, называются физическими. Например, превращение воды в лед или пар, выделение тепла, плавление металлов. Химические явления - процессы, идущие с превращением одного вещества в другое, то есть сопровождающиеся изменением состава и свойств вещества, называются химическими превращениями или химическими реакциями. Например, процессы окисления, горения, получения металлов из их руд, коррозия металлов и т.д. Химические формы существования материальных объектов называются веществами, а превращения одних веществ в другие – химическими реакциями. Вещество – это устойчивое скопление частиц, обладающих массой покоя, которое характеризуется определенными в данных условиях физическими и химическими свойствами. Сложные вещества или химические соединения - молекулы, которых состоят из атомов различных элементов. Например, молекула воды (Н2О) состоит из двух атомов водорода и одного атома кислорода. Химический элемент - это отдельный вид атомов, характеризующийся одинаковыми химическими свойствами. Атомами называются наиболее простые химически неделимые электронейтральные системы, состоящие из элементарных частиц. Молекула - наименьшая частица данного вещества, обладающая его химическими свойствами. Молекула состоит из атомных ядер и окружающих их внутренних и внешних (валентных электронов), которые принимают участие в образовании химических связей. Следует отметить, что из молекул состоят вещества, находящиеся в газообразном и парообразном состоянии. Твердые же вещества состоят из молекул лишь в том случае, если они имеют молекулярную кристаллическую решетку. Атомно-молекулярное учение Основные положения: 1.Все вещества состоят из молекул. Между молекулами имеются пустоты. 2.Молекулы состоят из атомов. 3.Молекулы и атомы находятся в непрерывном движении. Тепловое состояние тела есть результат движения частиц, из которых они состоят. 4.Атомы каждого элемента характеризуются определенным весом и размером. 5.Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ - из различных атомов. Данное учение окончательно утвердилось в химии лишь в середине XIX века в городе Карлсруэ в 1860г. на международном съезде химиков. Развитие количественных методов исследования в области химии потребовало разработки химической метрологии. Относительная атомная масса (Аr) химического элемента - величина, равная отношению средней массы атома естественного изотопического состава элемента к 1/12 массы атома углерода 12С. (1 а е м = 1,66× 10-27кг). Или - относительной атомной массой химического элемента (атомной массой) называется масса его атома, выраженная в атомных единицах массы (обозначается Аr). Это - одна из основных характеристик химического элемента. Например, относительная атомная масса хлора - Аr(Cl)=35,45. Она показывает, во сколько раз масса атома данного элемента тяжелее 1 атомной единицы массы, поэтому размерность а е м опускается. Современные значения Аr приведены в периодической системе элементов Д.И.Менделеева. Относительная молекулярная масса (молекулярная масса) простого или сложного вещества называется масса его молекулы, выраженная в атомных единицах массы. Например: Мr(Н2О) = 2×1,0079 + 1×15,9994 = 18,0152 Данная величина показывает, во сколько раз масса молекулы вещества тяжелее 1 атомной единицы массы, поэтому размерность а е м также опускается. Наряду с понятиями массы и объема в химии пользуются понятием количества вещества. Количество вещества - это физическая величина, определяемая числом реально существующих в системе формульных единиц (ФЕ) - атомов, молекул, ионов, радикалов, электронов и других частиц. Единицей количества вещества в Международной системе единиц (СИ) служит моль, а также его производные: 1 киломоль=103моль, 1 миллимоль=10-3моль, другие. Моль - количество вещества определенной химической формулы, содержащее столько же формульных единиц (атомов, ионов, молекул, электронов и др.), сколько содержится атомов в 12г изотопа углерода с массовым числом 12. Измерения показывают, что 1 моль содержит число формульных единиц равное 6,022045×1023. Это число определено итальянским ученым Авогадро и носит его имя. При практических расчетах в химии достаточно пользоваться величиной NA=6,022×1023 частиц/моль. Исходя из формулы соединения, нетрудно определить число моль формульных единиц молекулы - атомов, ионов. Например, 1 моль молекул CаCl2 содержит 1 моль ионов Са2+ (6,022×1023 ионов Са2+) и 2 моль ионов С1- (12,044×1023 ионов С1-). Масса одного моль вещества, выраженная в граммах, называется его молярной массой. Молярная масса выражается в г/моль и обозначается М(В). М(В)= m(В)/ν(В), где m(В) - масса вещества, г; ν(В) - количество вещества, моль; В – вещество.
Важное значение для решения практических расчетных задач (например: расчета материально-теплового баланса любого химического процесса) имеют законы стехиометрии. Они были сформулированы применительно к молекулам, а потому справедливы для веществ с молекулярным строением (молекул, кристаллов с молекулярной структурой).
Стехиометрические законы Стехиометрия - раздел химии, в котором рассматриваются массовые и объемные отношения между реагирующими веществами. В переводе с греческого «стехиометрия» означает «составная часть» и «измеряю». С одной стороны законы стехиометрии подтвердили правильность положений атомно-молекулярного учения, а оно в свою очередь объясняет все стехиометрические законы химии. Закон сохранения массы вещества и энергии. Изучая протекание химических реакций, М.В.Ломоносов (1748г.) сформулировал закон сохранения массы, который является частным случаем закона сохранения материи: масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции. То есть, в результате химической реакции происходит перегруппировка атомов из молекул одних веществ в молекулы других, а общее число атомов каждого химическою момента остается постоянным. Вторая часть общего принципа сохранения материи и движения явилась основанием для формулировки Ломоносовым в 1760т. закона сохранения энергии: энергия системы, включающей вещества, вступившие в реакцию, равна энергии системы, включающей вещества, образовавшиеся в результате реакции. В 1905 году Альберт Эйнштейн показал, что энергия (Е) и масса (m) связаны соотношением: ∆m=∆E где с - скорость света в вакууме, равная 2,998×108м/с. Каждый химический процесс описывается химическим уравнением, которое символизирует собой законы сохранения массы и энергии при протекании химической реакции, которые объединены в следующей формулировке: суммарные масса и энергия объектов, вступивших в реакцию, всегда равны суммарной массе и энергии продуктов реакции. В конце XVIII века французским ученым Прустом был открыт закон постоянства состава, в начале XIX века после восьмилетней дискуссии между Прустом и Бертолле была принята следующая формулировка закона: каким бы путем не было получено данное химическое соединение с молекулярной структурой, оно имеет вполне определенный постоянный элементный состав (и свойства). Закон справедлив для соединений с молекулярной структурой. Например, воду можно получить различными способами: синтезом из водорода и кислорода, реакцией нейтрализации, из кристаллогидратов и др. Во всех случаях у чистой воды, независимо от способа получения образца Н2О, массовая часть водорода составляет 11,19%, кислорода - 88,81%. Анализируя технологические процессы производства полимерных систем, отдельные стадии, мы будем исходить из следующего положения: в данных реакциях претерпевают химическое превращение соединения с молекулярной структурой. В 1803г. английским ученым Дж.Дальтоном на основе идеи, что химические процессы сводятся к соединению неделимых атомов в более сложные частицы, а химические соединения с молекулярной структурой образуются в строго определенных, постоянных и целочисленных отношениях элементов был сформулирован закон кратных отношений: два элемента образуют между собой несколько химических соединений с молекулярной структурой, то массовые части одного элемента соединяющегося с одной и той же массовой частью другого относятся между собой как небольшие целые числа. Например, в оксидах азота N2О, NO, N2О3 массовые части кислорода, приходящиеся на 1 массовую часть азота, относятся между собой как небольшие целые числа 1:2:3. Из закона кратных отношений вытекают два важных вывода. Соединении с молекулярной структурой, образованные одними и теми же элементами, обычно резко отличаются друг от друга по соотношению масс, причем это соотношение меняется скачкообразно. Изменение количественного соотношения между соединяющимися элементами всегда влечет за собой изменение качества. Исследования по изучению химических реакций между газообразными веществами привели Гей-Люссака к открытию закона объемных отношений (1808): при неизменной температуре и давлении объемы вступающих в реакцию газов относятся друг к другу и к Объемам образующихся газообразных продуктов реакции как небольшие целые числа. Например, реакция образования хлорметана. Запишем уравнение реакции: СН4(г)+С12(г)=СН3С1(г) + НCl Из уравнения следует, что объемы вступающих и образующихся газов относятся друг к другу как V(СН4):V(CI2):V(СН3С1): V(НС1)=1:1:1:1. Химические процессы в рассматриваемых полимерных системах протекают, как правило, при изменяющихся физических параметрах реагентов: V, P, T. Зависимость объема газопаровоздушной смеси реагентов от условий обращения в технологическом процессе будет выражается законом Шарля-Гей-Люссака (VT=V0T/T0) и законом Бойля-Мариотта PV= const. Определение измерения объемов газов, на стадии смешение мономера с сополимером (воздухом и т.п.) и его сжатие проводятся при физических условиях, отличающихся от нормальных. Для приведения полученных объёмов к нормальным условиям (н.у.) используют уравнение, объединяющее законы Бойля-Мариотта и Шарля-Гей-Люссака; PV/Т = Р0V0/Т0, где Р и V — давление и объем газа при данной температуре; Р0, V0, Т0 — давление и объем газа при нормальных условиях. Нормальные условия Т0 = 273,15К и Р0=101325Па.
Для объяснения простых соотношений между объемами реагирующих газопаровоздушных смесей используют, которая стала называться закон Авогадро (итальянский ученый Авогадро в 1811г. высказал гипотезу о простых соотношениях между объемами реагирующих газов): в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Из закона Авогадро вытекают два следствия: 1. Один моль любого газа при одинаковых условиях занимает один и тот же объем. При нормальных условиях (н.у.) 1 моль любого газа занимает объем, равный 22,4л. Этот объем называется молярным объемом газа и обозначается VМ. Молярный объем можно вычислить, зная молярную массу газа (М) и массу одного литра газа, измеренного при нормальных условиях (р) VM = М/р. Молярный объем газа - это отношение объема газообразного вещества V(B) к количеству этого вещества: VM = V(В)/ν(В) 2.В молярном объеме газообразного вещества (н.у.) 22,4л/моль, как и в любой другой системе, количеством вещества в 1 моль, число структурных единиц равно числу Авогадро NA=6,0221023. На практике часто для расчетов используется следующие положения: 1.Отношение масс равных объёмов различных газов равно отношению их молярных масс:
где m1 и m2 – массы, а M 1 и M 2 –молярные массы первого и второго газов. Отношение m1 к m2 получило название относительной плотности D первого газа по второму. Тогда
Отношение молярных масс двух газов при одинаковых условиях называется относительной плотностью одного газа по другому (D).
Введение в химию понятия "эквивалент" позволили сформулировать закон, называемый законом эквивалентов: вещества взаимодействуют между собой в количествах, пропорциональных их эквивалентам. Чаще пользуются другой формулировкой закона эквивалентов: массы (объемы) реагирующих друг с другом или образующихся веществ пропорциональны их молярным массам эквивалентов (молярным объемам эквивалентов). Уравнение состояния идеального газа. Уравнение Клапейрона-Менделеева Если записать объединенный газовый закон для любой массы любого газа, то получается уравнение Клапейрона-Менделеева:
где m - масса газа (г, кг); Mв-ва - молярная масса газообразного вещества (кг/моль, г/моль); р – давление (Па); V – объем (л, м3); T - абсолютная температура (К); R- универсальная газовая постоянная , которая равна 8,314 Дж/(моль
Рассмотрим использование выше изложенных теоретических положений на некоторых примерах расчетного задания курсовой работы. Например: задана полимерная система - полиметиленоксифенилен, определить сополимер, который будет использоваться в синтезе полимерной системы, если при полном сжигании 3,0 г вещества образовалось 4,4 г оксида углерода (IV) и 1,8 г воды. Плотность паров этого вещества по воздуху составляет 1,03 г/л. Вывести молекулярную формулу мономера. Возможная формула вещества – СхНуОz ν(C) = ν(CО2), ν(Н) = 2ν(Н2О),
ν(Н)= 2 Вычисляем массы углерода и водорода, которые содержались в навеске вещества:
Следовательно, в веществе содержится кислород, масса которого составляет:
х: y :z = ν(C) : ν(Н) : ν(О) =0,1:0,2:0,1 =1:2:1 Простейшая формула вещества: СН2О М(СН2О) = 2
Следовательно, молекулярная формула мономера совпадает с простейшей: СН2О. Учитывая, что в органических соединениях углерод четырехвалентен, возможна следующая структурная формула вещества:
При проектировании производств, одним из необходимых факторов показателей производства является объем производимой продукции (материальный баланс процесса), который рассчитывается с использованием основных законов химии. Например: рассчитать, какой образуется объем продуктов реакции, если для получения монохлорпроизводного метана, была использована смеси 500л метана и 500 кг хлора. Исходить из предположения, что хлорметан является основным продуктом реакции. Сколько составил практический выход продукта, если в результате разгерметизации колонны производственные потери составили 12%. СН4 + Cl2 =CH3Cl + HCl
1. Расчет количества метана
2. Расчет количества хлорирующего агента:
В соответствии с уравнением реакции на 1 Очевидно, что для полного использования метана потребовалось бы 6,25 моль хлора, т.е. хлорирующего агента недостаточно. Расчет количества и объема продукта реакции необходимо вести по хлорирующему агенту.
Производственные потери:
ηпрактический(СН3Cl)= ηтеоретический (СН3Cl) - Qпроизводственные потери = 155,6 – 18,7= 136,9 (л)
Определение уровня вентиляционной шахты в промышленном помещении Например: определить на каком уровне должен быть расположен вентиляционный проем, обеспечивающий удаление газопаровоздушного облака, если будет аварийное истечение в придонную часть аппарата. Истекающее вещество С2Н6О. Плотность газа в промышленном помещении определяет по соотношению:
М(С2Н6О) = 2
Газы, у которых относительная плотность по воздуху больше 1, тяжелее воздуха, т.е.
При отсутствии вентиляционной системы в промпомещение, аварийное истечение С2Н6О, приведет к скапливанию его в придонной части реактора, горючие пары газопаровоздушного облака будут с большей вероятностью скапливаться в нижней части помещения. Вентиляционные проемы должны располагаться в нижней части одной из стен помещения. Расчет газообразного состояния веществ при условиях, отличающихся от нормальных. Например: в рекуператоре реакционная смесь занимает объем 500м3, смесь находится под давлением 150 кПа. Считать, что с момента аварии до устранения разгерметизации аппарата 15% реакционной смеси оказалось вне рекуператора. Сколько газопаровоздушной смеси выйдет из аппарата при аварийной разгерметизации. По закону Бойля- Мариотта при Т=const, p1V1 =p2V2. Находим, какой объем займет газопаровоздушная смесь, если вне рекуператора давление равно атмосферному (101,3 кПа). Тогда
Учитывая, что с момента аварии до устранения разгерметизации аппарата 15% реакционной смеси оказалось вне рекуператора, вышедший объем газопаровоздушной смеси составит:
Например: рассчитать, какую массу имеет на загрузке мономер (СН2О), если рабочее давление при загрузке равно атмосферному (1 атмосфера), температура мономера составляет 540С, загружаемый объем 300 л. Для расчетов используем уравнение Менделеева-Клайперона:
Рассчитываем молярную массу мономера М(СН2О) = 1 Из уравнения Менделеева -Клайперона выражаем массу:
Если р0=1 атм; V0=22,4 л/моль; Т0=273 К, то
В системе СИ р0=101,3 кПа; V0=22,4
Тогда Например: при некоторой температуре давление газопаровоздушной смеси, занимающего объем 300 м3, равно 101,3 кПа (760 мм рт.ст.). Газопаровоздушная смесь передавливается в полимеризатор. Каким будет давление в полимеризаторе, если, не изменяя температуры, объем газопаровоздушной смеси уменьшить до 150 м3? Оценить сохранность конструкции, если конструкция выдерживает давление 3 атм? Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объему газа: P2 / P1 = V1 / V2 . Выражаем P2: P2 = P1 ·V1 / V2 = (101,3 · 300)/150=202,6 (кПа). Давление газопаровоздушной смеси в полимеризаторе составит 202,6 кПа. Предельное давление, при котором сохраняется конструкция резервуара 303,9 кПа или 3 атм. После закачки газопаровоздушной смеси давление в полимеризаторе повышается до 202,6 кПа. Предельно допустимое давление не превышено. Конструкция целостность сохранит. Опасности разрыва конструкции нет. Например: В хранилище газопаровоздушная смесь находится под буферным давлением, равным 4 атм. При той же температуре производится передавливание этого же количества смеси в компрессор меньшего объёма, давление увеличивается до 16 атм. Изменится ли и во сколько раз плотность пара в компрессоре? Согласно закону Бойля – Мариотта, при постоянной температуре давление газа прямо пропорционально его плотности. Можно записать
тогда
Плотность пара в компрессоре изменится в 4 раз.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-30; просмотров: 215. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 c2,
c2, ,
,



 0,1 = 0,2 (моль)
0,1 = 0,2 (моль)






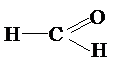

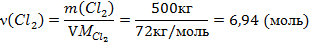
 приходится 1
приходится 1 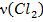 ,
,






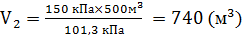







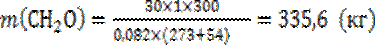
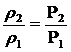 ,
,