
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
МЕТОДИ АНАЛІЗУ ХЛОРИДНОЇ КИСЛОТИСтр 1 из 3Следующая ⇒ КУРСОВА РОБОТА
з дисципліни«ТЕХНІЧНИЙ АНАЛІЗ, СТАНДАРТИЗАЦІЯ І СЕРТИФІКАЦІЯ НЕОРГАНІЧНИХ РЕЧОВИН» на тему: Технічний аналіз у виробництві хлоридної кислоти
Керівник Виконавець Студентка групи ХН-01 __________/ст. викл. Обушенко Т.І./ __________/Кирієнко О.Ю./ підпис посада, прізвище підпис прізвище
Допущено до захисту з рейтингом _______ балів Результат захисту _______ балів Рейтинг кредитного модуля ________ балів Оцінка ____________ _______ традиційна ECTS
Комісія: ______________ ст. викл. Обушенко Т.І.
_____________ ________________ підпис посада, прізвище Київ 2012
Хіміко-технологічний факультет НТУУ „КПІ” Кафедра технології неорганічних речовин та загальної хімічної технології ЗАВДАННЯ На курсову роботу
студенту ____________________________________________ (прізвище, ім’я, по батькові) 1. Тема роботи ______________________________________ ____________________________________________________ 2. Термін здачістудентом закінченої роботи “ 15 ” 05 2012р. 3. Вихідні дані до роботи ______________________________ ____________________________________________________ 4. Перелік питань, які мають бути розроблені: 4.1__________________________________________________ 4.2 _________________________________________________ 4.3__________________________________________________ ____________________________________________________  4.4__________________________________________________ ____________________________________________________
5. Дата видачі завдання “ 1 ” березня 2012 р.
Керівник курсової роботи _____________ Т.І. Обушенко (підпис) (ініціали, прізвище) Завдання прийняла до виконання _________ О. Ю. Кирієнко
ЗМІСТ Реферат Пояснювальна записка: стор., рис., табл., додатка, посилань. Виконано огляд технічної літератури та інтернет-джерел, присвячених дослідженню проблеми виробництва хлоридної кислоти в Україні, а також коротко розглянуто основні переваги та недоліки існуючих схем виробництва, слабкі місця технології та перспективи її вдосконалення. В роботі представлені технологічні схеми виробництва хлоридної кислоти, описані методи отримання, а саме сульфатний, абгазний, синтетичний, наведені основні методики технічного аналізу та контролю на виробництві. Проведено аналіз технічної хлоридної кислоти, а саме: визначення масової частки хлоридної кислоти, масової частки заліза та масової частки вільного хлору. Здійснено статистичну обробку експериментальних даних з метою встановлення їх достовірності та можливості використання для подальших розрахунків та характеристики досліджуваних об’єктів.
ХЛОРИДНА КИСЛОТА, ХЛОРОВОДЕНЬ, ХЛОР, ВОДЕНЬ, Фотометрія, ТИТРИМЕТРІЯ, довірчий інтервал, технічний контроль. Пояснительная записка: с., Рис., Табл., Приложения, ссылок. Выполнен обзор технической литературы и интернет-источников, посвященных исследованию проблемы производства соляной кислоты в Украине, а также кратко рассмотрены основные преимущества и недостатки существующих схем производства, слабые места технологии и перспективы ее совершенствования. В работе представлены технологические схемы производства соляной кислоты, описаны методы получения, а именно сульфатный, абгазный, синтетический, приведены основные методики технического анализа и контроля на производстве. Проведен анализ технической соляной кислоты, а именно: определение массовой доли соляной кислоты, массовой доли железа и массовой доли свободного хлора. Осуществлена статистическая обработку экспериментальных данных с целью установления их достоверности и возможности использования для дальнейших расчетов и характеристики исследуемых объектов.
cОЛЯНАЯ КИСЛОТА, ХЛОРОВОДОРОД, ХЛОР, ВОДОРОД, ФотометрИя, ТИТРИМЕТРИЯ, довЕРИТЕЛЬНЫЙ Интервал, технИЧЕСКИЙ контроль. ABSTRACT ВСТУП Виробництво хлоридної кислоти є одним з традиційних напрямів хімічної промисловості України. Основний попит на соляну кислоту формується підприємствами хімічної, нафтопереробної, металургійної галузей та паливно-енергетичного комплексу. Хлоридна кислота застосовується в хімічній, медичній, харчовій промисловості, кольоровій та чорній металургії. Виробництво синтетичної хлоридної кислоти освоєно в 1962 році. Соляну кислоту отримують розчиненням газоподібного хлороводню у воді. Хлороводень утворюється шляхом спалюванням водню в хлорі, отримана таким способом кислота називається синтетичної. Також соляну кислоту отримують з абгазів - побічних газів, що утворюються при різних процесах, наприклад, при хлоруванні вуглеводнів. Хлороводень, що міститься в цих газах називається абгазним, а отримана таким чином кислота - абгазною. В останні десятиліття частка абгазної соляної кислоти в обсязі виробництва поступово збільшується, витісняючи кислоту, отриману спалюванням водню в хлорі. Соляна кислота, отримана методом спалювання водню в хлорі, містить менше домішок і застосовується при необхідності високої чистоти. У лабораторних умовах використовується розроблений алхіміками спосіб, що полягає в дії концентрованої сірчаної кислоти на кухонну сіль: NaCl + H2SO4 (конц.) (150 ° C) → NaHSO4 + HCl ↑ Хлороводень добре розчинний у воді. Так, при 0 ° C 1 об'єм води може поглинути 507 обсягів HCl, що відповідає концентрації кислоти 45%. Однак при кімнатній температурі розчинність HCl нижче, тому на практиці звичайно використовують 36-відсоткову соляну кислоту. За період експлуатації проводився ремонт, удосконалилося технологічне обладнання. Висока якість сировини дозволяє отримувати кислоту високої якості. Хлоридну кислоту застосовують для одержання хлоридів різних металів, органічних напівпродуктів і синтетичних барвників, оцтової кислоти, активованого вугілля, різних клеїв, гідролізного спирту, в гальванопластиці. Її застосовують для травлення металів, очищення різних посудин, обсадних труб свердловин від карбонатів, оксидів та ін забруднень. У металургії кислотою обробляють руди, в шкіряної промисловості - шкіру перед дубленням і фарбуванням. Хлоридна кислота також застосовується у виробництві пластмас, отрутохімікатів, в електротехнічній, текстильній, харчовій промисловості, в медицині і т.д. 1 МЕТОДИ ВИРОБНИЦТВА ХЛОРИДНОЇ КИСЛОТИ
1.1 Загальна характеристика хлоридної кислоти Хлоридна кислота - сильна одноосновна кислота, розчин хлороводню у воді. Хлоридна кислота - безбарвна рідина з гострим запахом хлороводню. Технічна хлоридна кислота має жовтувато-зелений колір через домішки хлору і солей заліза. Максимальна концентрація соляної кислоти при 20 ° C дорівнює 38% за масою, щільність такого розчину 1,19 г/см3, на повітрі він «димить», виділяється HCl, утворюючи з водяною парою дрібні крапельки. Розчинність хлороводню у воді залежить від температури і парціального тиску хлороводню в газовій суміші. При затвердінні хлоридна кислота дає кристалогідрати складу HCl ∙ H2O, HCl ∙ 2H2O, HCl ∙ 3H2O, HCl ∙ 6H2O. НС1, утворює з водою азеотропну суміш. В системі HCl-вода існують три евтектичні точки: -74,7 ° С (23,0% по масі НС1), -73,0 ° С (26,5% НО), -87,5 ° С (24,8 % НС1, метастабільна фаза). Відомі кристалогідрати НС1-nН2О, де n = 8, 6 (Тпл. -40 ° С); 4, 3 (Тпл. -24,4 ° С); 2 (Тпл. -17,7 ° С) і 1 (Тпл . -15,35 ° С). Лід кристалізується з 10%-ної соляної кислоти при -20 ° С, з 15%-ной при -30 ° С, з 20%-ной при -60 ° С і з 24%-ной при -80 ° С. Хлоридна кислота хімічно дуже активна. Розчиняє з виділенням водню всі метали, які мають негативний стандартний потенціал, з багатьма оксидами і гідроксидами металів утворює хлориди, виділяє вільні кислоти з таких солей, як фосфати, силікати, борати та ін. Будучи сильною кислотою, вона має всі властивості кислот. Хлоридна кислота реагує з наступними речовинами: - З металами стоять в електрохімічному ряду металів до водню; Деякі органічні речовини, додані до хлоридної кислоти, сильно гальмують розчинення нею металів. Чим концентрованіша кислота, з тим меншою швидкістю вона розчиняє метал в присутності незначної кількості інгібітора. До числа найпоширеніших належать інгібітори ПБ - полімери бутіліміна. Гальмівну дію інгібіторів пояснюють адсорбцією органічного речовини на поверхні металу, в результаті якої утворюється захисний шар, що підвищує перенапруження виділення водню на металі. Більшість інгібіторів виявляють свою захисну дію нижче 70-80ºС. До інгібіторів, стійких при більш високій температурі (100-110ºС), відносяться уротропін, акридин, "пенореагент" ПР-1. Інгібована кислота розчиняє сталь в десятки і в сотні разів повільніше, ніж неінгібована. Виробництво хлоридної кислоти є одним з традиційних напрямів хімічної промисловості України. Основний попит на соляну кислоту формується підприємствами хімічної, нафтопереробної, металургійної галузей та паливно-енергетичного комплексу. Хлоридна кислота застосовується в хімічній, медичній, харчовій промисловості, кольоровій та чорній металургії. Виробництво синтетичної хлоридної кислоти освоєно в 1962 році. За період експлуатації проводився ремонт, удосконалилося технологічне обладнання. Висока якість сировини дозволяє отримувати кислоту високої якості. Соляну кислоту виготовляють двох марок: А і Б. За фізико-хімічними показниками технічна синтетична соляна кислота повинна відповідати нормам, зазначеним у таблиці 1.
У кислоті, що поставляється для травлення металів, масова частка заліза і залишку після прожарювання не нормується. За погодженням із споживачем допускається в кислоті обох марок масова частка хлористого водню не менше 30%. Соляна кислота випускається наступних сортів: технічна (27,5% НС1); синтетична (31% НС1), інгібіторна (20% НС1) і реактивна (35-38% НС1, щільність при 20 ° С дорівнює 1,17 - 1,19 г/см3). Хлоридну кислоту застосовують для одержання хлоридів різних металів, органічних напівпродуктів і синтетичних барвників, оцтової кислоти, активованого вугілля, різних клеїв, гідролізного спирту, в гальванопластиці. Її застосовують для травлення металів, очищення різних посудин, обсадних труб свердловин від карбонатів, оксидів та ін забруднень. У металургії кислотою обробляють руди, в шкіряної промисловості - шкіру перед дубленням і фарбуванням. Хлоридна кислота також застосовується у виробництві пластмас, отрутохімікатів, в електротехнічній, текстильній, харчовій промисловості, в медицині і т.д. Хлоридна кислота відіграє важливу роль в процесах травлення, вона є складовою частиною шлункового соку. Розведену хлоридну кислоту призначають всередину головним чином при захворюваннях, пов'язаних з недостатньою кислотністю шлункового соку.
1.2 Характеристика вихідної сировини у виробництві хлоридної кислоти 1.2.1 Хлор Проста речовина хлор за нормальних умов - отруйний газ жовтувато-зеленого кольору, з різким запахом. Молекула хлору двоатомна (формула Cl2). Хлор дуже активний - він безпосередньо взаємодіє майже з усіма елементами періодичної системи. Тому в природі він зустрічається тільки у вигляді сполук у складі мінералів: Галіта NaCI, Сільвіна KCl, сильвініту KCl • NaCl, бішофіту MgCl2 • 6H2O, карналіту KCl • MgCl2 • 6Н2O, каїніту KCl • MgSO4 • 3Н2О. Найбільші запаси хлору містяться в складі солей вод морів і океанів (вміст у морській воді 19 г / л). Розчини хлоридів - обов'язкова складова частина живих організмів. В організмі людини і тварин хлор міститься в основному в міжклітинних рідинах (у тому числі в крові) і грає важливу роль в регуляції осмотичних процесів, а також в процесах, пов'язаних з роботою нервових клітин. Хлор добре розчинний у неполярних рідинах, гірше - у воді. У концентрованих розчинах NaCl розчинність С12 в кілька разів нижче, ніж у воді. У водному розчині хлору встановлюється рівновага: Cl2 + H2O → HClO + Cl-+ H+ Газоподібний хлор відносно легко зріджується. Починаючи з тиску в 0,8 МПа (8 атмосфер), хлор буде рідким вже при кімнатній температурі. При охолодженні до -34 ° C хлор теж стає рідким при нормальному атмосферному тиску. Рідкий хлор - жовто-зелена рідина, що має дуже високу корозійну дією (за рахунок високої концентрації молекул). Підвищуючи тиск, можна домогтися існування рідкого хлору аж до температури +144 ° C (критичної температури) при критичному тиску 7,6 МПа. Хлор безпосередньо реагує майже з усіма металами (із деякими тільки в присутності вологи або при нагріванні), з неметалами (крім вуглецю, азоту, кисню і інертних газів) утворює відповідні хлориди. При реакції з фтором, утворюється не хлорид, а фторид. Хлор дуже сильний окисник. На світлі або при нагріванні активно реагує (іноді з вибухом) з воднем по радикальному механізму. Суміші хлору з воднем, що містять від 5,8 до 88,3% водню, вибухають при опроміненні з утворенням хлороводню. Безпосередня взаємодія водню і хлору використовується для промислового отримання хлороводню. Суміш хлору з воднем в невеликих концентраціях горить безбарвним або жовто-зеленим полум'ям. Максимальна температура воднево-хлористого полум'я 2200 ° C. З киснем хлор утворює оксиди, в яких він проявляє ступінь окиснення від +1 до +7: Cl2O, ClO2, Cl2O6, Cl2O7. Вони мають різкий запах, термічно і фотохімічно нестабільні, схильні до вибухового розпаду. Спочатку промисловий спосіб отримання хлору грунтувався на методі Шеєле, тобто реакції піролюзита з хлоридною кислотою: MnO2 + 4HCl → MnCl2 + Cl2 ↑ + 2H2O Сьогодні хлор в промислових масштабах отримують разом з гідроксидом натрію і воднем шляхом електролізу розчину кухонної солі: Анод: 2Cl-- 2е-→ Cl2 ↑ Застосовується три варіанти електрохімічного методу отримання хлору. Два з них електроліз з твердим катодом: діафрагмовий і мембранний методи, третій - електроліз з рідким ртутним катодом (ртутний метод виробництва). В ряду електрохімічних методів виробництва найбільш легким і зручним способом є електроліз з ртутним катодом, але цей метод завдає значної шкоди навколишньому середовищу в результаті випаровування і витоків металевої ртуті. В лабораторіях для отримання хлору зазвичай використовують процеси, засновані на окисленні хлороводорода сильними окисниками (наприклад, оксидом марганцю (IV), перманганатом калію, дихроматом калію): 2KmnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 ↑ +8 H2O
1.2.2 Водень Водень - перший елемент періодичної системи елементів. Атом водню найменший за розмірами і найлегший серед атомів усіх елементів. Водень - найлегший газ, він легший за повітря в 14,5 раз. Очевидно, що чим менше маса молекул, тим вище їх швидкість при одній і тій же температурі. Як найлегші, молекули водню рухаються швидше молекул будь-якого іншого газу і тим самим швидше можуть передавати теплоту від одного тіла до іншого. Звідси випливає, що водень має найвищу теплопровідність серед газоподібних речовин. Його теплопровідність приблизно в сім разів вище теплопровідності повітря. Молекула водню двоатомна – Н2. При нормальних умовах - це газ без кольору, запаху і смаку. Густина 0,08987 г/л (н.у.), температура кипіння -252,76 ° C, питома теплота згоряння 120.9 × 106 Дж / кг, малорозчинний у воді - 18,8 мл/л. Водень добре розчинний у багатьох металах (Ni, Pt, Pd і ін), особливо в паладії (850 обсягів на 1 обсяг Pd). З розчинністю водню в металах пов'язана його здатність дифундувати через них; дифузія через вуглецевий сплав (наприклад, сталь) іноді супроводжується руйнуванням сплаву внаслідок взаємодії водню з вуглецем (так звана декарбонізація). Практично не розчинний у сріблі. Рідкий водень існує в дуже вузькому інтервалі температур від -252,76 до -259,2 ° C. Це безбарвна рідина, дуже легка і текуча. Критичні параметри водню дуже низькі: температура -240, 2 ° C і тиск 12, 8 атм. Цим пояснюються труднощі при зрідження водню. Основний промисловий спосіб отримання водню - реакція з водою метану, який входить до складу природного газу. Вона проводиться при високій температурі:
Один з лабораторних способів добування водню, який іноді застосовується і в промисловості, - розкладання води струмом. Зазвичай в лабораторії водень добувають взаємодією цинку з соляною кислотою.
1.2.3 Хлороводень Хлороводень - застосовується для отримання хлоридів металів, органічних продуктів - хлоропрена, органічних барвників, гідролізного спирту, глюкози, цукру, желатина і клею; для дублення і фарбування шкір, омилення жирів; при виробництві активного вугілля, фарбуванні тканин, травленні металів; в гідрометалургійних процесах; в гальванопластиці, нафтовидобутку. Хлороводень - безбарвний газ з різким запахом. Т. плавл. -114,2 °; т. кип. -85,1 Е; густ. 1,639 г / л; тиск. парів 25,46 кгс/см2 (0 °), 45,58 кгс/см2 (20 °); коеф.розчин. у воді 485,6 (20 °), 477,2 (30 °). В повітрі утворює білий туман. Утворює ряд рідких гідратів. Сухий хлороводень на метали майже не діє.
1.3 Методи виробництва хлоридної кислоти 1.3.1 Класифікація методів виробництва хлоридної кислоти Раніше хлоридну кислоту отримували з кухонної солі дією на неї сірчаною кислотою, так званий сульфатний спосіб отримання хлоридної кислоти. При цьому кислота була низької концентрації (22-26% НС1) і містила велику кількість домішок. Сульфатний метод заснований на взаємодії твердої кухонної солі NaCl з концентрованою сірчаною кислотою H2SO4 (92-93%) при 500-550 ° С:
2NaCl + H2SO4 = Na2SO4 + 2HCl – Q (1.2)
Процес відбувається з поглинанням тепла, тому реакційну суміш необхідно нагрівати. Менш концентровану сірчану кислоту не застосовують, оскільки в цьому випадку хлороводень був би надмірно розбавлений парами води, що затруднило б отримання концентрованої соляної кислоти. Сульфатний спосіб отримання хлороводню застосовувався і застосовується тільки тоді, коли виникала потреба в сульфаті натрію. Тому в країнах і економічних районах, які мають запаси природного сульфату, зручні для розробки, сульфатний метод отримання хлористого водню не знайшов застосування. В даний час для виробництва соляної кислоти застосовують синтетичний хлороводень, що є побічним продуктом при хлоруванні органічних речовин, так званий абгазний НСІ. З синтетичного хлороводню виробляють синтетичну соляну кислоту трьох сортів, що відрізняються концентрацією і присутністю домішок таких, як H2S04, Fe і ін: відповідно до ТУ 6-01-193-80 - марку А, відповідно до Б-ТУ 6-01-193 – 70 - I сорт марки Б і відповідно до Б-ТУ 6-01-193-80 - II сорт марки Б, а також реактивну хлоридну кислоту. Щоб виключити домішки, реактивну кислоту отримують в спеціальній апаратурі з кварцу, кераміки або інших матеріалів. Кислота, що отримується з абгазів, містить 22-26% мас. НСІ, значну кількість органічних домішок і являється досить корозійно-активною. Для запобігання корозії в абгазну кислоту додають інгібітор. Застосування інгібітора дозволяє зберігати і перевозити хлоридну кислоту в звичайних сталевих ємностях і залізничних цистернах. Така кислота називається інгібованою і становить основну частина товарної хлоридної кислоти, що отримується з абгазів. Частину абгазної кислоти піддають очищенню і використовують безпосередньо на заводах для отримання чистого концентрованого (100%) хлороводню, що використовується у виробництві хлорорганічних продктів. Таким чином, у промисловості соляну кислоту отримують наступними способами: -Сульфатним;
1.3.2 Хімізм процесу адсорбції хлороводню в процесі виробництва хлоридної кислоти Виробництво соляної кислоти різної кваліфікації (реактивної, синтетичної, абгазної) полягає в синтезі хлороводню з подальшою його абсорбцією водою. При поглинанні HCl водою виникає проблема відводу тепла абсорбцією, величина якої значна і досягає 72,8 кДж / моль HCl. Цього тепла цілком достатньо, щоб утворена кислота закипіла, тому що при теплоємності 29 кДж / (кг • град) його вистачає для підвищення температури до 127 ° С. Тому в процесі абсорбції необхідний відвід тепла, в іншому випадку не вдається отримати кислоту потрібної концентрації, так як розчинність хлороводню з підвищенням температури зменшується. Залежно від способу відведення тепла методи абсорбції поділяють на ізотермічний (при постійній температурі), адіабатичний (без теплообміну з навколишнім середовищем) і комбінований. При ізотермічної абсорбції процес здійснюється з відведенням тепла, і температура кислоти підтримується постійною за рахунок безпосереднього охолодження абсорбера, чи завдяки охолодженню циркулюючої кислоти в виносному холодильнику. При цьому теоретично можна отримати соляну кислоту будь-якої концентрації, так як з пониженням температури зменшується і парціальний тиск НСІ над соляної кислотою. Ізотермічну абсорбцію слід застосовувати для одержання концентрованої соляної кислоти (35-38%) і для виробництва хлороводню низької концентрації. Однак в останньому випадку при вмісті в реакційних газах більше 40% домішок азоту, водню, метану та інших проведення абсорбції в ізотермічних умовах недоцільно зважаючи на погіршення теплопередачі і зменшення повноти абсорбції. Ізотермічну абсорбцію можна проводити в поверхнених абсорберах, де газ проходить над поверхнею нерухомої або повільно текучої рідини. Так як поверхня рідини (а отже, і массообмін) незначна, то такі абсорбери застосовують лише при невеликих масштабах виробництва. Зазвичай встановлюють каскад абсорберів. До більш досконалих типів ізотермічних поверхневих горизонтальних абсорберів відносяться зрошувальні і плас тинчаті апарати, що володіють великою поверхнею теплопередачі. Найбільш перспективними є абсорбери, що дозволяють брати з вихідного абгазу від 65-85% HCI. Адіабатична абсорбція була запропонована Гаспаряном для поглинання хлороводню водою з утворенням хлоридної кислоти і знайшла широке застосування в промисловості. При Адіабатичній абсорбції процес здійснюється без відводу тепла. Соляна кислота нагрівається до кипіння за рахунок тепла розчиненого хлороводню. При цьому збільшується тиск парів соляної кислоти і починається інтенсивне випаровування води. Останнє викликає зниження температури киплячої кислоти і зростання концентрації хлоридної кислоти, що є функцією температури.Таким чином, кипляча в адіабатичних умовах соляна кислота буде концентруватися. Температура абсорбції визначається точкою кипіння кислоти відповідної концентрації. Вихідний газ, що містить HCl вводять знизу в контактну вежу, протитечією йому надходить абсорбент (зазвичай вода). Замість води або разом з водою для зрошення колони може застосовуватися розбавлена соляна кислота. Якщо кислота є єдиним абсорбентом, ефективність абсорбції HCl дещо знижується і складає 95-99% в залежності від концентрації кислоти і тиску парів HCl. Якщо абсорбентом є вода, хлороводень може бути повністю поглинений. Концентрація хлористого водню у рідині зростає в напрямку від верху колони до низу. Відповідно до цього змінюється її температура в колоні. Максимальною є температура кипіння азеотропної кислоти (108,5 ° С). Вище і нижче цієї точки температура в колоні знижується і відповідає температурі кипіння кислоти даної концентрації. Температура і концентрація кислоти мало залежать від зміни навантаження в широких межах. Розподіл температур абсорбції і концентрацій соляної кислоти по висоті абсорбційної колони показано на рис. 1. У кожній точці колони парціальний тиск хлороводню наближається до рівноважного для системи НСІ – H2O при даній температурі. Умови абсорбції в колоні визначаються співвідношенням парціальних тисків парів води і хлористого водню.
Рисунок 1. Схема розподілу температур (крива 1) і концентрації (крива 2) соляної кислоти по висоті адіабатичного абсорберу.
Найбільш ефективно процес адіабатичної абсорбції може бути здійснено в насадках або тарілчатій колоні. Матеріалом для виготовлення колон служить поліефір, армований скловолокном, або сталь, футерована вогнетривкою цеглою або діабазовою плиткою на діабазовій замазці на двох шарах гумування. Насадочні колони заповнюються насадками різної форми. Насадки повинні володіти великою питомою поверхненою, а також бути корозіцно стійкими в солянокислому середовищі. Це можуть бути хордові насадки з графіту, пластмас, кільцеві насадки з кераміки або фарфору, сідлоподібні або блокові насадки. Найпоширенішим видом насадок є кільця Рашига, які добре зарекомендували в практичних умовах, найдешевші, прості в виготовленні і володіють достатньою питомою поверхнею. Недоліком насадок адсорберів є важкість відведення тепла в процесі абсорбції. Зазвичай використовують циркуляційне відведення тепла в виносних холодильниках.
1.3.3 Виробництво соляної синтетичної кислоти Сировиною для виробництва синтетичної хлоридної кислоти служать хлор і водень. Водень отримують в процесі виробництві каустичної соди і хлора дифрагменним, ртутним і мембранними методами. Вміст водню в технічному продукті не менше 98 об.%. Вміст кисню регламентується на рівні 0,3-0,5 %. При використанні водню, отриманого ртутним методом електролізу хлориду натрію, вміст ртуті має бути не більше 0,01 мг/м3. Для отримання синтетичної хлоридної кислоти можна використовувати абгазний хлор із стадії конденсації, електролітичний хлор, а також випаруваний хлор, склад яких приведений в табл. 1.
Таблиця 2 - Склад хлору(в об. %)
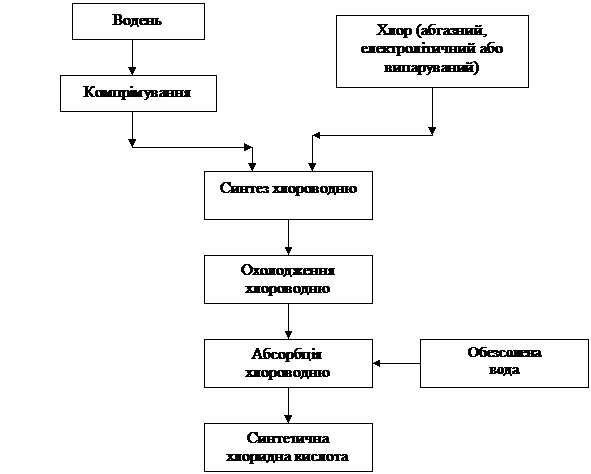
Для абсорбції хлороводню використовується обезсолена вода, в виробництві кислоти низчих сортів можливе застосування промислової води. Принципіальна схема виробництва наведена на Рис. 2. Виробництво синтетичної соляної кислоти складається із наступних стадій: 1) компрімуванння водню; 2) синтез хлороводню; 3) охолодження хлороводню; 4) абсорбція хлороводню з отриманням соляної кислоти і розлив її в цистерни, поліетиленові бочки, бутилі.
Рисунок 2-Принципіальна схема отримання хлоридної кислоти 1 – вогнеприпинювач; 2 – піч синтезу НСІ; 3 – холодильник; 4 – ізотермічні абсорбери; 5 – ємкість хлоридної кислоти; 6 – санітарна колона; 7 – насос. Рисунок 3 - Схема виробництва синтетичної хлоридної кислоти: Синтез хлороводню із хлору і водню ведуть в печі синтезу -вертикальному циліндричному зварному апараті, виготовленому із нержавіючої сталі 1Х18Н9Т. Піч має спеціальну горілку, опорну конструкцію, смотровий і запальний люки і люк для огляду. Днище печі футеровано діабазом. При діаметрі печі 2 м і висоті приблизно 10 м продуктивність печі 20 т/добу. Смотрові люки призначені для спостереження за кольором полум'я, а запальні – для розжигу печі, який проводять спеціальною горілкою, приєднаною до водневого комплектора резиновим шлангом. Тільки після загорання водню в основній горілці в піч синтезу подають хлор. Синтез хлороводню йде енергічно з великим виділенням тепла і утворенням яскравого полум'я. Всі печі синтезу працюють в водневому режимі, який виключає проскок хлору в хлороводні. Співвідношення СІ2 : Н2 = 1:1,03-1,1. В печі підтримується підвищений тиск (не більше 3•105 Па), що виключає підсмоктування повітря, завдяки чому виключається також утворення в печі вибухонебезпечних сумішей водню і кисню. Перед пуском піч і водневі комунікації продувають азотом. При пониженнні тиску водню і хлору зпрацьовує світлова і звукова сигналізація. Перед печами синтезу на лініях хлору та водню встановлені діафрагми. Витрата хлора і водню вимірюється приборами типу ДМПК-100. Вибухові мембрани виготовляють із оцинкованого заліза з паронітовою прокладкою. Печі синтезу НСІ котлонадзорні. Електричний або абагазний хлор під тиском не нижчий 1,6•105 Па(реєструється прибором) поступає по трубопроводу до печей синтезу 2. Водень попередньо компрімується і під тиском не більше 3•105 послідовно проходить водовідділювач і конденсатор для видалення води і через вогнеприпинювач 1 також поступає в піч синтезу 2. На перемичці, що з'єднує коллектор нагнітання і коллектор всмоктуючий лінії водню, встановлений регулюючий клапан, який зкидає надлишок водню з лінії нагнітання на лінію всмоктування копресора, тим самим підтримуючи постійний тиск водню на лінії подачі. Із печі синтеза 2 виходить хлороводень при температурі 450ºС, який охолоджується в трубопроводі за рахунок природної теплопередачі в навколишнє середовище і направляється в ігуритовий холодильник 3, встановлений по одному на піч. В холодильнику 3 газ охолоджується до температури 30-45ºС промисловою водою і далі по трубопроводу направляється в ізотермічні абсорбери 4I і 4II (по дві на кожну піч). Через один із штуцерів в ізотермічний абсорбер 4II подається обезсолена вода, через інший – вода на охолодження абсорбера. Із ізотермічного абсорбера 4I газ і хлоридна кислота при температурі 20-40ºС і при концентрації не нижче 31% поступа в фазорозділювач, із якого кислота далі йде в спільний кислотний коллектор і в ємності-сховища 5, а газ направляється в абсорбер 4II, де утворюється розбавлена хлоридна кислота. Ця кислота йде на зрошення абсорбера 4I , а газ - в хвостову колону 6, де відбувається остаточна відмивка газу від хлороводню. Стічні води, що містять 0,1-0,3% НСІ, зливають в кислу каналізацію і далі- на станцію нейтралізації кислих стоків. Інертні гази(азот, водень, діоксид вуглецю) викидають в атмосферу. Із ємностей–сховищ 5 соляна кислота поступа в розливну трубу і розливається в бутилі, поліетиленові бочки та іншу тару. Бутилі для соляної кислоти проходять наступну обробку: спочатку їх встановлюють на піддоні і промивають водою, нагрітою паром в пароводозмішувачі, а потім вони поступають у відділ для упаковки їх в обрешітки, звідки направляються у відділ розливу хлоридної кислоти. Схема виробництва хлоридної кислоти наведена на Рис. 3. Допоміжне обладнання має наступну характеристику. Вогнеприпинювач- стальний, зварний, вертикальний циліндричний аппарат з привареним сферичним днищем і з'ємній кришці на болтах. Заповнений насадкою із гравію із зернами 3-4 мм. Холодильник ігуритовий, протиточний пластинчатий. Поверхня теплообміну 10-22 м2 . Ізотермічний холодильник – із просоченого графіту – протиточний, пластинчатий. Поверхня теплообміну 11 м2. Хвостова колона – вертикальний циліндричний аппарат, захищений діабазовою плиткою по гумуванню. Ємність для соляної кислоти (50 м3) – зварна циліндрична з приварним сферичним днищем і з'ємною сферичною кришкою на болтах. Ємність футерована діабазовою плиткою на діабазовій замазці в два шари по гумуванню.
МЕТОДИ АНАЛІЗУ ХЛОРИДНОЇ КИСЛОТИ 2.1Загальні вказівки з проведення аналізу При проведенні аналізу температура повітря повинна складати (20 ± 5) ° С. 2.2 Визначення зовнішнього вигляду хлоридної кислоти
2.3 Визначення масової частки хлористого водню
2.3.1 Апаратура, реактиви, розчини:
У попередньо зважену колбу з притертою пробкою місткістю 100 см3 і містить 20 см3 води поміщають 3 см3 аналізованої кислоти і знову зважують (результат зважування записують з точністю до четвертого десяткового знака). Розчин кількісно переносять в мірну колбу місткістю 250 см3, багаторазово обполіскують дистильованою водою, зливаючи в мірну колбу, доводять об'єм водою до мітки і перемішують. Піпеткою відбирають 20 см3 отриманого розчину соляної кислоти в конічну колбу місткістю 250 см3, додають 25 см3 води, 2-3 краплі метилового оранжевого індикатора і титрують розчином гідроокису натрію до переходу червоного забарвлення в жовту.
2.3.3 Обробка результатів
де V-об'єм розчину гідроксиду концентрації точно з (NaOH) = 0,1 моль/дм3, що пішов на титрування, см3;
2.4 Визначення масової частки заліза
2.4.1 Апаратура, розчини, реактиви:
2.4.2 Підготовка до аналізу
2.4.3 Приготування градуювальних розчинів і градуювання фотоелектроколориметру
2.5 Визначення масової частки залишку після прожарювання
де m1 - маса чашки з залишком після прожарювання, г;
2.6.4 Обробка результатів
де m - маса хлору в аналізованій соляній кислоті, знайдена по градуювальному графіком, МКТ;
2.7 Визначення масової частки миш'яку
2.7.3 Приготування розчину миш'яку концентрації 0,001 мг/см3
2.7.4 Проведення аналізу
2.8.2 Вимоги безпеки при роботі з приладом "Ртуть-101"
2.8.4 Підготовка проби
2.8.6 Обробка результатів
де - середньоарифметичне показань аналізатора при вимірюванні двох паралельних проб;
2.9 Визначення масової частки ртуті з дитізоном 2.9.1 Апаратура, розчини і реактиви:
2.9.3 Проведення аналізу
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 443. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 (2.1)
(2.1) (2.2)
(2.2)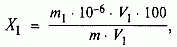 (2.3)
(2.3) (2.4)
(2.4) (2.5)
(2.5)  (2.6)
(2.6) (2.7)
(2.7)