
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Билет № 12. Работа в термодинамике. Внутренняя энергия. Первый закон термодинамики. Адиабатный процессВ термодинамике рассматривается перемещение частиц макроскопического тела относительно друг друга. При совершении работы меняется объем тела. Скорость самого тела остается равной нулю, но скорости
молекул тела меняются! Поэтому меняется и температура тела. Причина в том, что при столкновении с движущимся поршнем (сжатие газа) кинетическая энергия молекул изменяется — поршень отдает часть своей механической энергии. При столкновении с удаляющимся поршнем (расширение) скорости молекул уменьшаются, газ охлаждается. При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура. Газ, находящийся в сосуде под поршнем, действует на поршень с силой F’ = pS, где p — давление газа, S — площадь поршня. Если при этом поршень перемещается, то газ совершает работу. Предположим, что газ расширяется при постоянном давлении p. Тогда сила F’, с которой газ действует на поршень, также постоянна. Пусть поршень переместился на расстояние ∆x (рис.1). Работа газа равна: A’ = F’ ∆x = pS∆x = p∆V. – работа газа при изобарном расширении. Если V1 и V2 — начальный и конечный объём газа, то для работы газа имеем: A’ = p(V2 − V1). При расширении работа газа положительна. При сжатии — отрицательна. Таким образом: A’ = pΔV — работа газа. A= — pΔV — работа внешних сил.
Работа т/д сист. при изобарном процессе В изобарном процессе площадь под графиком в координатах p,V численно равна работе (рис. 2). Внешняя работа над системой равна работе системы, но с противоположным знаком А = — А’. В изохорном процессе объем не меняется, следовательно, в изохорном процессе работа не совершается! A=0  Любое тело (газ, жидкость или твердое) обладает энергией, даже если тело не имеет скорости и находится на Земле. Эта энергия называется внутренней, обусловлена она хаотическим (тепловым) движением и взаимодействием частиц, из которых состоит тело. Внутренняя энергиясостоит из кинетической и потенциальной энергии частиц поступательного и колебательного движений микрочастиц системы. Внутренняя энергия одноатомного идеального газа определяется по формуле: В изотермическом процессе температура постоянная, следовательно, внутренняя энергия не меняется. Тогда уравнение I закона термодинамики примет вид: Q = А’, т. е. количество теплоты, переданное системе, идет на совершение работы при изотермическом расширении, именно поэтому температура не изменяется. В изобарном процессе газ расширяется и количество теплоты, переданное газу, идет на увеличение его внутренней энергии и на совершение им работы: Q = ΔU +А’ При изохорном процессе газ не меняет своего объема, следовательно, работа им не совершается, т. е. А = 0. Уравнение I закона имеет вид Q = ΔU (переданное количество теплоты идет на увеличение внутренней энергии газа). Адиабатным называют процесс, протекающий без теплообмена с окружающими телами. Пример теплоизолированного сосуда — термос. При адиабатном процессе Q = 0, следовательно, газ при расширении совершает работу за счет уменьшения его внутренней энергии, следовательно, газ охлаждается, А’= — ΔU. Если заставить газ совершить достаточно большую работу, то охладить его можно очень сильно. Именно на этом основаны методы сжижения газов. И наоборот, в процессе адиабатного сжатия будет А’ < 0, поэтому ∆U > 0: газ нагревается. Адиабатное нагревание воздуха используется в дизельных двигателях для воспламенения топлива Практически все реальные процессы происходят с теплообменом: адиабатические процессы — это редкое исключение. Наглядные примеры адиабатных процессов: 1. В закрытом пробкой с продетым шлангом насоса сосуде находится капельки воды. После нагнетания в сосуд определенно количества воздуха, пробка быстро вылетает и в сосуде наблюдается туман (рис.). 2. В закрытом подвижным поршнем цилиндре находится небольшое количество топлива. После быстрого нажатия на поршень топливо воспламеняется.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 3518. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
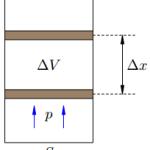 Рис. 1. A’ = p∆V
Рис. 1. A’ = p∆V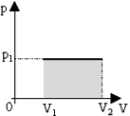
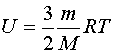 Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. Существует два способа изменения внутренней энергии: теплопередача и совершение механической работы(например, нагревание при трении или при сжатии, охлаждение при расширении).
Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. Существует два способа изменения внутренней энергии: теплопередача и совершение механической работы(например, нагревание при трении или при сжатии, охлаждение при расширении).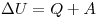 , где ΔU— изменение внутренней энергии, Q — количество теплоты, переданное системе, А— работа внешних сил. Если система сама совершает работу, то ее условно обозначают А’. Тогда закон сохранения энергии для тепловых процессов, который называется первым законом термодинамики, можно записать так:
, где ΔU— изменение внутренней энергии, Q — количество теплоты, переданное системе, А— работа внешних сил. Если система сама совершает работу, то ее условно обозначают А’. Тогда закон сохранения энергии для тепловых процессов, который называется первым законом термодинамики, можно записать так: 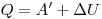 ( количество теплоты, переданное системе, идет на совершение системой работы и изменение ее внутренней энергии).
( количество теплоты, переданное системе, идет на совершение системой работы и изменение ее внутренней энергии).