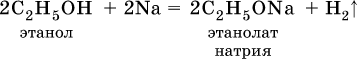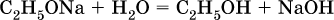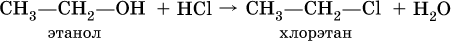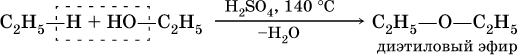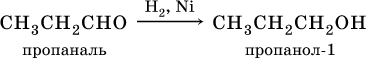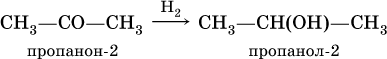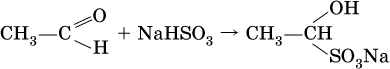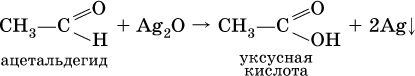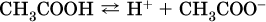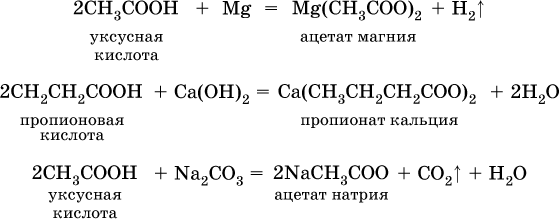Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Контрольный тест по теме «Гидроксиды» ⇐ ПредыдущаяСтр 3 из 3
1.Для различных сред выберите соответствующее окрашивание индикатора: кислая метиловый оранжевый – оранжевый, нейтральная метиловый оранжевый – желтый, щелочная метиловый оранжевый – красный, фенолфталеин – малиновый, фенолфталеин - бесцветный.
2. Выберите название кислоты, соответствующей следующему описанию: кислородсодержащая, трёхосновная, растворимая, нелетучая, стабильная - кремниевая -азотистая -фосфорная -угольная 3. Соотнесите свойства кислот и соответствующих продуктов реакции Взаимодействие с основаниями = СаCl2 +СО2 + H2О Реакция с оксидами металлов = Zn SO4 + H2 Взаимодействие с металлами = КNO3 + H2О Реакция с солью = MgSO4 + H2О ? + ? = Cu (NO3)2 + H2О ? + ? = AgCl + HNO3 4.Выберите способ получения гидроксида железа (III) Fe2 (SO4)3 + KOH = Fe + H2О = Fe 2O3 + H2О = FeCl3 + Cu (OH)2 = 5.Соотнесите формулы оксидов и соответствующие им названия кислот и оснований: N2O серная кислота Li2O гидроксид железа (III) SO2 азотная кислота Fe2O3 гидроксид лития ? сернистая кислота ? гидроксид железа (II) 6. Выберите названия классов веществ, с представителями которых взаимодействуют щелочи: оксиды металлов (основные) оксиды неметаллов (кислотные)
кислоты соли (растворимые) 
Лабораторная работа № 3 «Химические свойства металлов и неметаллов» Цель лабораторной работы:рассмотреть положение элементов металлов и неметаллов в Периодической системе химических элементов, изучить их химические свойства на примере отдельных представителей, осваивать технику проведения химического эксперимента. Теоретическая часть Металлические свойства элементов определяются способностью атомов при взаимодействии частично или полностью смещать электрон- ные облака к другим атомам или «отдавать» электроны, т е. проявлять при взаимодействии с атомами других элементов восстановительные свойства. К самым активным металлам относятся элементы с низкой энергией ионизации и низкой электроотрицательностью, с максимально большим радиусом атома и малым числом электронов на внешнем слое. Расположение металлов и неметаллов в периодической таблице 1A 8A H 2A 3A 4A 5A 6A 7A He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn – металлы; – амфотерные металлы; – неметаллы; Металлические свойства уменьшаются Металлы расположены в 1 и 2 группах, а также образуют побочные подгруппы 3–8 групп. Металлы в основном располагаются в левой части периодической системы. По мере заполнения наружной электронной оболочки число электронов на внешнем слое у атомов элементов растет, а радиус атомов уменьшается, поэтому они в большей степени стремятся присоединять электроны, а не отдавать их. В связи с этим в периоде металлические свойства у элементов уменьшаются, а неметаллические свойства – увеличиваются. Металлы, имея больший радиус, характеризуются более низкими значениями энергии ионизации, сродства к электрону и электроотрицательности по сравнению с атомами неметаллов. Поэтому у металлов преобладают восстановительные свойства, т. е. способность атомов отдавать электроны. Особенно ярко восстановительные свойства выражены у атомов металлов I и II групп главных подгрупп или у s-элементов. Самый сильный восстановитель – франций, а в водной среде – литий, за счет более высокого значения энергии гидратации. Свойства металлов по отношению к кислороду, воде и кислотам представлены в таблице 2. Кислородные соединения металлов проявляют основные свойства. Металлы при взаимодействии с кислородом (прямом или косвенном) образуют основные оксиды, гидроксиды которых проявляют основные свойства: Металл (Ме) → основной оксид (МехОу) → гидроксид или [Ме(ОН)х] основание Mg → MgО → Mg(OH)2 2 Mg + O2 = 2 MgO; MgO + H2O = Mg(OH)2 Оксид и гидроксид магния проявляют основные свойства, поэтому могут взаимодействовать с кислотными оксидами и с кислотами, например: MgO + SO3 = MgSO4; MgO + H2SO4 = MgSO4 + H2O Mg(OH)2 + N2O5 = Mg(NO3)2 + Н2О Mg(OH)2 + 2 НС1 = MgС12 + 2 Н2О
Неметаллические свойства элементов определяются способностью атомов «принимать» электроны, т.е. проявлять при взаимодействии с атомами других элементов окислительные свойства. К неметаллам относятся элементы с большой энергией ионизации, большим сродством к электрону и минимально возможным радиусом атома. Число неметаллов, известных в природе по сравнению с металлами относительно невелико. Из всех элементов с неметаллическими свойствами обладают 22 элемента, остальные элементы характеризуются металлическими свойствами. Ряд элементов проявляет амфотерные свойства. Неметаллы в основном располагаются в правой верхней части периоди-ческой системы. По мере заполнения наружной электронной оболочки число электронов на внешнем слое у неметаллов растет, а радиус уменьшается, поэтому они в большей степени стремятся присоединять электроны. В связи с этим неметаллы характеризуются более высокими значениями энергии ионизации, сродства к электрону и электроотрицательности по сравнению с атомами металлов и поэтому у них преобладают окислительные свойства, т.е. способность атомов присоединять электроны. Особенно ярко окислительные свойства выражены у атомов неметаллов 6 и 7 групп второго и третьего периодов. Самый сильный окислитель – фтор. Оксиды неметаллов относят к кислотным оксидам, которым соответствуют кислоты. С водородом неметаллы образуют газообразные соединения (например HCl, H2S, NH3). Водные растворы некоторых из них (например, галогеноводородов) – сильные кислоты. С металлами типичные неметаллы дают соединения с ионной связью (например, NaCl). Неметаллы могут при определенных условиях между собой реагировать, образуя соединения с ковалентной полярной (H2O, HCl) и неполярной связями (CO2). С водородом неметаллы образуют летучие соединения, как, например, фтороводород HF, сероводород H2S, аммиак NH3, метан CH4. При растворении в воде водородные соединения галогенов, серы, селена и теллура образуют кислоты той же формулы, что и сами водородные соединения: HF, HCl, HCl, HBr, HI, H2S, H2Se, H2Te. При растворении в воде аммиака образуются аммиачная вода, обычно обозначаемая формулой NH4OH и называемая гидроксидом аммония. Ее также обозначают формулой NH3 • H2O и называют гидратом аммиака. С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы (например, SO2, N2O5), а других – более низкую (например, SO2, N2O3). Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления. Например, азотная кислота HNO3 сильнее азотистой HNO2, а серная кислотаH2SO4 сильнее сернистой H2SO3. Самые типичные неметаллы имеют молекулярное строение, а менее типичные – немолекулярное. Этим и объясняется отличие их свойств.
Практическая часть Опыт 1. Получение металлов Каждый металл вытесняет из растворов солей все другие металлы, и расположенные в электрохимическом ряду активности металлов (ряд напряжений металлов) правее его. Это свойство используется для получения многих металлов. Приготовить три пробирки. В первую пробирку внести 20 капель раствора сульфата меди (II), во вторую – столько же раствора сульфата кадмия, в третью – нитрата свинца (II). В каждую пробирку опустить по одной грануле цинка. Наблюдать протекание реакций с выделением меди, кадмия и свинца на поверхности цинка. В отчете записать уравнения реакций, указать в каждой окислитель и восстановитель, составить электронные схемы окисления и восстановления
Опыт 2. Получение и свойства оксидов 1. Получение оксида магния. Серебристо-белый легкий металл магний при 500 ºС вспыхивает и быстро сгорает ослепительно ярким пламенем. Горение сопровождается излучением света и выделением большого количества тепла. На сильном выделении света при горении магния основано его применение для изготовления осветительных ракет и в фотографии (магниевая вспышка). Образующийся оксид MgO (жженая магнезия) применяется в медицине как средство от изжоги, как сорбент и катализатор, он входит в состав огнеупорных изделий. Взять щипцами небольшой кусочек стружки магния и поджечь его пламенем спиртовки. Горящий магний держать над фарфоровой чашкой. В чашку с образовавшимся оксидом магния добавить несколько миллилитров воды, размешать стеклянной палочкой и определить среду раствора индикатором фенолфталеином или универсальной индикаторной бумагой. В отчете описать опыт, составить уравнения реакций горения магния и взаимодействия оксида магния с водой, объяснить среду раствора и сделать вывод о химической природе оксида магния. Опыт №3. Получение оксида хрома (III) разложением соли Темно-зеленый оксид хрома Cr2O3 получают разложением гидроксида хрома (III) или хромосодержащих солей. Он применяется в качестве пигмента, катали-затора, полирующего материала, вводится в стёкла для их окраски. В фарфоровую чашку поместить небольшой горкой кристаллический дихромат аммония и ввести в центр горки горящую спичку. Наблюдать разложение соли, которое вначале идет медленно, а затем убыстряется. Схема реакции: (NH4)2Cr2O7 → Cr2O3 + N2↑ + 4H2O↑ Описать опыт и указать, какое природное явление он напоминает в уменьшенном масштабе. Переписать схему реакции, составить к ней электронные схемы окисления и восстановления, определить стехиометрические коэффициенты перед веществами и тип реакции. Опыт №4 Получение СО2 в аппарате Киппа Оксид углерода (IV) – углекислый газ – содержится в небольшом количестве в атмосфере (0,03 %) и в растворенном виде в некоторых минеральных источниках. В технике его получают прокаливанием известняка по реакции: CaCO3 → CaO + CO2↑, а в лабораториях – разложением мрамора соляной кислотой в аппарате Киппа по уравнению: CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ Главным потребителем углекислого газа является пищевая промышленность: производство сахара, пива, газированной воды. Он применяется также в качестве хладоагента (сухой лед), для тушения пожаров и в качестве нагнетающего газа для перекачки легковоспламеняющихся жидкостей. В химической промышленности диоксид углерода используется при получении кальцинированной соды – карбоната натрия Na2CO3. В течение примерно трех минут большую пробирку наполнять углекислым газом из аппарата Киппа, затем внести в неё 10–15 капель раствора NaOH, тотчас закрыть пробирку смоченным водой большим пальцем и встряхнуть, после чего пробирка свободно повисает на пальце. Углекислый газ взаимодействует со щелочью, в результате чего в пробирке образуется вакуум и внешнее давление прочно прижимает ее к пальцу. Эту реакцию применяют в промышленности для удаления СО2 из газовых смесей. Углекислый газ тяжелее воздуха, поэтому его можно «переливать», как воду. В течение примерно трех минут заполнять углекислым газом химический стакан емкостью 100 мл. Затем «перелить» газ во второй стакан и опустить в него горящую лучинку. Пламя гаснет, так как углекислый газ не поддерживает горения. В отчете нарисовать аппарат Киппа (рис. 1) и описать принцип его действия. Написать уравнение реакции получения углекислого газа и его взаимодействия с NaOH. Сделать вывод о химической природе этого оксида.
Оформить отчет по лабораторной работе и сдать на проверку преподавателю, сделать общий вывод по лабораторной работе.
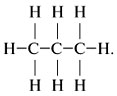
Практическая работа №4 «Составление структурных формул различных органических веществ, формул изомеров углеводородов» Цель практической работы:изучить различные типыС-С-цепи, способы их соединения, кратность связей, примеры гибридизации и конформации углеродных цепей, научиться составлять формулы различных классов органических веществ и изомеров. Теоретическая часть Алгоритм 1.1. Составление полных и кратких структурных формул углеводородов Задание. Составить полную и краткую структурные формулы пропана С3Н8. Решение: 1. Записать в строчку 3 атома углерода, соединить их связями: С–С–С. 2. Добавить черточки (связи) так, чтобы от каждого атома углерода отходило 4 связи:
3. Записать краткую структурную формулу: СН3–СН2–СН3
Алгоритм 1.2. Составление формул изомеров Задание. Составить формулы изомеров пентана С5Н12. Решение: 1. Записать углеродные скелеты изомеров, уменьшая число атомов углерода в основной цепи, таким образом разветвляя углеродную цепь:
2. Расставить атомы водорода и представить структурные формулы в сокращенном виде: С5Н12
Алгоритм 1.3. Составление формул гомологов Задание. Составить формулы двух гомологов для вещества, имеющего строение:
Решение: 1. Составляя формулы гомологов, увеличиваем или уменьшаем число групп СН2 в основной цепи, сохраняя строение (разветвление). Приведены два низших гомолога: Практическая часть Задание 1. Назвать органические соединения по их структурным формулам. 1.СН4 2. С6Н14 3. С5Н12 4. С2Н6 5. С10Н22 6. С2Н2 7. С4Н6 8. С3Н4 9. С6Н10 10. С9Н16 Задание 2. Назвать органические соединения по их структурным формулам и расставить недостающие атомы водорода. 1. С—С—С—С—С 2. С — С ═ С ─ С─С 3. С — С─С ═ С ─ С─С 4. С — С─С ═ С─С─С 5. С ═С ─С ═ С─С 6. С ─С─С ≡С─С─С─С 7. С—С—С—С=С- 8. С—С—С—С—С—С—С Задание 3. По названию органических соединений составить структурные формулы: 1) 2 - метил- бутан 2) 1,2,3- три- метил- циклопропан 3) 2,3- ди- метил- пентан 4) 2,4,6 - три –метил- октан 5) 2- метил – 4-этил – гексан 6) 2,2 – диметил-гептен-3 7) 3-метилгексадиен-2,4 8) 4,4-диметилпентин-2 9) 5-метил-3-гексен-2 10) 2-метилгексадиен-1,5
Задание 4. Осуществить следующие превращения: 1. C → CH4 → CH3CI → C2H6→ C2H5CI 2. СН4→ СН3CI→ C2H6→ C2H5CI→ C3H8 3. С→ СН4→ CH3CI→ C2H6→ C2H4→ C2H5ОН Контрольные вопросы: 1.Какие органические соединения называются углеводородами? 2.Какие углеводороды называются непредельными? 3. Назовите первые пять представителей гомологического ряда непредельных углеводородов исходя из общей формулы. 4. Какие углеводороды называются предельными? 5. Как даётся название непредельным углеводородам? 6. В чём сходство и различие предельных и непредельных углеводородов? 7. Какие вещества называются гомологами? Привести пример. 8. Что такое радикалы? 9. Какие виды изомерии существуют у непредельных углеводородов?
Практическая работа №5 «Химические свойства углеводородов» Цель практической работы: закрепление теоретических знаний об углеводородах, их строении, получении и химических свойствах. Формирование навыков лабораторного эксперимента. Оборудование и реактивы: штатив с пробирками, пробиркодержатель, пробка с газоотводной трубкой, спиртовка, спички; парафин (С17Н36), растворы кислоты (HCl), щелочи (NaOH), окислителей – перманганат калия (KMnO4) и бромная вода (Br2), смесь этилового спирта (С2Н5ОН) с серной кислотой(Н2SO4) конц., прокаленный песок, карбид кальция (СаС2), вода (Н2О).
Теоретическая часть Алканами называются углеводороды с одинарной связью между углеродными атомами. Предельные углеводороды являются инертными и с трудом вступают в химические взаимодействия из –за насыщенности внутримолекулярных связей. Алкенами называются углеводороды с двойной связью между соседними атомами углерода. Алкинами называются углеводороды с тройной связью между соседними углеродными атомами. Алкены и алкины являются непредельными углеводородами. Благодаря кратным связям, входящим в состав непредельных углеводородов, эти углеводороды являются более реакцеспособными: для них характерны реакции присоединения по месту разрыва кратных связей.
Опыт 1. Получение метана (реакция Дюма) и изучение его свойств В ступке тщательно растирают обезвоженный ацетат натрия с натронной известью (массовое соотношение 1:2). Смесь помещают в пробирку (высота слоя 8–10 мм), закрывают пробкой с газоотводной трубкой (рис.1) и закрепляют в пробиркодержателе. В штатив ставят две пробирки. В одну пробирку наливают 2—3 мл раствора перманганата калия, в другую — 2 мл бромной воды. Рис.1. Прибор для получения метана: 1 – пробирка с реакционной смесью, 2 – вата, 3 – газоотводная трубка, 4 – пробирка с раствором. В пробиркодержателе закрепляют пробирку с содержимым и равномерно нагревают всю пробирку, а затем ту часть, где находится основное количество смеси. Конец газоотводной трубки поочередно вводят в предварительно подготовленные растворы перманганата калия и бромной воды. Пропускание газа проводят в течение 20–30 с. Растворы не изменяют своей окраски, что свидетельствует о том, что метан при комнатной температуре не окисляется и не способен вступать в реакции присоединения. Газоотводную трубку переворачивают вверх и поджигают газ. Метан горит несветящимся голубоватым пламенем. При внесении фарфоровой чашки в пламя сажа на ней не образуется. После охлаждения пробирки к ее содержимому добавляют 1–2 капли концентрированной соляной кислоты. Наблюдают характерное «вскипание» — качественная реакция на карбонаты – в данном случае побочный продукт получения метана из ацетата натрия. Если быстро соединить пробирку с газоотводной трубкой и опустить ее в заранее приготовленную пробирку с 2–3 каплями насыщенного раствора гидрата окиси бария Ba(OH)2, можно заметить помутнение баритовой воды вследствие выделения белого осадка карбоната бария. Напишите уравнения проведенных реакций, в том числе и горения метана. Почему метан горит без образования сажи?
Опыт 2. Получение этилена и его химические свойства В сухую пробирку наливают 1 мл этанола и осторожно 2 мл концентрированной серной кислоты, помещают несколько крупинок окиси алюминия Al2O3 или сухого песка, закрывают пробкой с газоотводной трубкой (см. рис.1). Этанол при смешивании с серной кислотой образует этилсульфат: CH3-CH2-OH + HO-SO3H → CH3-CH2-O-SO3H + H2O кислый этиловый эфир серной кислоты Смесь осторожно нагревают, не допуская сильных толчков реакционной смеси и получают этилен С2Н2.
Так же, как в опыте 1, изучают взаимодействие этилена с растворами бромной воды и перманганата калия (реакция Вагнера). Выделяющийся этилен моментально обесцвечивает бромную воду, а фиолетовый раствор перманганата калия почти мгновенно исчезает и появляется бурый осадок оксида марганца (IV). После всех реакций газоотводную трубку переворачивают вверх и поджигают этилен. Он горит светящимся желтоватым пламенем. При внесении в пламя фарфоровой чашки на ней образуется черное пятно. Это объясняется неполным окислением этилена при горении на воздухе, вследствие большего процентного содержания углерода в молекуле. Запишите все реакции и расставьте коэффициенты в последних двух уравнениях реакций, составьте уравнение полного сгорания этилена.
Опыт №3 Получение ацетилена и изучение его свойств В пробирку помещают небольшой кусочек карбида кальция СаС2 и приливают 1 мл воды. Пробирку закрывают пробкой с газоотводной трубкой (см. рис.1), и выделяющийся ацетилен пропускают через заранее приготовленные растворы: бромной воды, перманганата калия, аммиачного раствора хлорида меди (I). При пропускании ацетилена через насыщенную бромную воду наблюдают постепенное ее обесцвечивание. При окислении ацетилена перманганатом калия фиолетовая окраска исчезает и появляется осадок оксида марганца (IV) бурого цвета Терминальные ацетиленовые углеводороды способны обменивать свои кислые протоны на металлы с образованием солей — окрашивание в красный цвет раствора с дальнейшим выпадением красно-бурого осадка ацетиленида меди (I). Ацетиленид меди образуется только в присутствии аммиака (практически берется аммиачный раствор однохлористой меди). Аммиак необходим для связывания выделяющегося при реакции хлористого водорода. Реакция эта очень чувствительна, ее применяют для открытия следов ацетилена в воздухе цехов промышленных предприятий, использующих ацетилен. Ацетилениды требуют осторожного обращения. В высушенном виде они очень опасны, так как взрываются при ударе или нагревании. Так же, как и в предыдущих опытах, изучают горение ацетилена на воздухе. Он горит коптящим пламенем После проведения опыта в пробирку, в которой получали ацетилен, добавляют каплю фенолфталеина. Появляется малиновое окрашивание —качественная реакция на присутствие щелочей — в данном случае побочный продукт получения ацетилена из карбида кальция. Объясните, почему ацетилен взаимодействует с бромом значительно медленнее, чем этилен? Напишите уравнение получения ацетилена и расставьте коэффициенты в уравнениях реакций, составьте уравнение полного сгорания ацетилена. Оформите отчет по практической работе и сдайте на проверку преподавателю.
Лабораторная работа № 4 «Качественное определение органических веществ» Цель лабораторной работы: научиться определять углерод, водород, хлор в органических соединениях Реактивы:парафин, оксид меди (II), сульфат меди (II), известковая вода, медная проволока, хлороформ. Посуда и оборудование:лабораторный штатив (или проборкодержатель), пробирки, пробка с газоотводной трубкой, спиртовка, спички, вата. Теоретическая часть За всё время существования органической химии как науки важнейшей задачей было определить структуру органических соединений. Это значит узнать, какие атомы входят в состав структуры, в каком порядке и каким образом эти атомы связаны между собой и как расположены в пространстве. Существует несколько методов решения этих задач. Элементный анализ заключается в том, что вещество разлагают на более простые молекулы, по количеству которых можно определить количество атомов, входящих в состав соединения. Этот метод не дает возможности установить порядок связей между атомами. Часто используется лишь для подтверждения предложенной структуры. Принадлежность органических веществ к определенным классам соединений, их строение, степень чистоты устанавливается с помощью элементного и функционального анализа. Качественный элементный анализ позволяет определить, из атомов каких элементов построены молекулы органического вещества: количественный элементный анализ устанавливает элементный состав соединения и простейшую формулу. Небольшое количество (~0,2 г) вещества помещают в маленькую фарфоровую чашечку. Нагревают чашечку с веществом в вытяжном шкафу – на треугольнике в кольце штатива либо в щипцах – сначала осторожно, затем сильнее и наблюдают: плавится ли вещество, улетучивается ли, горючи ли его пары, бесцветное или коптящее пламя, образуются ли при горении пары воды (конденсирующиеся на поднесенной к пламени холодной пробирке). Если вещество не улетучивается полностью, усиливают нагревание остатка до его потемнения (обугливания) и прокаливают его до последующего побеления. Дают чашечке охладиться, добавляют к остатку от прокаливания несколько капель воды, перемешивают палочкой и помещают каплю жидкости на красную лакмусовую бумажку. Если остаток не растворился в воде, то испытывают растворимость его в соляной кислоте, добавляя несколько капель кислоты при помешивании. Органические соединения, не содержащие металлов, при нагревании обычно улетучиваются или разлагаются (обугливаются), но затем при прокаливании сгорают полностью. В данном опыте обнаруживается, способно ли вещество кипеть при атмосферном давлении или плавиться без разложения. Сильно коптящее пламя горячих паров вещества указывает на высокое процентное содержание углерода, т.е. заставляет предполагать наличие кратных связей, бензольных колец или длинных углеродных цепей. Образование паров воды обнаруживает наличие водорода в молекуле вещества (см. следующий опыт). При сильном прокаливании солеобразных органических соединений, содержащих металлы (соли кислот, феноляты и т.п.), образуются нелетучие карбонаты щелочных металлов (K,Na) либо оксиды щелочноземельных металлов (Са, Ва, а такжеMg). Все эти продукты прокаливания с водой дают щелочную реакцию и полностью растворимы в соляной кислоте; наличие нерастворимого в ней остатка указывает на присутствие в испытуемом веществе тяжелых металлов. Некоторые металлоорганические соединения (например, тетраэтилсвинец) при нагревании в описанных условиях улетучивается без остатка, не разлагаясь; это характерно для веществ, содержащих металл, непосредственно связанный с углеродом органической молекулы. Экспериментальная часть Опыт № 1. Обнаружение углерода и водорода окислением оксидом меди (II) Соберите прибор, как показано на рисунке.
Смесь 1 — 2 г оксида меди (П) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди (П). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди (П). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (П). Нижний конец газоотводной трубки должен быть погружен в пробирку с свежеприготовленным раствором известковой воды (раствор гидроксида кальция) Нагрейте пробирку в течении 2-3 мин. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, пробирку с ней следует удалить (что и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(П) и не вызовут его посинения. После изменения окраски сульфата меди (П) следует прекратить нагревание. Наблюдения: – парафин окисляется в присутствии оксида меди (II). При этом углерод превращается в углекислый газ, а водород – в воду: СnH2n+2 + (3n+1) CuO → n CO2↑ + (n+1) H2O + (3n+1) Cu – выделяющийся углекислый газ взаимодействует с гидроксидом кальция, что вызывает помутнение известковой воды вследствие образования нерастворимого карбоната кальция: СО2 + Cа(OН)2 → СаCO3↓ + H2O – сульфат меди (II) приобретает голубую окраску при взаимодействии с водой, в результате чего образуется кристаллогидрат CuSO4 · 5Н2О. Вывод: по продуктам окисления парафина СО2 и H2O установили, что в его состав входят углерод и водород. Контрольные вопросы к 1 опыту: 1. Почему помутнел раствор известковой воды? Напишите уравнение реакции, считая условно формулу парафина С16Н34. 2. Почему белый порошок сульфата меди (П) стал голубым? Напишите уравнение реакции, учитывая, что безводному сульфату меди (П) присоединяется 5 молекул воды. 3.Что произошло с чёрным порошком оксида меди (П)? Сделайте выводы. Опыт №2. Качественное определение хлора в молекулах галогенопроизводных углеводородов
Прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди (П), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки. Немедленно появляется характерная зеленовато-голубая окраска пламени, так как образующиеся при сгорании летучие галогениды меди окрашивают пламя горелки. Результаты работы оформите в таблицу, ответьте на контрольные вопросы и сдайте на проверку преподавателю. Отчетная таблица
Лабораторная работа №5 «Химические свойства кислородсодержащих органических соединений» Цель практической работы:изучить химические свойства кислородсодержащих соединений. Реактивы: раствор глюкозы; раствор формальдегида, аммиачный раствор оксида серебра, горячая вода в широком стакане; раствор гидроксида натрия, уксусная кислота; раствор глицерина; раствор сульфата меди; индикаторы – фенолфталеин и метилоранж; раствор карбоната натрия или калия; стружки магния. Теоретическая часть Спирты – производные углеводородов, содержащие функциональную группу ОН (гидроксил). Спирты, в которых имеется одна группа ОН, называются одноатомными, а спирты с несколькими группами ОН —многоатомными. Химические свойства одноатомных спиртов обусловлены присутствием в них функциональной группы ОН. Водород группы ОН в спиртах может замещаться на металл:
Этанолаты и производные других спиртов (алкоголяты) легко гидролизуются:
Группу ОН в спиртах можно заместить на Cl или Br:
При действии на спирты водоотнимающих средств, например концентрированной H2SO4, происходит межмолекулярная дегидратация:
Альдегиды и кетоны – это производные углеводородов, содержащие функциональную карбонильную группу СО. В альдегидах карбонильная группа связана с атомом водорода и одним радикалом, а в кетонах с двумя радикалами. Химические свойства альдегидов и кетонов обусловлены присутствием в них карбонильной группы СО; они легко вступают в реакции присоединения, окисления и конденсации. В результате присоединения водорода к альдегидам образуются первичные спирты:
При восстановлении водородом кетонов образуются вторичные спирты:
Реакция присоединения гидросульфита натрия используется для выделения и очистки альдегидов, так как продукт реакции малорастворим в воде:
Качественная реакция на альдегидную группу – реакция «серебряного зеркала», т. е. окисление группы С(Н)O с помощью оксида серебра (I) в присутствии гидрата аммиака:
Карбоновые кислоты – это производные углеводородов, содержащие функциональную группу СООН (карбоксил). Простейшие карбоновые кислоты растворимы в воде, обратимо диссоциируют в водном растворе с образованием катионов водорода:
и проявляют общие свойства кислот:
Экспериментальная часть Опыт 1 Качественная реакция на многоатомные спирты (глицерин)
Сначала получите гидроксид меди (II). Для этого налейте в пробирку на высоту 1-1.5 см раствор сульфата меди (II) и добавьте в 2-3 раза больше раствора гидроксида натрия. Отметьте цвет осадка. Напишите уравнение реакции. Теперь прилейте примерно столько же раствора глицерина (или немного больше), сколько прилили щелочи. Запишите, что наблюдаете. Осторожно покачайте пробирку, слегка ударяя ладонью, чтобы ускорить растворение осадка. Составьте уравнение реакции. Какое вещество является реактивом на многоатомные спирты?
Опыт 2 Реакция серебряного зеркала – качественная реакция на альдегиды
В абсолютно чистую пробирку прилейте 2 мл аммиачного раствора оксида серебра. Осторожно добавьте немного раствора формалина или глюкозы, приливая по стенке пробирки. Что наблюдаете? При необходимости, поместите пробирку в стакан с горячей водой. Не встряхивайте и не перемешивайте раствор! Напишите уравнение реакции. Как называется этот реактив на альдегидную группу?
Опыт 3. Глюкоза – альдегидоспирт
а) В пробирку налейте раствор сульфата меди на высоту 1-1.5 см и добавьте в 2-3 раза больше раствора глюкозы. Затем прилейте столько же гидроксида натрия, сколько добавили глюкозы. Что наблюдаете? Как характеризует глюкозу эта реакция? б) Поместите пробирку в стакан с горячей водой и наблюдайте изменение окраски до интенсивной розово-оранжевой. Как характеризует глюкозу данная реакция?
Опыт 4. Изучение свойств карбоновых кислот
Докажите, что уксусная кислота проявляет все общие свойства кислот:
а) К раствору уксусной кислоты добавьте немного индикатора – метилоранжа. Как окрасился индикатор? О чем это говорит? Напишите уравнение диссоциации уксусной кислоты; б) В пробирку бросьте несколько стружек магния и добавьте уксусной кислоты(осторожно – реакция может идти бурно и с сильным разогревом!)Напишите уравнение реакции. в) Налейте в пробирку раствор щелочи (NaOH), добавьте индикатор – фенолфталеин и прилейте уксусной кислоты до обесцвечивания раствора. Напишите уравнение реакции. г) К 1 мл раствора карбоната натрия или калия (осторожно – возможно бурное выделение газа!) добавьте уксусную кислоту. Напишите уравнение реакции и свои наблюдения. д) Получите гидроксид меди(II), и прилейте уксусную кислоту до растворения осадка. Запишите наблюдения и уравнение реакции. Напишите вывод по опыту 4, в котором охарактеризуйте свойства уксусной кислоты. Результаты работы оформите в таблицу, ответьте на контрольные вопросы и сдайте на проверку преподавателю. Отчетная таблица
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 548. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
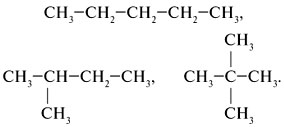
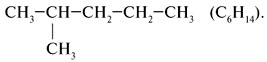
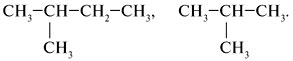


 Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлей и вставленная другим концом в держатель.
Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлей и вставленная другим концом в держатель.