
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Порядок заполнения электронных орбиталейСтр 1 из 3Следующая ⇒ Список практических работ по ОДБ.6 «Химия» гр. ЭМт-17, СЭЗ-17, РРТ-17 (10 часов практических работ + 10 часов лабораторных работ) Практическая работа № 1 «Решение задач на основные законы химии». Практическая работа №2 «Периодическая система химических элементов». Практическая работа №3 «Уравнения электролитической диссоциации, гидролиза солей» Лабораторная работа №1 «Приготовление растворов заданной концентрации» Лабораторная работа № 2 «Кислотно – основные свойства гидроксидов» Лабораторная работа №3 «Химические свойства металлов и неметаллов» Практическая работа№4 «Составление структурных формул различных органических веществ, формул изомеров» Практическая работа № 5 «Химические свойства углеводородов» Лабораторная работа№4 «Определение качественного состава органических веществ Лабораторная работа№5 «Химические свойства кислородсодержащих органических веществ» Требования безопасности:
1. Сначала прочесть инструкцию и посмотреть демонстрацию опыта, а затем приступать к работе. Работать предельно собранно и аккуратно. Убрать со столов все предметы, кроме тетрадей. 2. Тщательно продумать все свои действия. 3. Не нюхать реактивы и не пробовать их на вкус. 4. О всех непредвиденных случаях и ошибках, а также фактах пролива реактивов сразу сообщать преподавателю.
Практическая работа №1 «Решение задач на основные законы химии» Цель практической работы:формирование умений применять основные законы для вычислений по химическим уравнениям, используя алгоритм решения задач на нахождение относительной молекулярной массы, определение массовой доли химических элементов в сложном веществе.  Теоретический материал 1. Закон сохранения массы веществ: «Масса всех веществ, которые вступают в химическую реакцию, равна массе всех продуктов реакции». 2. Молярная масса вещества M выражается в г/моль. Она численно равна относительной молекулярной массеэтого вещества 3. Количество вещества где n – количество вещества, моль; m – масса вещества, г; M – молярная масса, г/моль или где V – объем вещества, л. V 4. Масса исходного вещества Объем исходного вещества 5. Молярный объем любого газа при нормальных условиях (н.у.) равен 22,4 л/моль. Алгоритм решения задач 1. Прочитайте текст задачи. 2. Запишите условие и требование задачи с помощью общепринятых обозначений. 3. Составьте уравнение реакции. 4. Подчеркните формулы веществ, о которых идет речь в условии задачи. 5. Надпишите над подчеркнутыми формулами исходные данные. 6. Рассчитайте молярные массы веществ, о которых идет речь в условии задачи. 7. Рассчитайте количество данного по условию задачи вещества. 8. Определите соотношение веществ в данной реакции (по коэффициентам). 9. Составьте пропорцию, рассчитайте количество определяемого вещества. 10. Используя формулу (3), вычислите массу исходного вещества. Используя формулу (4), вычислите объем исходного вещества. 11. Запишите ответ. Примеры решения задач Задача №1. Какая масса воды образуется при сгорании 1 г глюкозы
Решение. Составим уравнение данной реакции:
Запишем информацию, которую дает это уравнение:
1 моль 6 моль 180 г 6 х 18 = 108 г Следовательно: при сгорании 180 г при сгорании 1 г Отсюда: Ответ: при сгорании 1 г глюкозы образуется 0,6 г воды. Задача №2. Какая масса магния Mg вступает в реакцию с серной кислотой Решение. Запишем уравнение реакции и ту информацию, которую оно дает:
1 моль 1 моль 24 г 22,4 л 22,4 л 5,6 л Отсюда:
Ответ: 5,6 л Если в условии задачи даются массы или объемы двух исходных веществ, то начинать решение этой задачи следует с выяснения того, какое исходное вещество дано в избытке, а какое – в недостатке. Задача №3. Смешано 7,3 г Уравнение реакции: Решение. Определяем, какое вещество находилось в избытке, какое в недостатке. Для этого рассчитаем данное число молей
Уравнение реакции показывает, что 1 моль 1 моль 0,2 моль
Рассчитаем молярную массу
Рассчитаем, сколько граммов
Ответ: образуется 10.7 г Задания для самостоятельной работы Решите представленные задачи, используя алгоритм решения. 1. Составьте уравнение реакции горения магния и вычислите массу оксида магния 2. В реакцию с водой вступило 28 г оксида кальция 3. Рассчитайте, какая масса кислорода образуется при разложении 54 г воды. 4. Рассчитайте массу оксида меди 5. В реакцию с азотной кислотой 6. Рассчитайте объем водорода (н.у.), образующегося при разложении 54 г воды. Контрольные вопросы: 1. Как формулируется закон сохранения массы веществ? 2. Чем объясняется сохранение массы веществ в химических реакциях? 3. Что такое химическое уравнение? 4. Как называются числа перед формулами веществ в химических уравнениях? 5. Что показывают коэффициенты перед формулами веществ в уравнениях химических реакций? Задание выполните в тетради для практических работ и сдайте на проверку преподавателю. Практическая работа №2 «Периодическая система химических элементов» Цель практической работы:повторить и закрепить закономерности поведения электронов в атоме, их дуализм, понятия об орбиталях и квантовых числах, характеризующих состояние электрона в атоме, закономерности распределения электронов по орбиталям и взаимосвязь их со структурой периодической системы химических элементов (ПСХЭ) Д.И.Менделеева. Теоретическая часть Электроны в атомах обладают различным запасом энергии и двойственной природой. Это материальные частицы с очень незначительной массой, и одновременно их представляют как электромагнитные волны с определенной частотой колебаний. Электроны находятся лишь в определенных квантовых состояниях (квант – порция энергии), соответствующих значениям энергии связи с ядром. Согласно теории М.Планка испускание электромагнитных волн не непрерывно. Атомы поглощают и испускают энергию порциями – квантами. Вся совокупность сложных движений электрона в атоме описывается четырьмя квантовыми числами: главным n, побочным l, магнитным m и спиновым s. Подобно любой системе, атомы стремятся к минимуму энергии. Это достигается при определенном состоянии электронов (распределение по орбиталям), которое можно оценить на основе следующих закономерностей. Принцип Паули. В атоме не может быть двух электронов с одинаковыми значениями четырех квантовых чисел. На одной атомной орбитали не может быть более двух электронов с противоположными спинами. Соответственно существует следующий порядок заполнения электронных орбиталей (схема). Схема Порядок заполнения электронных орбиталей
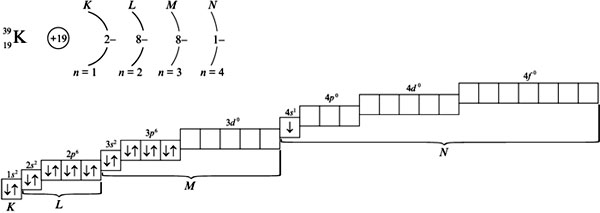
Пример. Рассмотреть применение правила Клечковского для определения распределения электронов по орбиталям в атомах калия (Z = 19) и скандия (Z = 21). Решение Предшествующий калию в ПСХЭ элемент аргон (Z = 18) имеет распределение электронов по орбиталям: при распределении электронов по орбиталям в атоме К соответственно правилу Клечковского предпочтение отдается орбитали 4s, т. к. сумма квантовых чисел n + l равна 4 + 0 = 4 (если сравнить с орбиталью 3d, то n + l = 3 + 2 = 5). Орбиталь 4s имеет меньшее значение n + l. Поэтому электронная формула калия: 1s22s22p63s23p63d04s1.
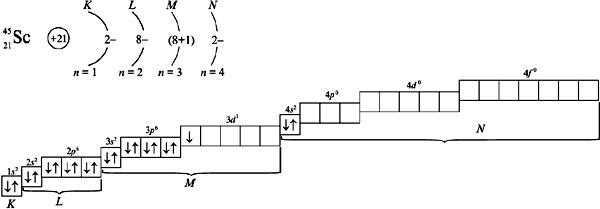
Предшествующий скандию элемент кальций (Z = 20) имеет следующее распределение электронов по орбиталям: 1s22s22p63s23p63d04s2. Из орбиталей 3d (n + l = 3 + 2 = 5) и 4p (n + l = 4 + 1 = 5) при распределении электронов в атоме Sc отдается предпочтение орбитали 3d, как имеющей минимальное значение n = 3 при одинаковых суммах квантовых чисел n + l = 5. Электронная формула атома скандия: 1s22s22p63s23p63d14s24p0.
Задание. На основании положения химических элементов в ПСХЭ и закономерностей распределения электронов по орбиталям рассмотреть особенности электронной структуры: а) атома кальция Ca; Задание 1. Определить число химических элементов в каждом периоде ПСХЭ. Задание 2. Определить число главных и побочных подгрупп в ПСХЭ. Решение
4-й период – Fe–Co–Ni, то число побочных подгрупп ... . Задание 3. Определить (по аналогии с переходными элементами) число лантаноидов и актиноидов, вынесенных в виде самостоятельных рядов вниз периодической системы. Таким образом, строгая периодичность расположения элементов в ПСХЭ полностью Электронные формулы элементов 2-го периода:
При переходе от Li к Ne заряд ядра (Z) постепенно увеличивается от +3 до +10, что вызывает увеличение сил притяжения электронов к ядру. В результате радиусы атомов в этом ряду уменьшаются.
Поэтому способность отдавать электроны, ярко выраженная у лития, постепенно ослабевает при переходе к фтору, являющемуся типичным неметаллом. Элемент фтор в реакциях присоединяет электроны. Он имеет самую высокую электроотрицательность, равную 4. Начиная со следующего за неоном элемента натрия (Na, Z = 11), электронные структуры атомов повторяются. Как следствие, внешние электронные орбитали можно представить в общем виде, где n – номер периода:
В 4-м периоде появляются переходные элементы, принадлежащие побочным подгруппам. Элементы одной и той же подгруппы имеют идентичный характер расположения электронов на внешних электронных уровнях, а принадлежащие к разным подгруппам одной и той же Выполните задания по предложенному алгоритму: 1.Для всех элементов 2 и 3-гопериодов таблицы Д. И. Менделеева приведите: а) полную электронную формулу, б) сокращенную электронную формулу, в) сокращеннуюэлектронно-графическуюформулу элемента в нормальном состоянии, г) сокращенную электроннографическую формулу элемента в ионизированном состоянии. Пример:
2.Приведите сокращенные электронно-графическиеформулы элементов25Mn и35Br в нормальном и ионизированном состояниях. Укажите сходство и различие этих элементов. 3.Приведите сокращенную электронную формулу следующих элементов: 57La,64Gd,72Hf,52Те,48Cd,88Ra. Контрольные вопросы: 1.Модель строения атома. 2.Как определить число протонов, нейтронов и электронов в атоме? Приведите пример. 3.Квантовые числа, их физический смысл. 4.Принцип Паули и следствия из него. 5.Возбужденное состояние атома. 6.Правило Хунда. 7.Изотопы и изобары. 8.Ионное состояние атомов. Практическая работа №3 «Уравнения электролитической диссоциации, гидролиза солей» Цель практической работы:закрепить и систематизировать знания учащихся об основных положениях теории электролитической диссоциации, условиях течения реакций ионного обмена до конца, типах гидролиза солей. Составлять молекулярные и молекулярно-ионные уравнения реакций между электролитами; определять тип гидролиза солей; писать уравнения гидролиза солей. Теоретический материал Растворы широко применяются в различных сферах деятельности человека. Они имеют большое значение для живых организмов. Сложные физико-химические процессы в организмах человека, животных и растений протекают в растворах.
Реакции, протекающие между ионами, называются ионными реакциями. 1)образование малорастворимых веществ (осадки), ↓
Ag+ + NO3- + H+ + Cl- → AgCl↓ + H+ + NO3- - это полное ионное уравнение
Ag+ + NO3- + H+ + Cl- → AgCl↓ + H+ + NO3-
Ag+ + Cl- → AgCl↓- это сокращенное ионное уравнение Сильные и слабые электролиты
1. Соль образована сильным основанием и сильной кислотой
слабокислая или слабощелочная
Примеры Н2S слабая кислота Na2S - Соль образована сильным основанием и слабой кислотой, подвергается гидролизу по аниону
Контрольное задание 1.Пользуясь предложенным алгоритмом составления уравнений реакций ионного обмена и гидролиза солей: 1. Составьте уравнения электролитической диссоциации для следующих электролитов: Н2СО3, Ва(ОН)2, СuSО4, Nа2НРО4, PbOHNO3, Al(OH)2Cl, Na3PO4, Li2S, H2SO3 2. Напишите полные и сокращенные ионные уравнения для следующих схем реакций: а) Ca(NO3)2 + K2CO3→ CaCO3+ KNO3 б) СuCl 2+ КОН→ Cu(OH)2 + KCl в) NН4Сl + NаОН→ NH3 + NaCl + H2O г) Zn(ОН)2+НСl→ ZnCl2 + H2O 3. Напишите молекулярные и ионные уравнения реакций между: а) гидроксидом кальция и азотной кислотой б) сульфидом натрия и соляной кислотой в) сульфатом железа (II) и гидроксидом натрия г) карбонатом натрия и серной кислотой 4. Составьте молекулярные уравнения реакций, выражаемых ионными уравнениями: а) Zn2+ + S2-→ ZnS б) H+ + OH-→ H2O в) Fe3+ + 3OH- → Fe(OH)3 г) Mg(OH)2 + H+→ MgOH+ + H2O 5. В какой цвет будет окрашен лакмус в водных растворах солей: силикат натрия, хлорид аммония, сульфид калия, нитрат натрия, хлорид железа (III), сульфат натрия. Напишите уравнения реакций гидролиза в ионной и молекулярной форме. 6. Допишите краткие ионные уравнения реакций гидролиза: а) Cr3+ + HOH ↔ … + … б) SО32- + HOH↔ …. + … в) Pb2+ + HOH ↔ … + … 2. Ответьте на контрольные вопросы: 1. Какие вещества называются электролитами, а какие - неэлектролитами? Приведите примеры. 2. Что называется электролитической диссоциацией, или ионизацией? 3. Что такое ионы? Какие ионы называются катионами, а какие – анионами? Приведите примеры катионов и анионов. 4. Что называется степенью диссоциации? От чего она зависит? 5. Какие электролиты называются сильными, а какие – слабыми? Приведите примеры сильных и слабых электролитов. 6. Что характеризует константа диссоциации? 7. Какие типы сред водных растворов вы знаете? С помощью, каких веществ можно определить характер среды раствора? 8. Что называется водородным показателем? По какой формуле можно рассчитать водородный показатель? 9. Какие реакции называются ионными? В каких случаях реакции обмена в растворах электролитов являются необратимыми (протекают до конца)? 10. Что такое гидролиз солей? 11. Типы солей и по составу. Приведите примеры.
Лабораторная работа №1 Расчет и приготовление растворов различной концентрации Цель практической работы: формирование умений приготовления растворов различной концентрации из сухой соли или более концентрированного раствора. Теоретический материал Растворы играют важную роль в живой и неживой природе, а также в науке и технике.Большинство физиологических процессов в организмах человека, животных и в растениях, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах. Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ. Растворы могут быть в газообразном (воздух), жидком и твердом (сплавы, цветные стекла) агрегатных состояниях. Чаще всего приходится работать с жидкими растворами. Содержание данного вещества в единице массы или объема раствора называется концентрацией раствора. На практике наиболее часто пользуются следующими способами выражения концентрации: 1. Массовая доля – отношение массы данного компонента в растворе к общей массе этого раствора. Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млнˉ1). Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента cодержится в 100 г раствора. 2. Массовая концентрация –отношение массы компонента, содержащегося в растворе, к объему этого раствора. Единицы измерения массовой концентрации ‑ кг/м3, г/л. 3. Титр Т– число граммов растворенного вещества в 1 мл раствора. Единицы измерения титра – г/мл, кг/см3. 4. Молярная концентрацияс – отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Единицы измерения - моль/м3, (моль /л). Раствор, имеющий концентрацию 1 моль/л, обозначают 1 М; 0,5 моль/л, обозначают 0,5 М. 5. Молярная концентрация эквивалентовсэк (нормальная концентрация) –это отношение количества вещества эквивалентов (моль) к объему раствора (л). Единица измерения нормальной концентрации моль/л. Например, сэк(KOH) = 1 моль/л, сэк(1/2H2SO4) = 1 моль/л,сэк(1/3 AlCl3) = 1 моль/л. Раствор в 1 л которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н. 6. Моляльностьb - это отношение количества растворенного вещества (в молях) к массе m растворителя. Единица измерения моляльности - моль/кг. Например, b(HCl/H2O) = 2 моль/кг. 7. Молярная доля – отношение числа молей растворенного вещества к общему числу молей вещества и растворителя. Молярная доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млн-1). Для приготовления растворов определенной концентрации, для точного измерения объемов применяют мерную посуду: мерные колбы, пипетки и бюретки. Экспериментальная часть Опыт 1.Приготовление раствора хлорида натрия с заданной массовой долей соли (%) разбавлением концентрированного раствора. Как известно, плотность – это масса вещества в единице объема, ρ = m/v. Зная плотность, можно по таблице определить массовую долю (%) раствора. Определить плотность раствора можно многими способами. Из них наиболее простой и быстрый – с помощью ареометра. Его применение основано на том, что плавающее тело погружается в жидкость до тех пор, пока масса вытесненной им жидкости не станет, равна массе самого тела (закон Архимеда). В расширенной нижней части ареометра помещен груз, на узкой верхней части – шейке - нанесены деления, указывающие плотность жидкости, в которой плавает ареометр. Концентрацию исследуемого раствора находят, пользуясь табличными данными о плотности в зависимости от концентрации раствора. Плотность водных растворов хлорида натрия приведена в таблице 1. Выполнение опыта.В мерный цилиндр наливают раствор хлорида натрия и ареометром определяют его плотность. По таблице 1 находят концентрацию исходного раствора [в % ( масс) ]. Таблица 1 – Плотность и процентное содержание растворов хлорида натрия
Рассчитывают, сколько миллилитров исходного раствора и воды следует взять для приготовления 250 мл 5% раствора. Воду отмерить цилиндром и вылить в мерную колбу объемом 250мл. Исходный раствор поваренной соли отмеряют цилиндром на 100 мл и вливают в колбу с водой. Раствор в колбе перемешивают. Цилиндр ополаскивают небольшим объемом раствора из колбы, который затем присоединяют к общей массе раствора в колбе. Проверить плотность и концентрацию полученного раствора. Рассчитать относительную ошибку δотн
где С – заданная концентрация, С1- полученная концентрация. Пример 1. Приготовить 0,5 л 20% раствора H2SO4, исходя из концентрированного раствора, плотность которого 1,84 г/см3. По таблице находим, что плотности 1,84 г/см3 соответствует кислота с содержанием 96% H2SO4, а 20% раствору соответствует кислота с плотностью 1,14 г/см3. Вычислим количества исходной кислоты и воды, требующиеся для получения заданного объема раствора. Масса его составляет 500 Вычислим, в каком объеме исходной 96% кислоты содержится 114 г H2SO4: 1 мл исходной кислоты содержит Таким образом, для приготовления 500мл 20% раствора H2SO4 необходимо взять 64,6 мл 96% раствора. Количество воды определяется как разность весов полученного исходного раствора, а именно Опыт 2. Приготовление раствора заданной концентрации смешиванием растворов более высокой и более низкой концентрации. Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации. Пример 2. Приготовить 100г 36% раствора H3PO4, смешав 44% и 24% растворы этой кислоты. Обозначим через х количество граммов 44% раствора, которое следует добавить к (100-х) граммам 24% раствора для получения 100г 36% раствора H3PO4. Составим уравнение: откуда Следовательно, необходимо взять 60г 44% раствора Выполнение опыта.Приготовить 250 мл 10 % раствора хлорида натрия, имея в своем распоряжении 15 % и 5 % раствор NaCl. Учитывая плотности приготовляемого и исходных растворов рассчитать объемы 15 % и 5 % раствора (см. пример 2). Отмерить вычисленные объемы исходных растворов, слить в колбу на 250 мл, закрыть колбу пробкой и тщательно перемешать раствор, перевернув колбу несколько раз вверх дном. Отлить часть раствора в цилиндр, измерить ареометром плотность приготовленного раствора и по табл.1 найти его концентрацию (в %). Установить расхождение практически полученной концентрации с заданной. Рассчитать относительную ошибку δотн. Опыт 3. Приготовление водного раствора хлорида натрия. определение массовой доли и расчет навески. Получить навеску соли хлорида натрия у преподавателя. При помощи воронки перенести данную навеску в мерную колбу емкостью 250 мл. Промывалкой обмыть внутреннюю часть воронки небольшим количеством воды. Растворить соль в воде. Затем, добавляя воду небольшими порциями, довести уровень воды в колбе до метки, закрыть колбу пробкой и тщательно перемешать, переворачивая вверх дном. Замерить плотность полученного раствора ареометром. Для этого раствор перелить в мерный цилиндр. Уровень жидкости должен быть ниже края цилиндра на 3-4 см. Осторожно опустите ареометр в раствор. Ареометр не должен касаться стенок цилиндра. Отсчет плотности по уровню жидкости производите сверху вниз. По таблице 1 найдите и запишите массовую долю (в %) раствора, отвечающую этой плотности. Рассчитать количество хлорида натрия взятого для приготовления 250 мл раствора. Контрольное задание: 1. Проведите расчет и приготовьте 250 мл 20% раствора KCl 2. Замерьте плотность раствора и по таблице проверьте его % концентрацию. 3. Ответьте на контрольные вопросы. 4. Отчет оформите в тетради для практических работ и сдайте на проверку преподавателю. Контрольные вопросы: 1. Что такое разбавленный раствор; концентрированный раствор? 2. Что называется массовой долей растворенного вещества? По какой формуле рассчитывается? 3. Какие еще виды концентраций растворов вы знаете?
Лабораторная работа № 2 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 397. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
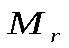 (для молекул)
(для молекул) 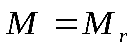 , (для атомов)
, (для атомов) 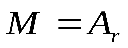 .
.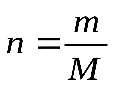 , (1)
, (1)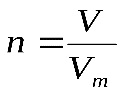 , (2)
, (2) - молярный объем, л/моль.
- молярный объем, л/моль.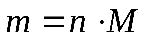 . (3)
. (3)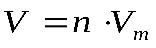 . (4)
. (4)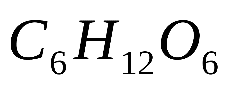 , если реакция протекает по схеме:
, если реакция протекает по схеме:
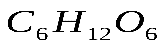 +
+ 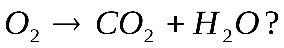
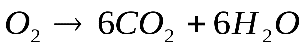
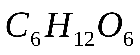 образуется 108 г
образуется 108 г 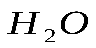 ;
;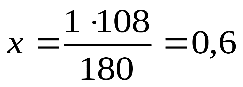
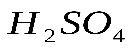 , если в результате реакции выделяется 5,6 л водорода
, если в результате реакции выделяется 5,6 л водорода 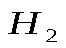 при н.у.?
при н.у.?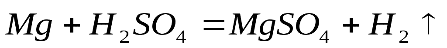
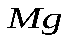 ;
;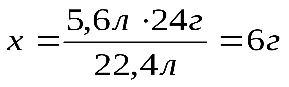
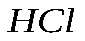 с 4,0 г
с 4,0 г  . сколько г
. сколько г 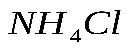 образуется?
образуется?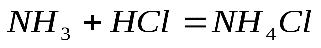
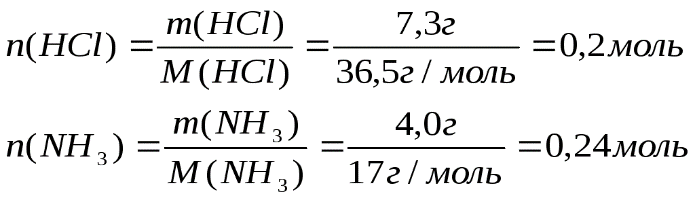
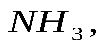 значит 0,2 моль
значит 0,2 моль 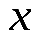 моль
моль 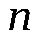 (
( 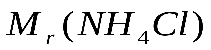 =
= 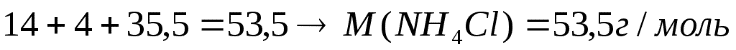 .
.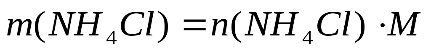 (
( 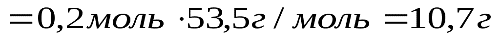
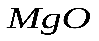 , который получится при сгорании 6 г металла.
, который получится при сгорании 6 г металла.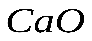 . Рассчитайте массу образовавшегося вещества.
. Рассчитайте массу образовавшегося вещества.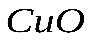 , образующегося при разложении 49 г гидроксида меди
, образующегося при разложении 49 г гидроксида меди 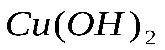 .
.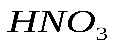 вступило 20 г гидроксида натрия
вступило 20 г гидроксида натрия 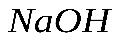 . Рассчитайте массу образовавшейся соли.
. Рассчитайте массу образовавшейся соли.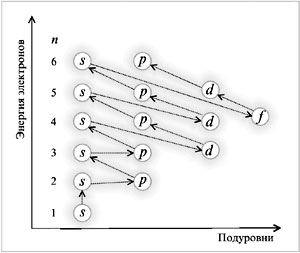
 Число главных подгрупп определяется максимальным числом электронов на s- и p-подуровнях.
Число главных подгрупп определяется максимальным числом электронов на s- и p-подуровнях.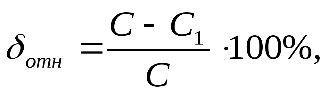
 1,14 = 570 г, а содержание в нем H2SO4 равно
1,14 = 570 г, а содержание в нем H2SO4 равно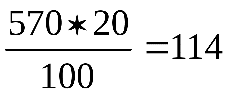 г.
г.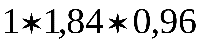 г H2SO4
г H2SO4 х мл исходной кислоты содержит 114 г H2SO4
х мл исходной кислоты содержит 114 г H2SO4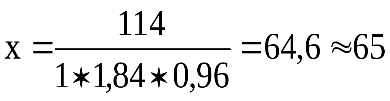 мл
мл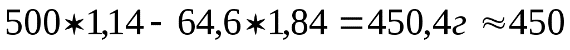 мл
мл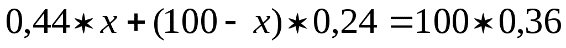
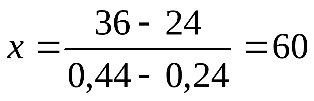
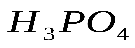 и 100 - х = 40г 24% раствора.
и 100 - х = 40г 24% раствора.