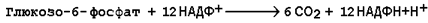Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
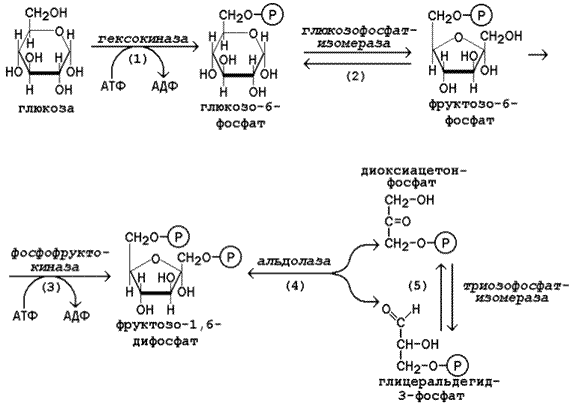
Образование и пути использования глюкозо-6-фосфата в организме. Особенности обмена глюкозо-6-фосфата в различных тканях, обусловленные функциональными различиями этих тканей.Источниками глюкозо-6-фосфата служат 2 процесса: мобилизация гликогена и глюконеогенез. 1. Мобилизация гликогена. В состоянии гипогликемии в крови повышается уровень гормона глюкагона, вырабатываемого а-клетками поджелудочной железы. Подобно адреналину он запускает каскад реакций, приводящих к фосфорилированию внутриклеточных ферментов печени. В том числе, ключевого фермента распада гликогена - гликогенфосфорилазы, что приводит к повышению его активности. Мобилизация гликогена обеспечивает потребности организма человека в глюкозе на протяжении первых 12-24 часов голодания. 2. В более поздние сроки голодания основным источником глюкозы становится глюконеогенез - биосинтез глюкозы из неуглеводных источников. Основными субстратами для глюконеогенеза при голодании служат глицерол и аминокислоты (за исключением лейцина). Повышение уровня этих субстратов в крови обеспечивается тем же глюкагоном, за счет распада триацилглицеролов в клеткаж жировой ткани и гормонами коркового вещества надпочечников – глюкокортикоидами, которые стимулируют процессы катаболизма белков во внепеченочных тканях. Кроме того, эти гормоны ,индуцируют синтез и повышают активность регуляторных ферментов глюконеогенеза – пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы и фруктозо-1,6-дифосфатазы. Начальной реакцией превращения глюкозы в клетке является её фосфорилирование в результате взаимодействия с АТФ (рисунок 15.1, реакция 1). Эта реакция в условиях клетки протекает только в одном направлении. Биологическая роль реакции фосфорилирования глюкозы заключается в том, что глюкозо-6-фосфат, в отличие от свободной глюкозы, не может проникать через плазматическую мембрану обратно в кровь и оказывается «запертой» в клетке. Таким образом, глюкозо-6-фосфат является ключевым метаболитом углеводного обмена, на уровне которого осуществляется интеграция различных путей превращения глюкозы в клетке.  В большинстве тканей реакцию фосфорилирования глюкозы катализирует фермент гексокиназа, которая обладает высоким сродством к глюкозе, способна также фосфорилировать фруктозу и маннозу и аллостерически ингибируется избытком глюкозо-6-фосфата. В клетках печени, кроме того, есть фермент глюкокиназа, которая имеет низкое сродство к глюкозе, не ингибируется глюкозо-6-фосфатом и не участвует в фосфорилировании других моносахаридов. Глюкокиназа эффективно функционирует только при высокой концентрации глюкозы в крови. Это способствует усвоению большого количества углеводов, поступающих в печень из кишечника в активную фазу пищеварения. В следующей реакции глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат. 43. Гликолиз - локализация в клетке и тканях, последовательность реакций, биологическая роль, энергетический баланс. Утилизация молочной кислоты в организме человека. Интенсивность гликолиза в тканях в период внутриутробного развития плода и после рождения. Гликолиз – это ферментативный распад глюкозы в аэробных условиях до двух молекул пировиноградной кислоты (аэробный гликолиз), а в анаэробных условиях – до двух молекул молочной кислоты (анаэробный гликолиз). В анаэробных условиях гликолиз протекает в тканях без потребления кислородаи является единственным процессом, поставляющим АТФ, так как окислительное фосфорилирование в этих условиях не функционирует. Анаэробный гликолиз происходит во всех тканях, функционирующих в условиях гипоксии, прежде всего в скелетных мышцах. Гликолиз в эритроцитах даже в присутствии кислорода завершается образованием лактата, поскольку в этих клетках отсутствуют митохондрии. Гликолиз протекает в цитозоле клеток организма. Этот процесс катализируется одиннадцатью ферментами, которые выделены в высокоочищенном состоянии и хорошо изучены. Условно можно разделить гликолиз на две стадии. 15.2.2. Первая стадия гликолиза является подготовительной и включает реакции превращения молекулы глюкозы в две молекулы фосфотриоз. Эта стадия сопровождается затратой молекул АТФ. Начальной реакцией превращения глюкозы в клетке является её фосфорилирование в результате взаимодействия с АТФ (рисунок 15.1, реакция 1). Эта реакция в условиях клетки протекает только в одном направлении. Биологическая роль реакции фосфорилирования глюкозы заключается в том, что глюкозо-6-фосфат, в отличие от свободной глюкозы, не может проникать через плазматическую мембрану обратно в кровь и оказывается «запертой» в клетке. Таким образом, глюкозо-6-фосфат является ключевым метаболитом углеводного обмена, на уровне которого осуществляется интеграция различных путей превращения глюкозы в клетке. В большинстве тканей реакцию фосфорилирования глюкозы катализирует фермент гексокиназа, которая обладает высоким сродством к глюкозе, способна также фосфорилировать фруктозу и маннозу и аллостерически ингибируется избытком глюкозо-6-фосфата. В клетках печени, кроме того, есть фермент глюкокиназа, которая имеет низкое сродство к глюкозе, не ингибируется глюкозо-6-фосфатом и не участвует в фосфорилировании других моносахаридов. Глюкокиназа эффективно функционирует только при высокой концентрации глюкозы в крови. Это способствует усвоению большого количества углеводов, поступающих в печень из кишечника в активную фазу пищеварения. В следующей реакции глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат (рисунок 15.1, реакция 2). Продукт реакции изомеризации подвергается повторному фосфорилированию за счёт АТФ (рисунок 15.1, реакция 3). Эта реакция – наиболее медленно протекающая реакция гликолиза и, подобно фосфорилированию глюкозы, необратима. Фермент – фосфофруктокиназа – является аллостерическим, активируется АДФ, АМФ, и фруктозо-2,6-бисфосфатом, а ингибируется цитратом и высокой концентрацией АТФ. На следующем этапе фруктозо-1,6-дифосфат подвергается расщеплению на две фосфотриозы (рисунок 15.1, реакция 4). Таким образом, химическое соединение, содержащее 6 углеродных атомов, превращается в два, содержащих по 3 атома углерода. Поэтому гликолиз называют дихотомическим путёмпревращения глюкозы (от слова «дихотомия» – рассечение на две части). Далее происходит изомеризация триозофосфатов (рисунок 15.1, реакция 5). В этой реакции диоксиацетонфосфат переходит в глицеральдегид-3-фосфат. Таким образом, в первой стадии гликолиза молекула глюкозы превращается в две молекулы глицеральдегид-3-фосфата. Поэтому в реакциях второй стадии глюкозы будет участвовать по две молекулы каждого субстрата, что необходимо учитывать при расчёте энергетического баланса данного метаболического пути.
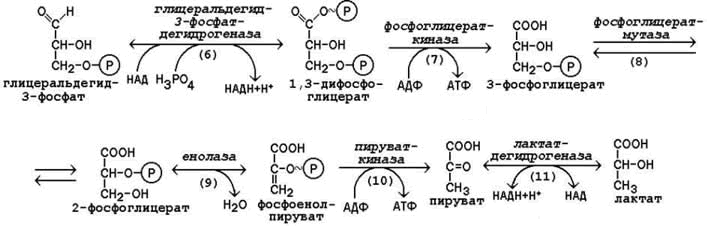
Рисунок 15.1.Реакции первой стадии гликолиза. 15.2.3. Вторая стадия гликолиза включает реакции превращения двух молекул глицеральдегид-3-фосфата в две молекулы лактата. На этой стадии гликолиза происходит синтез молекул АТФ. Глицеральдегид-3-фосфат подвергается дегидрированию при участии НАД-зависимой дегидрогеназы. В этой реакции происходит потребление неорганического фосфата, который включается в состав продукта реакции, содержащего макроэргическую фосфатную связь (рисунок 15.2, реакция 6), а промежуточным донором водорода служит SH-группа в активном центре фермента, которая потом регенерирует. 1,3-Дифосфоглицерат вступает в реакцию первого субстратного фосфорилирования, т.е. не сопряжённого с переносом электронов в дыхательной цепи. В этой реакции осуществляется синтез молекулы АТФ в результате переноса фосфатной группы вместе с макроэргической связью на молекулу АДФ (рисунок 15.2, реакция 7). В следующей реакции происходит внутримолекулярное перемещение фосфатной группы 3-фосфоглицерата ко 2-му углеродному атому (рисунок 15.2, реакция 8). Тем самым облегчается последующее отщепление молекулы воды, которое приводит к появлению в продукте реакции макроэргической фосфатной связи (рисунок 15.2, реакция 9). Фосфоенолпируват (ФЕП) вступает в реакцию второго субстратного фосфорилирования, в ходе которого образуется молекула АТФ. В отличие от первого субстратного фосфорилирования, данная реакция является необратимой в условиях клетки (рисунок 15.2, реакция 10). Фермент пируваткиназа существует в двух изоферментных формах. Изофермент, присутствующий в печёночных клетках, аллостерически ингибируется АТФ и активируется фруктозо-1,6-дифосфатом. Изофермент, присутствующий в головном мозге, мышцах и других тканях, не является аллостерическим и не принимает участия в регуляции гликолиза. В заключительной реакции гликолиза происходит использование НАДН, образовавшегося при дегидрировании глицеральдегид-3-фосфата (см. реакцию 6). При участии НАД-зависимой лактатдегидрогеназы пируват восстанавливается в молочную кислоту (рисунок 15.2, реакция 11). Фермент существует в пяти изоферментных формах, отличающихся сродством к субстрату и распределением в тканях.
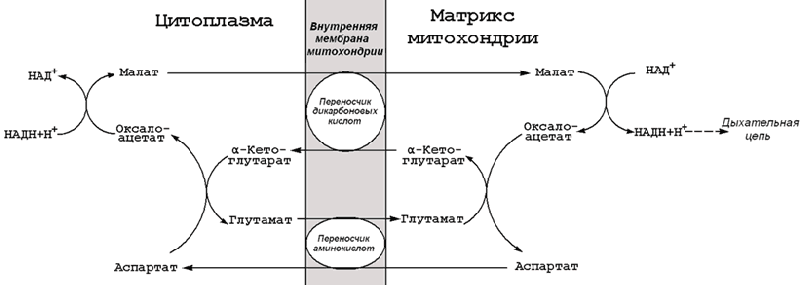
Таким образом, в процессе образования лактата из глюкозы в клетке не накапливается НАДН. Это значит, что данный процесс является анаэробным и может протекать без участия кислорода (который является конечным акцептором электронов, передаваемых НАДН в дыхательную цепь). В тканях, функционирующих в условиях гипоксии, При подсчёте энергетического баланса гликолиза следует учитывать, что каждая из реакций второй стадии этого метаболического пути повторяется дважды. Таким образом, в первой стадии было затрачено 2 молекулы АТФ, а во второй стадии путём субстратного фосфорилирования образовалось 2х2 = 4 молекулы АТФ; следовательно при окислении одной молекулы глюкозы в клетке накапливается 2 молекулы АТФ. 44. Дихотомический аэробный распад глюкозы: схема последовательности реакций, значение. Энергетический баланс аэробного окисления глюкозы. Аэробным называется окисление биологических субстратов с выделением энергии, протекающее при использовании кислорода в качестве конечного акцептора водорода в дыхательной цепи. В качестве доноров водорода выступают восстановленные формы коферментов (НАДН, ФАДН2 и НАДФН), образующиеся в промежуточных реакциях окисления субстратов. Аэробное дихотомическое окисление глюкозы является основным путём катаболизма глюкозы в организме человека и может происходить во всех органах и тканях. В результате этих реакций глюкоза расщепляется до СО2 и Н2О, а выделяющаяся энергия аккумулируется в АТФ. В этом процессе можно условно выделить три стадии: 1. превращение глюкозы в 2 молекулы пирувата в цитоплазме клеток (специфический путь распада глюкозы); 2. окислительное декарбоксилирование пирувата с образованием ацетил-КоА в митохондриях; 3. окисление ацетил-КоА в цикле Кребса в митохондриях. 15.3.2.На каждом этапе процесса происходит образование восстановленных форм коферментов, которые окисляются ферментными комплексами дыхательной цепи с образованием АТФ путёмокислительного фосфорилирования. Коферменты, образующиеся на второй и третьей стадиях аэробного окисления глюкозы, подвергаются непосредственному окислению в митохондриях. В то же время НАДН, образующийся в цитоплазме в реакциях первой стадии аэробного окисления, не способен проникать через митохондриальную мембрану. Перенос водорода с цитоплазматического НАДН в митохондрии происходит при помощи специальных челночных циклов, основным из которых является малат-аспартатный челночный механизм. Цитоплазматический НАДН восстанавливает оксалоацетат в малат, который проникает в митохондрию, где окисляется, восстанавливая митохондриальный НАД; в цитоплазму оксалоацетат возвращается в виде аспартата (рисунок 15.3).
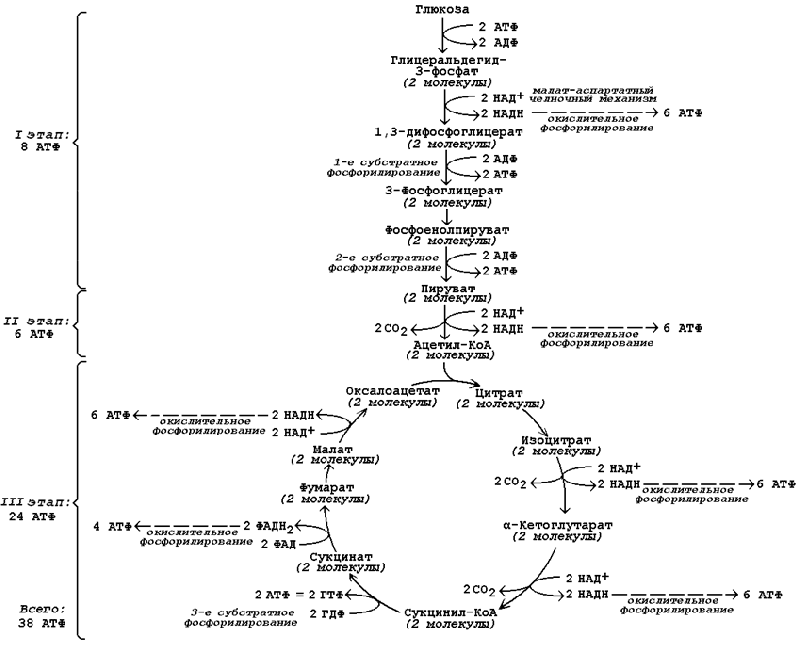
Продукция АТФ в реакциях аэробного дихотомического окисления происходит также в трёх реакциях субстратного фосфорилирования – две из них в гликолизе, третья в цикле Кребса на уровне сукцинил-КоА. Полный энергетический баланс аэробного окисления глюкозы представлен на рисунке 15.4. 45. Пентозофосфатный путь превращений глюкозы. Реакции окислительного этапа. Роль пентозофосфатного пути в различных тканях. Пентозофосфатный путь представляет собой прямое окисление глюкозы и протекает в цитоплазме клеток. Наибольшая активность ферментов пентозофосфатного пути обнаружена в клетках печени, жировой ткани, коры надпочечников, молочной железы в период лактации, зрелых эритроцитах. Низкий уровень этого процесса выявлен в скелетных и сердечной мышцах, мозге, щитовидной железе, легких. Пентозофосфатный путь называют также апотомическим путём, так как в его реакциях происходит укорочение углеродной цепи гексозы на один атом, который включается в молекулу СО2. 16.1.2.Пентозофосфатный путь выполняет в организме две важнейшие метаболические функции: · он является главным источником НАДФН для синтеза жирных кислот, холестерола, стероидных гормонов, микросомального окисления; в эритроцитах НАДФН используется для восстановления глутатиона – вещества, препятствующего пероксидному гемолизу; · он является главным источником пентоз для синтеза нуклеотидов, нуклеиновых кислот, коферментов (АТФ, НАД, НАДФ, КоА-SН и др.).
Рисунок 15.3.Энергетический баланс аэробного окисления глюкозы.
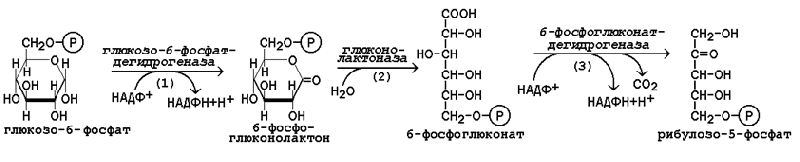
16.1.3.В пентозофосфатном пути можно выделить две фазы - окислительную и неокислительную. Исходным субстратом окислительной фазы является глюкозо-6-фосфат, который непосредственно подвергается дегидрированию с участием НАДФ-зависимой дегидрогеназы (рисунок 16.1, реакция 1). Продукт реакции гидролизуется (реакция 2), а образующийся 6-фосфоглюконат дегидрируется и декарбоксилируется (реакция 3). Таким образом, происходит укорочение углеродной цепи моносахарида на один углеродный атом («апотомия»), и образуется рибулозо-5-фосфат.
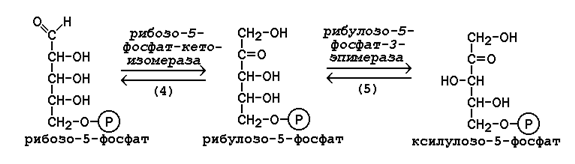
Рисунок 16.1. Реакции окислительной фазы пентозофосфатного пути. 16.1.4. Неокислительная фазапентозофосфатного пути начинается с реакций изомеризации. В ходе этих реакций одна часть рибулозо-5-фосфата изомеризуется в рибозо-5-фосфат, другая - в ксилулозо-5-фосфат (рисунок 16.2, реакции 4 и 5).
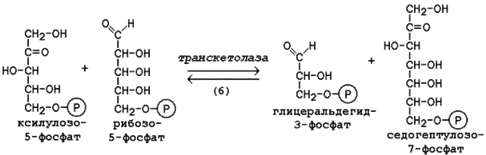
Следуюшая реакция протекает при участии фермента транскетолазы, коферментом которой является тиаминдифосфат (производное витамина B1). В этой реакции происходит перенос двухуглеродного фрагмента с ксилулозо-5-фосфата на рибозо-5-фосфат:
Образовавшиеся продукты взаимодействуют между собой в реакции, которая катализируется трансальдолазой и заключается а переносе остатка дигидроксиацетона на глицеральдегид-3-фосфат.
16.1.5.Посредством пентозофосфатного пути может происходить полное окисление глюкозо-6-фосфата до шести молекул СО2. Все эти молекулы образуются из С-1-атомов шести молекул глюкозо-6-фосфата, а из образовавшихся при этом шести молекул рибулозо-5-фосфата снова регенерируются пять молекул глюкозо-6-фосфата:
Если упростить представленную схему, то получится:
Таким образом, полное окисление 1 молекулы глюкозы в пентозофосфатном пути сопровождается восстановлением 12 молекул НАДФ.
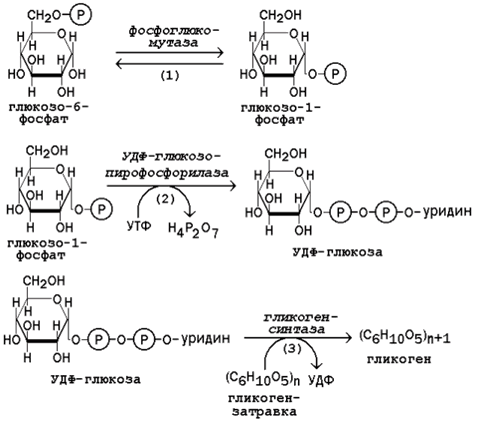
46. Обмен гликогена. Регуляция синтеза и распада гликогена. Мобилизация гликогена печени: последовательность реакций, каскадный механизм активации фосфорилазы. Нарушения обмена гликогена. Гликогенозы. Гликоген – биополимер, состоящий из остатков глюкозы, он является компонентом всех тканей животных и человека (см. рисунок 15.1). Этот полисахарид служит основным источником энергии и резервом углеводов в организме. Содержание гликогена в различных органах зависит от физиологического состояния организма. Наиболее высокое содержание гликогена обнаруживается в печени (от 2 до 6% от массы органа). Хотя концентрация гликогена в мышцах значительно ниже (от 0,5 до 1,5%), однако в норме его количество в мышцах составляет 2/3 от общего его содержания в организме. Гликоген отличается значительным разнообразием по структуре и по относительной молекулярной массе. Молекулы его ветвисты. Глюкозные остатки образуют цепи, в которых они связаны между собой α-1,4-гликозидными связями. Разветвления образуются при помощи α-1,6-гликозидных связей. Большая часть глюкозы, поступающей в организм с пищей, превращается в клетках печени в гликоген. Это связано с тем, что накопление легко растворимой глюкозы в клетках привело бы к резкому увеличению осмотического давления и разрушению клеточной мембраны. 16.3.2.Молекула глюкозы фосфорилируется при участии фермента глюкокиназы (в гепатоцитах) или гексокиназы (в других клетках) с образованием глюкозо-6-фосфата. Этот метаболит под влиянием фосфоглюкомутазы превращается в глюкозо-1-фосфат (рисунок 16.7, реакция 1).
Рисунок 16.7.Реакции биосинтеза гликогена. Глюкозо-1-фосфат взаимодействует с уридинтрифосфатом (УТФ) в присутствии фермента УДФ-глюкозо-пирофосфорилазы с образованием УДФ-глюкозы – ключевого метаболита углеводного обмена (рисунок 16.7, реакция 2). Перенос глюкозного остатка с УДФ-глюкозы на затравочную полисахаридную цепь осуществляет гликогенсинтаза – регуляторный фермент данного метаболического пути (рисунок 16.7, реакция 3). Гликогенсинтаза существует в двух формах: гликогенсинтаза b (неактивная) и гликогенсинтаза а (активная). Превращение формы а в форму b катализируется цАМФ-зависимой протеинкиназой, обратный процесс – протеинфосфатазой. Образование α-1,6-гликозидных связей в молекуле гликогена катализирует ветвящий фермент или трансглюкозидаза (рисунок 16.8) .
Рисунок 16.8.Образование α-1,6-гликозидных связей в молекуле гликогена. Мобилизация, или распад гликогена – процесс превращения гликогена в глюкозу, происходящий в печени. Таким образом, распад гликогена в печени наряду с глюконеогенезом принимает участие в поддержании уровня глюкозы в крови.
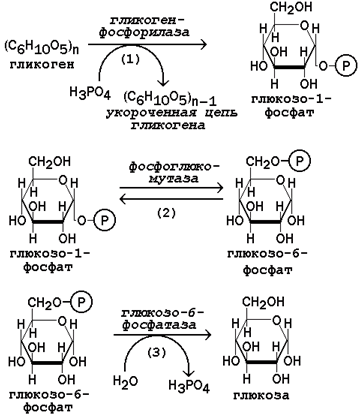
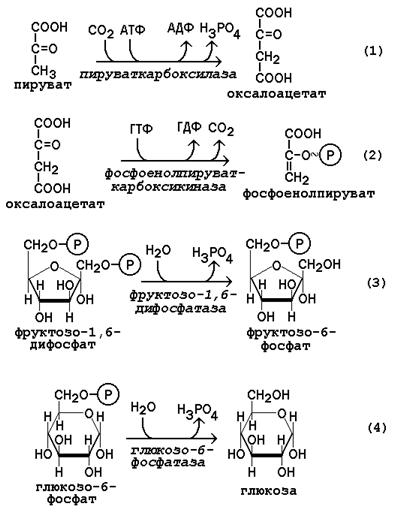
Рисунок 16.9.Реакции мобилизации гликогена. Первую реакцию внутриклеточного расщепления гликогена катализирует фермент фосфорилаза гликогена (рисунок 16.9, реакция 1). Простетической группой его является пиридоксальфосфат (производное витамина В6). Фосфорилаза гликогена – регуляторный фермент, он существует в двух формах: фосфорилаза а (активная) и фосфорилаза b (неактивная). Переход фосфорилазы b в фосфорилазу акатализирует киназа фосфорилазы, которая фосфорилирует неактивный фермент. Превращение фосфорилазы а в фосфорилазу b катализирует протеинфосфатаза, которая осуществляет дефосфорилирование активного фермента. Следует отметить, что ускорение процессов мобилизации гликогена происходит одновременно с торможением его биосинтеза, и наоборот. Активацию фосфорилазы гликогена вызывают гормоны адреналин и глюкагон. Фосфорилаза расщепляет в молекуле гликогена лишь α-1,4-гликозидные связи. Расщепление α-1,6-гликозидных связей осуществляется амило-1,6-гликозидазой гидролитически с образованием свободной глюкозы. Глюкозо-1-фосфат, образующийся в фосфорилазной реакции, при участии уже известного Вам фермента фосфоглюкомутазы переходит в глюкозо-6-фосфат (рисунок 16.9, реакция 2). 16.4.2.Дальнейшая судьба глюкозо-6-фосфата, образовавшегося при распаде гликогена, в разных тканях различна. Как уже упоминалось, в печени и почках имеется фермент глюкозо-6-фосфатаза, отщепляющая фосфат от глюкозо-6-фосфата (рисунок 16.9, реакция 3). Образовавшаяся глюкоза диффундирует в кровь, откуда поглощается клетками организма и служит для них источником энергии. В мышечной ткани фермент глюкозо-6-фосфатаза отсутствует. Поэтому глюкозо-6-фосфат, образовавшийся при распаде гликогена, подвергается дальнейшему превращению по гликолитическому пути с образованием лактата (этот процесс называется гликогенолизом). Образующийся в реакциях субстратного фосфорилирования АТФ используется в процессах мышечного сокращения. Таким образом, гликоген мышц является резервом энергии только для мышечной ткани. 47. Биосинтез глюкозы (глюконеогенез): возможные предшественники, последовательность реакций, значение. Регуляция глюконеогенеза из аминокислот. Интенсивность глюконеогенеза в организме плода и новорожденного ребенка. Глюконеогенез - биосинтез глюкозы из различных соединений неуглеводной природы. Биологическая роль глюконеогенеза заключается в поддержании постоянного уровня глюкозы в крови, что необходимо для нормального энергообеспечения тканей, для которых характерна непрерывная потребность в углеводах. Особенно это касается центральной нервной системы. Роль глюконеогенеза возрастает при недостаточном поступлении углеводов с пищей. Так, в организме голодающего человека может синтезироваться до 200 г глюкозы в сутки. Глюконеогенез быстрее, чем другие метаболические процессы, реагирует на изменения диеты: введение с пищей большого количества белков и жиров активизирует процессы глюконеогенеза; избыток углеводов, наоборот, тормозит новообразование глюкозы. Интенсивные физические нагрузки сопровождаются быстрым истощением запасов глюкозы в организме. В этом случае глюконеогенез является основным путём пополнения углеводных ресурсов, предупреждая развитие гипогликемии. Глюконеогенез в организме тесно связан также с процессами обезвреживания аммиака и поддержанием кислотно-основного баланса. 16.2.2.Основным местом биосинтеза глюкозы de novo является печень. Глюконеогенез протекает также в корковом слое почек. Принято считать, что вклад почек в глюконеогенез в физиологических условиях составляет около 10% глюкозы, синтезируемой в организме; при патологических состояниях эта доля может значительно возрастать. Незначительная активность ферментов глюконеогенеза обнаружена в слизистой тонкого кишечника. 16.2.3.Последовательность реакций глюконеогенеза представляет собой обращение соответствующих реакций гликолиза. Лишь три реакции гликолиза необратимы вследствие происходящих в ходе их значительных энергетических сдвигов: а) фосфорилирование глюкозы; б) фосфорилирование фруктозо-6-фосфата; в) превращение фосфоенолпирувата в пируват. Обход этих энергетических барьеров обеспечивают ключевые ферменты глюконеогенеза. Обратный переход пирувата в фосфоенолпируват требует участия двух ферментов. Первый из них – пируваткарбоксилаза - катализирует реакцию образования оксалоацетата (рисунок 16.4, реакция 1). Коферментом пируваткарбоксилазы является биотин (витамин Н). Реакция протекает в митохондриях. Роль её заключается также в пополнении фонда оксалоацетата для цикла Кребса. Все последующие реакции глюконеогенеза протекают в цитоплазме. Мембрана митохондрий непроницаема для оксалоацетата, и он переносится в цитоплазму в виде других метаболитов: малата или аспартата. В цитоплазме указанные соединения вновь переходят в оксалоацетат. При участии фосфоенолпируваткарбоксикиназы из оксалоацетата образуется фосфоенолпируват (рисунок 16.4, реакция 2). Фосфоенолпируват в результате обращения ряда реакций гликолиза переходит во фруктозо-1,6-дифосфат. Превращение фруктозо-1,6-дифосфата во фруктозо-6-фосфат катализируетсяфруктозодифосфатазой (рисунок 16.4, реакция 3). Фруктозо-6-фосфат изомеризуется в глюкозо-6-фосфат. Заключительной реакцией глюконеогенеза является гидролиз глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатазы (рисунок 16.4, реакция 4).
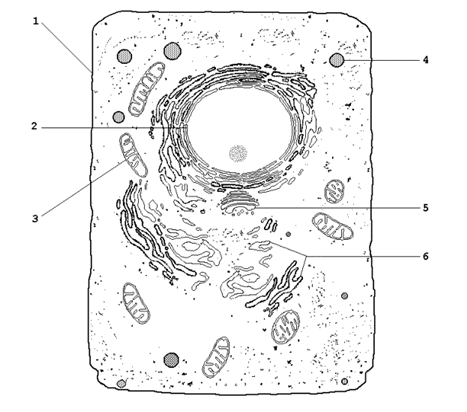
Рисунок 16.4.Обходные реакции глюконеогенеза. 16.2.4.Основными источниками глюкозы в глюконеогенезе являются лактат, аминокислоты, глицерол и метаболиты цикла Кребса. 48. Принципы построения биологических мембран. Роль основных компонентов (липидов, белков, углеводов) в структурной организации и функционировании мембран. Биологические мембраны – сложные надмолекулярные структуры, окружающие все живые клетки и образующие в них замкнутые, специализированные компартменты – органеллы. Основные разновидности биологических мембран представлены на рисунке 9.2. Мембрану, ограничивающую цитоплазму клетки снаружи, называют цитоплазматической или плазматической мембраной (1). Название внутриклеточных мембран обычно происходит от названия ограничиваемых или образуемых ими субклеточных структур. Различают ядерную (2), митохондриальную (3), лизосомальную (4) мембраны, мембраны комплекса Гольджи (5), эндоплазматический ретикулум (6) и другие.
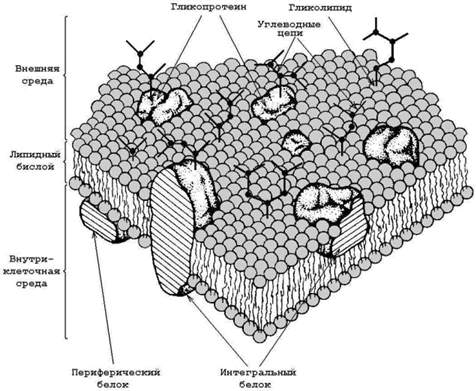
Рисунок 9.2. Схематическое изображение органелл животной клетки (объяснения в тексте). 9.2.2.Некоторые примеры функций биологических мембран. Плазматическая мембрана – ограничивает содержимое клетки от внешней среды; осуществляет контакт с другими клетками, получение, обработку и передачу информации внутрь клетки, поддержание постоянства внутренней среды. Ядерные мембраны (внешняя и внутренняя) – образуют ядерную оболочку, которая отделяет хромосомный материал от цитоплазматических органелл; через поры ядерной оболочки происходит транспорт белков и нуклеиновых кислот в ядро и из ядра. Митохондриальные мембраны – осуществляют преобразование энергии в ходе окислительного фосфорилирования, синтез АТФ. Лизосомальные мембраны – ограничивают гидролитические ферменты от цитоплазмы клетки, препятствуют самоперевариванию (аутолизу) клеток, способствуют поддержанию постоянства рН среды в лизосомах. Мембраны эндоплазматического ретикулума – принимают участие в образовании новых мембран, осуществляют синтез белков, липидов, полисахаридов, окисление гидрофобных метаболитов и ксенобиотиков. Все мембраны по своей организации и составу обнаруживают ряд общих свойств. Они: · состоят из липидов, белков и углеводов; · являются плоскими замкнутыми структурами; · имеют внутреннюю и внешнюю поверхности (асимметричны); · избирательно проницаемы. 9.3.2.Схема строения биологической мембраны, представлена на рисунке 9.3. Основу мембраны составляет липидный бислой – двойной слой молекул липидов, которые обладают свойствомамфифильности (содержат как гидрофильные, так и гидрофобные функциональные группы). В липидном бислое гидрофобные участки молекул взаимодействуют между собой, а гидрофильные участки обращены в окружающую водную среду.
Рисунок 9.3.Схема строения биологической мембраны (по Сингеру и Николсону). Мембранные липиды выполняют роль растворителя мембранныхбелков, создавая жидкую среду, в которой они могут функционировать. По степени влияния на структуру бислоя и по силе взаимодействия с ним мембранные белки делят на интегральные и периферические. Важнейшие особенности интегральных и периферических белков представлены в таблице 9.1. Таблица 9.1 |
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 1370. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 Продукт этой реакции эритрозо-4-фосфат участвует во второй транскетолазной реакции вместе со следующей молекулой ксилулозо-5-фосфата:
Продукт этой реакции эритрозо-4-фосфат участвует во второй транскетолазной реакции вместе со следующей молекулой ксилулозо-5-фосфата: Таким образом, три молекулы пентозофосфатов в результате реакций неокислительной стадии превращаются в две молекулы фруктозо-6-фосфата и одну молекулу глицеральдегид-3-фосфата. Фруктозо-6-фосфат может изомеризоваться в глюкозо-6-фосфат, а глицеральдегид-3-фосфат может подвергаться окислению в гликолизе или изомеризоваться в дигидроксиацетонфосфат. Последний вместе с другой молекулой глицеральдегид-3-фосфата может образовывать фруктозо-1,6-дифосфат, который также способен переходить в глюкозо-6-фосфат.
Таким образом, три молекулы пентозофосфатов в результате реакций неокислительной стадии превращаются в две молекулы фруктозо-6-фосфата и одну молекулу глицеральдегид-3-фосфата. Фруктозо-6-фосфат может изомеризоваться в глюкозо-6-фосфат, а глицеральдегид-3-фосфат может подвергаться окислению в гликолизе или изомеризоваться в дигидроксиацетонфосфат. Последний вместе с другой молекулой глицеральдегид-3-фосфата может образовывать фруктозо-1,6-дифосфат, который также способен переходить в глюкозо-6-фосфат.