
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Кинетика процессов кристаллизации.
При концентрации растворов ниже концентрации насыщения кристаллы не образуются. При концентрации выше насыщения начинается процесс кристаллизации, который можно подразделить на две стадии: образование кристаллических зародышей и их рост. Кинетика процесса кристаллизации характеризуется скоростью образования зародышей и скоростью роста кристаллов. Кристаллизацию из растворов соответственно проводят смещая равновесие в системе за счет увеличения концентрации (испарение растворителя) или за счет изменения температуры раствора (охлаждение). Скорость роста каждого из кристаллов зависит от интенсивности внешнего массообмена и скорости включения молекул растворенного вещества в кристаллическую решетку. Скорость подвода вещества к поверхности кристалла описываются уравнением массоотдачи:
где М – масса кристаллической фазы (кг), βс – коэффициент массоотдачи в жидкой (сплошной) фазе, с – концентрация вещества в объеме раствора, Если скорость прироста массы кристаллов велика, то общую скорость процесса кристаллизации можно определить по уравнению (7.1), так как в этом случае основное сопротивление процессу будет сосредоточена в фазе раствора (диффузионная область). Скорость прироста массы кристалла (скорость встраивания молекул в кристалл) может быть описана следующим выражением:
где  В случае соизмеримых скоростей процессов в сплошной и дисперсной фазах общая скорость процесса может быть определена по уравнению массопередачи:
где Возрастание температуры также увеличивает скорость образования кристаллов. Соотношение скорости образования зародышей и их роста определяет конечный размер кристаллов. Увеличение температуры кристаллизации, а также быстрое охлаждение раствора уменьшают средний размер образующихся кристаллов. Однако надо иметь ввиду, что быстрый рост кристаллов ухудшает их однородность. Функции распределения кристаллов по размерам для диффузионной и кинетической областей отличаются: в диффузионной области кривая имеет максимум, когда как в кинетической области кривая плавная.
Материальный и тепловой балансы кристаллизации. Материальный баланс.
Рис.7.5. Схемы материальных и тепловых балансов кристаллизации: а – изогидрическая кристаллизация, б – изотермическая кристаллизация.
Материальный баланс процесса кристаллизации по общим потокам веществ может быть представлена в виде:
Баланс по безводному веществу имеет вид:
хн – начальная концентрация растворенного вещества в растворе,
Здесь
где М- молекулярная масса кристалла без растворителя, Решая совместно уравнения (7.4) – (7.6) получим расход кристаллической фазы:
Если кристаллическая фаза не включает растворителя тогда 𝝀=1:
При изотермической кристаллизации происходит удаление влаги из насыщенного раствора. Поэтому концентрации начального и маточного раствора равны. Тогда получим:
При изогидрической кристаллизации
Тепловой баланс. Тепловой баланс процесса изогридической кристаллизации может быть записан на основе схемы тепловых потоков, представленных на рис.7.5, в виде:
Здесь Уравнения (7.11) и (7.4) дают возможность определить расход охлаждающей воды на процесс изогидрической кристаллизации:
Тепловой баланс изотермической кристаллизации может быть записана основе схемы тепловых потоков, представленных на рис.7.5, в виде:
Здесь Совместное решение уравнений (7.13) и (7.4) позволяет определить расход греющего пара:
В большинстве случаев при кристаллизации тепло выделяется. В практике кристаллизации теплоту кристаллизации
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 310. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
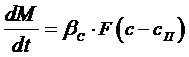 (7.1)
(7.1)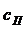 - концентрация вещества у поверхности кристалла, F – поверхность кристалла.
- концентрация вещества у поверхности кристалла, F – поверхность кристалла.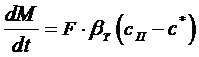 (7.2)
(7.2)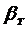 - коэффициент массоотдачи в твердой (дисперсной) фазе,
- коэффициент массоотдачи в твердой (дисперсной) фазе, 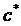 - концентрация насыщения. По уравнению (7.2) можно определить общую скорость процесса кристаллизации, если скорость подвода вещества к поверхности кристалла велика, т.е. в этом случае лимитирующей стадией процесса является скорость прироста массы кристалла (кинетическая область).
- концентрация насыщения. По уравнению (7.2) можно определить общую скорость процесса кристаллизации, если скорость подвода вещества к поверхности кристалла велика, т.е. в этом случае лимитирующей стадией процесса является скорость прироста массы кристалла (кинетическая область).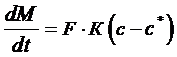 (7.3)
(7.3)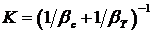 - коэффициент массопередачи. В диффузионной области, при
- коэффициент массопередачи. В диффузионной области, при 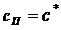 кристаллизация существенно ускоряется за счет возрастания значений параметров, уменьшающих толщину диффузионного пограничного слоя.
кристаллизация существенно ускоряется за счет возрастания значений параметров, уменьшающих толщину диффузионного пограничного слоя.
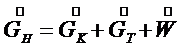 (7.4)
(7.4)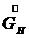 - расход начального раствора,
- расход начального раствора,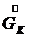 - расход конечного (маточного) раствора,
- расход конечного (маточного) раствора,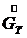 - расход кристаллов (кристаллической фазы),
- расход кристаллов (кристаллической фазы),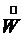 - поток выпаренной воды.
- поток выпаренной воды.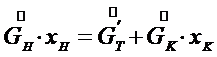 (7.5)
(7.5)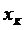 – конечная концентрация растворенного вещества в растворе (маточный раствор).
– конечная концентрация растворенного вещества в растворе (маточный раствор).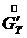 - расход кристаллической фазы в пересчете на растворенное вещества. Определяем
- расход кристаллической фазы в пересчете на растворенное вещества. Определяем 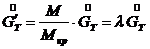 (7.6)
(7.6)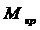 - молекулярная масса кристалла с учетом растворителя. Например, сульфат меди кристаллизуется при Т=50
- молекулярная масса кристалла с учетом растворителя. Например, сульфат меди кристаллизуется при Т=50 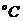 как
как 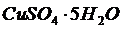 , а при более высоких Т как
, а при более высоких Т как 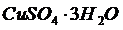 .
.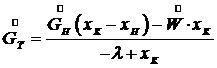 (7.7)
(7.7)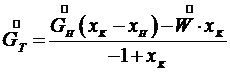 (7.8)
(7.8)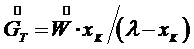 (7.9)
(7.9)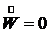 , и уравнение (7.8) примет вид:
, и уравнение (7.8) примет вид: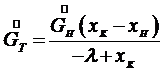 (7.10)
(7.10) (7.11)
(7.11)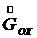 - расход охлаждающей воды,
- расход охлаждающей воды,  - теплота кристаллизации,
- теплота кристаллизации, 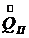 - потери теплоты в окружающую среду, Н – энтальпия, индексы: н – начальный, к – конечный, ох – охлаждающий, т – твердый (кристалл).
- потери теплоты в окружающую среду, Н – энтальпия, индексы: н – начальный, к – конечный, ох – охлаждающий, т – твердый (кристалл).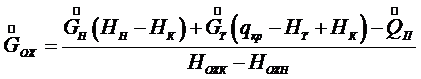 (7.12)
(7.12) (7.13)
(7.13)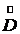 - расход греющего пара;
- расход греющего пара; 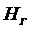 ,
, 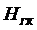 и
и 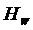 - энтальпии греющего пара, конденсата греющего пара, вторичного пара соответственно.
- энтальпии греющего пара, конденсата греющего пара, вторичного пара соответственно.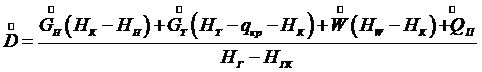 (7.14)
(7.14)