
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Необходимые условия равновесия ⇐ ПредыдущаяСтр 2 из 2
Согласно первому постулату термодинамики процесс установления равновесия в изолированной ТС необратим. Это утверждение выражается в формулировках 1-го и 2-го законов термодинамики, данных Р. Клаузиусом (1867 г.) применительно к неравновесной изолированной ТС: энергия изолированной ТС постоянна (U = const); энтропия изолированной ТС стремится к максимуму:
Отсюда следует аналитическое выражение 2-го закона термодинамики в форме неравенства Клаузиуса для изолированной ТС:
где знак неравенства откосится к неравновесным состояниям ТС, а знак равенства к равновесным. Рассмотрим изолированную ТС, состоящую из подсистем 1, 2, ..., n, состояние каждой из которых описывается экстенсивными термодинамическими переменными Пусть система находится в состоянии термодинамического равновесия. Тогда выполняются следующие условия:
dS = dS1 +...+dSn = 0; dV = dV1 +...+dVn = 0; dN = dN1 +...+dNn = 0. (2.14)
В соответствии с первым законом термодинамики, внутренняя энергия изолированной ТС постоянна, тогда
Подстановка в (2.15) dS1, dV1 и dN1 из (2.14) приводит к тождественному равенству нулю выражения
Переменные Si, Vi, Ni для каждой подсистемы независимы, следовательно, равенство (2.16) имеет место, если в состоянии термодинамического равновесия выполняются условия:

2.3.2. Устойчивость равновесия К необходимым условиям устойчивости термодинамического состояния можно прийти в результате следующих рассуждений. Рассмотрим закрытую ТС. Используем основное термодинамическое неравенство
Пусть ТС находится в ОС с параметрами V*, S*, p*, T*. Будем полагать, что ОС находится в состоянии термодинамического равновесия, следовательно, p*, T* = const. Расширенная система, состоящая из ТС и ОС, является системой изолированной, тогда
dU + dU* = 0, dS + dS* ³ 0; dV + dV* = 0. (2.18)
Используя основное термодинамическое неравенство и условия (2.18) получим:
Пусть в начальный момент времени ТС не находилась в равновесии с ОС. С течением времени расширенная система, а вместе с ней и рассматриваемая ТС придут в состояние термодинамического равновесия, которое будет сохраняться, пока не нарушатся условия изоляции. Это значит, что равновесие расширенной системы и ТС есть равновесие устойчивое. Тогда любые мыслимые (виртуальные) процессы в системе должны приводить к нарушению неравенства (2.19) и удовлетворять неравенству
Разложим U(S, V) в ряд около состояния равновесия:
Так как (¶U/¶S)V = T = T*, (¶U/¶V)S = -p = -p*, то из (2.20‑21) получим:
при любых ¶S и ¶V. В сумме (2.22) слагаемые второго порядка определяющие (исключением является критическое состояние вещества). Следовательно, состояние термодинамического равновесия тогда устойчиво, когда квадратичная форма в (2.22) положительно определена. Для положительной определенности (2.22) необходимо и достаточно выполнение следующих неравенств:
Из (2.23) получаются следующие неравенства
Таким образом, для устойчивости состояния термодинамического равновесия ТС необходимы положительные теплоемкости Сv, Ср и положительные коэффициенты изотермической bT и адиабатической bS сжимаемости.
2.3.3. Равновесие в гетерогенной системе Для ТС, состоящей из n компонентов (компонент ‑ индивидуальное вещество, являющееся частью термодинамической системы) и m фаз (A, B, C, ...), условия ТД равновесия описываются уравнениями (2.17). Условия химического равновесия фаз
дают (m - 1)n уравнений для определения мольных долей zjk компонент в каждой из m фаз (k = 1, ... , m). Мольная доля j -го вещества в k -ой фазе определяется уравнением
Сумма мольных долей всех компонент в каждой фазе равна единице:
Учитывая наличие m уравнений связи (2.27), можно прийти к выводу, что число независимых переменных
Соотношение (2.28) называемое правилом фаз Гиббса позволяет подсчитать количество фаз, способных одновременно находиться в равновесии. Рассмотрим следствия из (2.28) для однокомпонентной ТС. Число степеней свободы однокомпонентной ТС
Однокомпонентная однофазная система. При m = 1, f11 = 2 и состояние однокомпонентной системы определяется двумя ТД переменными, например, p и T. Однокомпонентная двухфазная система. При m = 2 двухфазная, однокомпонентная ТС имеет лишь одну степень свободы: f12 = 1. Независимой переменнойявляется давление или температура:
Однокомпонентная трехфазная система. При m = 3 такая система не имеет ни одной степени свободы: f13 = 0. Это означает, что фазовое равновесие может иметь место в единственном состоянии с параметрами pтр, Tтр ‑ тройной точке. В тройной точке имеет место равенство химических потенциалов трех сосуществующих фаз вещества:
2.3.4. Термодинамическая поверхность. Фазовые диаграммы
На рис. 2.2 в координатах (p, V, T) представлена термодинамическая поверхность некоторого вещества, которое в рассматриваемой области параметров состояния может существовать только в одной твердой фазе.
|
||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 156. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
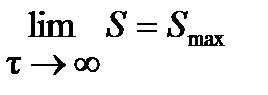 .
. 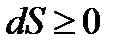 , (2.13)
, (2.13)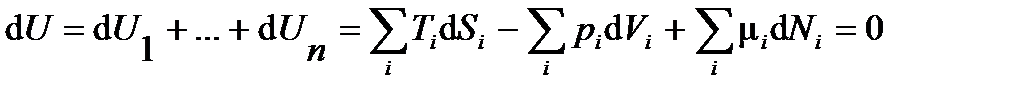 . (2.15)
. (2.15)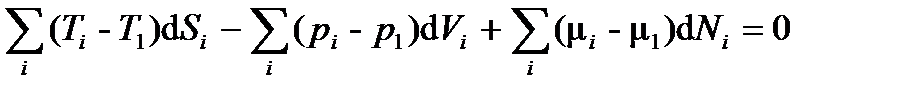 . (2.16)
. (2.16)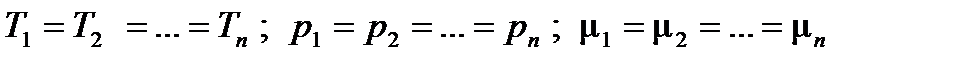 . (2.17)
. (2.17)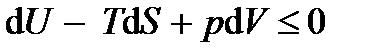 .
. 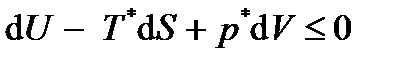 . (2.19)
. (2.19)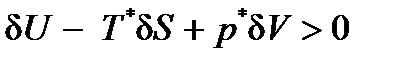 . (2.20)
. (2.20)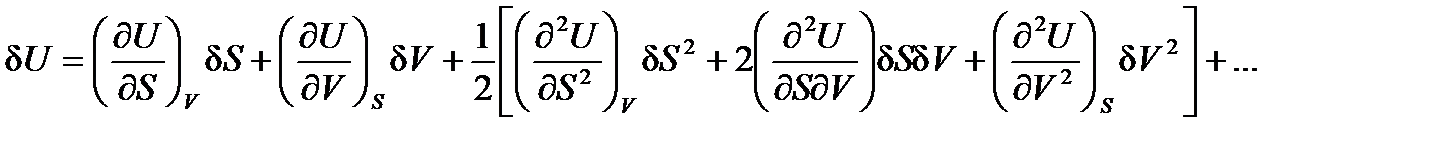 . (2.21)
. (2.21)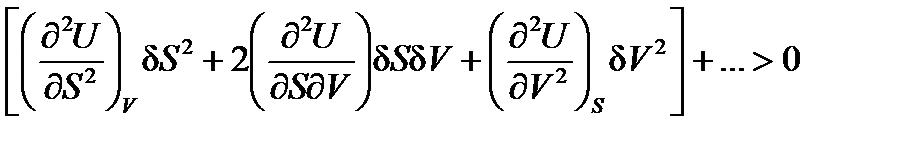 (2.22)
(2.22) . (2.23)
. (2.23)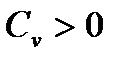 ;
; 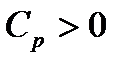 ; (2.24а, б)
; (2.24а, б)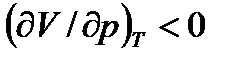 ;
; 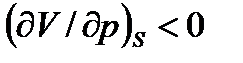 ; (2.24в, г)
; (2.24в, г)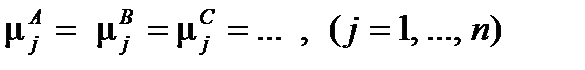 ; (2.25)
; (2.25)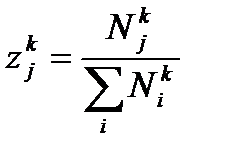 . (2.26)
. (2.26)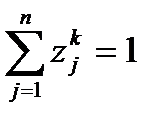 . (2.27)
. (2.27)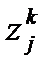 равно (n - 1)m. Совместно с двумя внешними переменными (р, Т) число независимых переменных составит (n - 1)m + 2, тогда как число уравнений вида (2.25) равно (m - 1)n. Отсюда можно найти число независимых ТД переменных
равно (n - 1)m. Совместно с двумя внешними переменными (р, Т) число независимых переменных составит (n - 1)m + 2, тогда как число уравнений вида (2.25) равно (m - 1)n. Отсюда можно найти число независимых ТД переменных 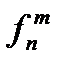 (число степеней свободы) гетерогенной ТС, которые можно изменять, не нарушая ее равновесия:
(число степеней свободы) гетерогенной ТС, которые можно изменять, не нарушая ее равновесия: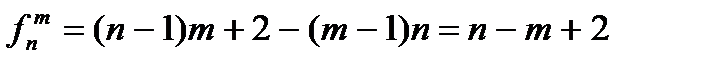 . (2.28)
. (2.28)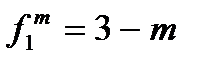 . (2.29)
. (2.29)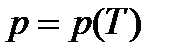 . (2.30)
. (2.30)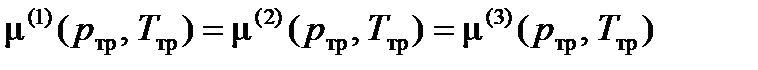 . (2.31)
. (2.31)