
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ИСПОЛЬЗОВАНИЕ МЕТОДОВ ТИТРИМЕТРИИ ДЛЯ АНАЛИЗА ПРИРОДНЫХ ВОДСтр 1 из 3Следующая ⇒ КУРСОВАЯ РАБОТА на тему
Обучающийся: ТКАЧУК ОЛЬГА НИКОЛАЕВНА ___________
Специальность: 18.02.01Аналитический контроль качества химических соединений Группа 4АК4
Научный руководитель: Рюш Ирина Олеговна ___________
Курсовая работа выполнена на оценку ________________________
Дата защиты «__» __________ 2018 г.
Симферополь, 2018 2 Содержание ВВЕДЕНИЕ…………………………………………………………….….3 ГЛАВА 1 ИСТОЧНИКИ ПРИРОДНОЙ ВОДЫ. ЕЕ СОСТАВ И МЕТОДЫ АНАЛИЗА……………………..………………..…………………….4 1.1 Источники водообеспечения………………………………………………………4 1.2 Состав природных вод ………………………………..…………......5 1.3 Титриметрические методы анализа основных прказателей природных вод………………………………………..……...…………9 ГЛАВА 2 МАТЕРИАЛЫ И МЕТОДИКА ИССЛЕДОВАНИЯ…………………..………………………………………….10 2.1. Определение общей жесткости природных вод комплексонометрически согласно ГОСТ 31954-2012……………………………….………..……………………………………10 2.2 Определение содержания сульфат-ионов с использованием титриметрии с хлористым барием в природных водах согласно ГОСТ 31940-2012......………………………………………….……………………………...13 2.3. Определение содержания хлор - иона титрованием азотнокислым серебром в природных водах согласно ГОСТ 4245-72 …………………………………………………………………………………….15 ГЛАВА 3 ОХРАНА ТРУДА И ТЕХНИКА БЕЗОПАСНОСТИ………18 ГЛАВА 4 РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЯ……………………..22 ЗАКЛЮЧЕНИЕ………………………………………………….…………30 СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ…….……….………31  3 Введение Вода является поистине уникальным, до конца не изученным веществом. Она является одним из лучших растворителей, в ее состав входят примеси различных химических веществ и элементов, но именно их концентрация играет важную роль при определении пригодности или непригодности воды для той или иной цели. Вода необходима человеку ежедневно для удовлетворения своих повседневных потребностей. Но чистая пресная вода в современном Крыму уже близка к черте дефицита. На сегодняшний день воду анализируют в основном фотометрическими, гравиметрическими, титриметрическими, нефелометрическими и потенциометрическими методами анализа. Но все же основные показатели состава воды получают титриметрическими методами. Цель: количественно определить основные показатели качества природных вод (общая жесткость, содержание сульфатов и хлоридов). Были поставлены следующие задачи: 1. Количественно определить общую жесткость природных вод согласно ГОСТ 31954-2012. 2. Количественно определить содержание сульфатов согласно ГОСТ 31940-2012. 3. Количественно определить содержание хлоридов согласно ГОСТ 4245-72. 4. Соотнести полученные результаты анализов к нормам СанПиН 2.1.4.1074-01. 5. Произвести статистическую обработку результатов экспериментов. 4 Актуальность работы состоит в том, что несмотря на технологический прогресс в методиках исследования, на растущую приборную базу в химических лабораториях большое число важных анализов по контролю качества воды выполняется титриметрическими методами. В рамках данной курсовой работы были изучены титриметрические методы анализа природных вод, подающихся в централизованные системы питьевого водоснабжения г. Симферополя и Симферопольского района, используемые в ЦПХБЛ ГУП РК «Вода Крыма». Качество воды, применяемой для таких целей контролируется согласно требованиям СанПиН 2.1.4.1074-01. ГЛАВА 1 ИСТОЧНИКИ ПРИРОДНОЙ ВОДЫ. ЕЕ СОСТАВ И МЕТОДЫ АНАЛИЗА 1.1 Источники водообеспечения Источниками водообеспечения централизованных систем водоснабжения являются подземные и поверхностные воды и атмосферные осадки. К подземным водам относят: подрусловые, грунтовые, межпластовые, артезианские, карстовые, шахтные. Состав подземных вод определяется условиями их образования и залегания. К поверхностным относят воды рек, озер, водохранилищ, прудов, каналов, морей. Их состав определяют почвенно-геологические условия; климатические, геоморфологические и антропогенные факторы. К атмосферным водам относят осадки, выпадающие в виде дождя и снега, аккумулирующиеся в естественных или искусственных емкостях. Их состав определяется чистотой атмосферы, количеством; 5 гидрогеологическими свойствами грунтов бассейна водосбора, способом их накопления и хранения; условиями, сопутствующими их выпадению [1]. 1.2 Состав природных вод Поскольку вода представляет собой динамическую многокомпонентную систему, то в ее состав входят газы, различные ионы, радиоактивные и органические вещества, микроорганизмы. Из растворенных газов наиболее важными являются В поверхностных водах концентрация углекислого газа находится в пределах 20 – 30 мг/л, в подземных не минерализованных водах – 90 мг/л. В подземных водах он появляется в результате процессов разложения органических соединений и биохимических процессов. Кислород попадает в воду при контакте с воздухом. В поверхностных водах концентрация кислорода меньше теоретического за счет потребления его различными организмами, процессов брожения и гниения органических остатков. Азот попадает в воду из воздуха, при разложении органических остатков, а также при восстановлении соединений азота бактериями. За счет высокого парциального давления концентрация азота в воде сильно превышает концентрацию кислорода. Присутствие сероводорода более характерно для подземных источников, где он образуется в результате процессов разложения и восстановления некоторых минеральных солей. Придает воде неприятный запах. 6 Концентрация метана в природных водах незначительна, наличие характерно для болотных вод и в подземных водах газонефтеносных районов. Ионы оказывают существенное влияние на качество воды: Больше всего присутствуют хлориды, сульфаты, ионы кальция и магния, карбонаты и гидрокарбонаты. Ионы SO42-и Cl- попадают в природные воды из-за вымывания солесодержащих пород или сбросов промышленных и бытовых сточных вод. Концентрация, как правило, колеблется от долей миллиграмма до нескольких десятков граммов на литр. При превышении 350 мг/л хлоридов или 500 мг/л сульфатов придает воде солоноватый вкус, и приводит к нарушению пищеварительной системы человека. Ионы Ca2+и Mg2+ встречаются во всех минерализованных водах. Источником попадания являются залежи известняков, гипса, доломитов. В маломинерализованных водах преобладает Ca2+ . С ростом степени минерализации количество ионов Ca2+ падает и не превышает 1г/л, а содержание ионов Mg2+ растёт и может достигать нескольких десятков граммов. Эти ионы по большей степени обуславливают жесткость воды.
7 Избыток железа вызывает заболевание печени, ухудшает репродуктивную функцию организма. Марганецсодержащие воды характеризуются особой окраской, вяжущим привкусом, оказывают токсическое воздействие на человека.ПДК железа 0,3 мг/л, марганца - 0,1 мг/л. Бор при концентрации в питьевой воде выше 0,5 мг/л и бром при концентрации 0,2 мг/л ухудшает обмен веществ, вызывая заболевание органов выделения. Нитраты содержатся в основном в поверхностных водах (0,001 – 0,003 мг/л), нитриты (десятые доли миллиграммов в литре) – в артезианских. При употреблении воды с содержанием нитратов свыше 45 мг/л в организме человека способствует образованию злокачественных опухолей желудка, у детей возникает нарушение окислительной функции крови. ПДК нитрит-иона не должна превышать 3 мг/л. Фтор является биологически активным микроэлементом, концентрация которого в питьевой воде не должно превышать 0,7 – 1,5 мг/л во избежание развития кариеса или флюороза зубов. Стронций, кадмий, ртуть, цинк, молибден и медь являются тяжелыми металлами и опасны для здоровья человека. As, Be, Cu, Mo, Pb, Se, Sr, Zn и др. Эти элементы относятся к ядовитым и в природных водах встречаются крайне редко. Их наличие ведет к серьезным негативным последствиям для живых организмов.
8 Взвешенные вещества появляются в воде в результате смыва твердых частичек песка, глины, илистых веществ с верхнего покрова земли. Их наличие обуславливает мутность. Она должна составлять не более 1,5 мг/л для питьевой воды, так как серьезно ухудшает органолептические показатели. Наиболее значительными поставщиками органических веществ в природные воды являются почвенный и торфяной гумус, продукты жизнедеятельности и разложения растительных и животных организмов, сточные воды промышленных предприятий. Наиболее сильно окрашивают воду гумусовые вещества, придающие ей оттенки желтого или бурого цветов. Наибольшую угрозу для водоемов с точки зрения загрязнения органическими веществами представляют неочищенные стоки промышленных предприятий, в состав которых могут входить белки, жиры, углеводы, органические кислоты, эфиры, спирты, фенолы, нефть и др. Гидробиониты в процессе жизнедеятельности влияют как на состав окружающей среды, так и на качество воды. Они включают в себя планктон, бентос, нейстон, пагон. Гидрофлора определяется макрофитами и микрофитами. При отмирании и разложении макрофитов вода обогащается органическими веществами, появляется запах, ухудшаются органолептические свойства воды. Также в воде присутствуют бактерии и вирусы, в том числе и патогенные [11]. Состав природных вод постоянно изменяется в результате протекающих в них процессов окисления и восстановления, седиментации диспергированных и коллоидных примесей и солей, ионообмена между водой и донными отложениями; 9 обогащения вод микроэлементами вследствие биохимических процессов. В поверхностных водотоках наблюдается самоочищение воды за счет физических, химических и биологических процессов, чему способствует аэрация, перемешивание, декантация взвесей, разбавление загрязнений в большой массе воды[5]. 1.3. Титриметрические методы анализа основных показателей качества природных вод Для анализа природных вод на хлориды, сульфаты и общую жесткость применяется титриметрический метод. Он является одним из «классических» методов химического анализа и имеет серьезные приемущества: быстрота определения, простота используемого оборудования, его относительная дешевизна. К недостаткам относится средняя чувствительность метода [4]. Титриметрическим анализом называется метод количественного химического анализа, основанный на точном измерении объема раствора известной концентрации (титранта), израсходованного на реакцию взаимодействия с определяемым веществом. Титрант добавляют к точно отмеренному объему анализируемого раствора небольшими порциями. Эта операция называется титрованием. Титриметрические методы подразделяют по типу реакции, лежащей в основе метода, на четыре больших группы: кислотно - основное титрование, окислительно-восстановительное титрование (редоксиметрия, оксидиметрия), осадительное титрование, комплексонометрия.
10 ГЛАВА 2 МАТЕРИАЛЫ И МЕТОДИКА ИССЛЕДОВАНИЯ |
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 596. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |


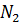 ,
, 
 . Их содержание в воде зависит от природы и парциального давления газа, давления, температуры и состава водной среды [2].
. Их содержание в воде зависит от природы и парциального давления газа, давления, температуры и состава водной среды [2].
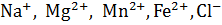 ,
, 
 ,
,  ,
, 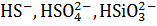 .
.