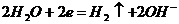Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
А) нашар еритiн негiздердi алу. ⇐ ПредыдущаяСтр 2 из 2 Үш пробиркаға 2-3 мл темiр(Ш) хлоридiнiң, марганец сульфатының, магний хлоридінің ертiндiлерiн құйыңыз және 2-3 мл натрий гидроксидiнiң ерітiндiсiн қосыңыз. б) әлсiз негiздi алу. Бiр пробиркаға 2-3 мл аммоний хлоридiн құйыңыз және 2-3 мл (С(NaОН)=2моль/л) натрий гидроксидiн қосыңыз. Аздап қыздырыңыз. Иісiнен қандай газ бөлiнетiнiн байқаңыз. в) нашар еритiн қышқылды алу. Бiр пробиркаға 2-3 мл натрий силикатының, екiншi пробиркаға 2-3мл аммоний молибдатының ерітiндiсiн құйыңыз. Екi пробиркаға қышқылдардың тұнбалары түзiлгенше тұз қышқылының ерітіндісін қосыңыз. қолданбалы химия кафедрасы г) әлсiз қышқылдарды алу. Бiр пробиркаға 2-3 мл натрий карбонатының ерітiндiсiн, екiншi пробиркаға натрий ацетаты ерітiндiсiн құйыңыз. Екi пробиркаға да тұз қышқылы ертiндiсiн қосыңыз. Бiрiншi пробиркада қандай газ бөлiнедi? Иісiнен екiншi пробиркада қандай қышқыл түзiлгенiн байқауға болады? д) қиын еритiн тұздарды алу. Пробиркаға 1-2 мл қорғасын нитратын құйыңыз, содан кейін натрий хлоридін қосыңыз. Түзiлген тұнбаның түсiн байқаңыз. Тұнбаға калий иодидiн қосыңыз. Тұнба түсi қалай өзгередi? Алынған тұнбаға аммоний сульфидін қосыңыз. Тұнбаның түсін байқаңыз. ЕК-дi пайдаланып осы реакциялардың теңдеулерін жазыңыз. Жұмысты өңдеу Лабораториялық дәптерге барлық жасалған реакциялардың теңдеулерін молекулалық және иондық түрiнде жазыңыз. Әлсiз электролиттер мен қиын еритiн қосылыстардың (еру кестесі) формулаларының қасына Кд және ЕК мәнiн жазып қойыңыз. 
Бақылау сұрақтары 1. Мынадай қиын еритін тұздарды алудың реакция теңдеулерін жазыңыз: барий сульфатын, барий хроматын, күмiс иодидiн, цинк фосфатын. 2. 100 мл-де 8,7 г калий сульфаты болатын ерітіндінің молярлық және нормальдық концентрацияларын анықтаңыз. 3. AgCl-дың таза судағы және 0,1 М KNO3 ерітіндісіндегі ерігіштігін анықтаңыз.
Қолданбалы химия кафедрасының 17.08.2016 ж. отырысында №1 хаттамасында бекітілді
қолданбалы химия кафедрасы № 7 зертханалық жұмыс Тұздар гидролизi
Тұздардың гидролиздену реакцияларын зерттеу, ортаның рН-өзгерiсін және гидролиздiң температура мен сұйылтуға тәуелді екенін байқау.
Жұмыстың мазмұны а) Гидролиз кезiнде қышқылдық тұздардың түзiлуi. б) Гидролиз кезiнде негiздік тұздардың түзiлуi. в) Бiрнеше тұздардың бірге гидролизденуi. г) Температура мен сұйылтудың гидролизге әсерi.
Жұмыстың теориялық негізі Гидролиз деп тұз иондары мен су иондарының арасындағы реакцияны айтады. Реакция нәтижесiнде әлсiз электролиттер түзiледі және ерітiндi ортасының рН өзгереді. I-жағдай. Күштi негiзден және әлсiз қышқылдан түзiлген тұздың гидролизi әлсiз қышқылдың анионы арқылы жүредi: СО32- + НОН Na2CO3 + HOH II-жағдай. Әлсiз негiзден және күштi қышқылдан түзiлген тұздың гидролизi әлсіз негіздің катионы арқылы жүредi: АI3+ + НОН АIСI3 + НОН III-жағдай. Әлсiз қышқылдан және әлсiз негiзден түзiлген тұздың гидролизi катион және анион арқылы жүреді. NН+4 + СН3СОО- + НОН NН4СН3СОО + НОН IV-жағдай. Әлсiз негiзден және әлсiз қышқылдан түзiлген тұздың гидролизi бiр саты бойынша жүретін қайтымсыз процес, егер реакция нәтижесiнде түзiлген заттың бiрi газ күйiнде болса: АI2S3 + 6HOH V-жағдай. Бiрнеше тұздардың бірге гидролизі нәтижесiнде суда ерімейтiн немесе суда кездеспейтiн қосылыстар түзiледi. АI2(SО4)3 + 3Nа2СО3 + 6HOH = 2АI(ОН)3 2АI3+ + 3СО32- + 6НОН = 2АI(ОН)3 қолданбалы химия кафедрасы Барлық тәжiрибеде жүрген гидролиз реакцияларының молекулалық және иондық теңдеулерін жазыңыз, ортаның рН-ын және әлсiз электролиттердiң Кд-ын көрсетiңiз (кесте).
Қолданылатын реактивтер: Тұздар: калий карбонаты, натрий сульфиты, алюминий хлоридi, магний хлоридi, натрий ацетаты, сурьманың қаныққан ерiтiндiсi, дистилденген су, индикаторлар.
Жұмыстың барысы 1- тәжiрибе. Гидролиз нәтижесiнде қышқылдық тұздардың түзiлуi. Екi пробиркаға 2-3 мл дистилденген су құйып, 1-2 тамшы фенолфталеин тамызыңыз және микрошпателмен төменгi тұздардың түйірлерін салыңыз: қолданбалы химия кафедрасы 1-шi пробиркаға калий карбонатын, 2-ге натрий сульфитiн. Әлсiз қышқылдардың диссоциациялану константасын пайдаланып гидролиз реакциясының теңдеуінің бiрiншi сатысын жазыңыз. Қандай тұздың ерiтiндiсiнде фенолфталеиннің бояуы ашық болады? Қандай ерiтiндiде ОН--иондарының концентрациясы жоғарылау болады? Қандай тұздың гидролиздену дәрежесi жоғары болады? 2- тәжiрибе. Гидролиз нәтижесiнде негiздік тұздардың түзiлуi Екi пробиркаға 3-4 мл дистилденген су құйып, келесi тұздарды ерітiңiз: 1-шi пробиркаға - магний хлоридiн, 2-шi пробиркаға - алюминий хлоридiн салып, универсалды индикатор қағазымен ерітіндінің ортасын анықтаңыздар. Қайсысының рН-ы жоғары болады? 3- тәжiрибе. Екi тұздың бiрге гидролизі Бiр пробиркаға 6-8 тамшы алюминий хлоридiн құйыңыз. Оған сонша тамшы натрий карбонатын құйыңыз. Пробиркада көмiртегi(IV) оксидiнiң бөлiнетiнін байқаңыз. Осы жағдайда алюминий гидроксидiнiң тұнбасы түзiледi. Не себептен алюминий карбонаты түзiлмейдi? 4- тәжiрибе. Температураның гидролиздену дәрежесiне әсерi Пробирканың 1/3 бөлігіне дейiн дистилденген су құйыңыз және оған микрошпателмен 2-3 түйір натрий ацетатын салыңыз. Ерiтiндiнiң рН мәнi қаншаға тең? Пробиркаға 1-тамшы фенолфталеин қосыңыз. Пробирканы ыстық су моншасына салыңыз. Фенолфталеиннің түсi қалай өзгередi? Гидролиз процесінің тепе-теңдiгi қандай бағытта ығысады? Осы құбылыстың себептерін көрсетіңіз. 5- тәжiрибе. Ерiтiндiнi сұйылтудың гидролиздену дәрежесiне әсерi Пробиркаға 2-3 тамшы сурьма(III) хлоридiн құйыңыз оған ақ тұнба сурьма хлороксидi - SbОСI пайда болғанша бiртiндеп тамшылатып су құйыңыз. Бұл тұнба гидролиздiң үшінші сатысында су молекуласы бөлiнiп шығуы нәтижесiнде пайда болады. Түзiлген тұнбаны қалай ерiтуге болады, яғни гидролиздiң иондық тепе-теңдiгiн қалай сол жаққа қарай ығыстыруға болады? Жұмысты өңдеу Лабораториялық дәптерге барлық жасалған реакциялардың теңдеулерін молекулалық және иондық түрiнде жазыңыз. Ортаның рН-ын көрсетіңіздер. Бақылау сұрақтары 1. Мына тұздарды атаңыз: KHSO4, Ca(HCO3)2, Fe(OH)ClO4, CrOHSO4. 2. Na3PO4, Cu(NO3)2, KCl тұздарының гидролиздену реакциясының теңдеуін құрыңыздар. 3. 0,01 M HNO3 ерітіндісінің рОН-ын есептеңіз.
Қолданбалы химия кафедрасының 17.08.2016 ж. отырысында №1 хаттамасында бекітілді
қолданбалы химия кафедрасы № 8 зертханалық жұмыс Тотығу-тотықсыздану реакциялары
Тотығу-тотықсыздану реакцияларын жүргiзу. Элементтердiң тотығу дєрежесiн анықтау арқылы реакцияны электрондық баланс немесе иондық-электрондық әдiстері бойынша теңестiру. Тотығу-тотықсыздану реакциясының жүру жағдайларына тәуелді екенін зерттеу. Жұмыстың мазмұны а) Натрий сульфитінің калий перманганатымен әртүрлі ортада тотығуы. б) Аммоний дихроматының молекула ішілік тотығуы. в) Иодтың сілтілік ортада диспропорциялануы. Жұмыстың теориялық негізі Әрекеттесуші заттардың құрамына кіретін атомдардың тотығу дәрежелері өзгере жүретін реакцияларды тотығу-тотықсыздану реакциялары деп атайды. Электрондарын беретін молекулаларды, атомдарды немесе иондарды тотықсыздандырғыштар деп атайды. Реакция кезінде олар тотығады. Электрондарын қосып алатын молекулаларды, атомдарды немесе иондарды тотықтырғыштар деп атайды. Реакция кезінде олар тотықсызданады. Барлық тотығу-тотықсыздандыру реакциялардың теңдеуiн екi жолмен: электрондық баланс және жартылай иондық әдiспен көрсету керек. Мысалы: Zn0 + 2HCl Тотықсыздандырғыш: Zn0 -2е Тотықтырғыш: 2Н+ +2е
Қажетті химиялық реактивтер: 1. Иодтың кристалы. 2. Калий перманганаты, натрий сульфиті, аммоний дихроматы тұздарының ерітінділері. 3. Тұз және күкірт қышқылы. 4. Натрий гидроксидінің ерітіндісі.
Жұмыстың жүру барысы 1-тәжірибе. Натрий сульфитінің калий перманганатымен қышқыл ортада тотығуы. Пробиркаға 2-3 тамшы калий перманганатын тамызып, сондай мөлшерде 2н күкірт қышқылын, содан кейін натрий сульфитін толық түсі жойылғанша құйыңыз. Марганец қышқыл ортада қандай тотығу дәрежесін көрсетеді? қолданбалы химия кафедрасы 2-тәжірибе. Натрий сульфитінің калий перманганатымен нейтрал (бейтарап) ортада тотығуы. Пробиркаға 2-3 тамшы калий перманганатын тамызып, сондай мөлшерде натрий сульфитін қосыңыз. Қандай өзгеріс байқалды? Тұнбаға қандай қосылыс түсті? Ерітіндінің түсі қандай? Марганецтің нейтрал ортадағы тотығу дәрежесі неге тең? 3-тәжірибе. Натрий сульфитінің калий перманганатымен сілті ортада тотығуы. Пробиркаға 2-3 тамшы натрий гидроксидін тамызып, сондай мөлшерде натрий сульфитін қосыңыз. Содан кейін 2-3-тамшы калий перманганатының ерітіндісін құйыңыз. Ерітіндінің түсі қандай түске боялды? 4-тәжірибе. Аммоний дихроматының молекула ішілік тотығу-тотықсыздануы. Құрғақ пробиркаға 2-3 шпатель аммоний дихроматын салып, реакция басталып кеткенше қыздырыңыз. Одан кейін қыздыруды тоқтатыңыз. Реакция нәтижесінде түзілген өнімдерге назар аударыңыздар: азот және су буы, қатты хром оксиді. 5-тәжірибе. Иодтың сілтілік ортада диспропорциялануы Пробиркаға иодтың 1-2 түйірін салып, оған 1-2 мл натрий гидроксидін қосыңыз. Ерітіндінің түсі қалай өзгереді? Сілтілік ортада фтордан басқа барлық галогендерге диспропорциялану реакциясы тән болғандықтан, осы жағдайда натрий иодиді мен натрий иодататы түзіледі.
Жұмысты өңдеу Лабораториялық журналға тәжірибеде қарастырылған химиялық теңдеулерді жазып, электрондық баланс және жартылай иондық әдіспен теңестіріңдер. Тотықтырғыш пен тотықсыздандырғыштарды табыңдар. Бақылау сұрақтары: 1. ТТР реакциясы дегеніміз не? 2. Маңызды тотықтырғыштар, мысал келтіріңіз. 3. Маңызды тотықсыздандырғыштар, мысал келтіріңіз. 4. ТТР реакциясын теңестіру әдістері. 5. Тотықтырғыш пен тотықсыздандырғыштың эквиваленттік молярлық массасын есептеңіздер. Қолданбалы химия кафедрасының 17.08.2016 ж. отырысында №1 хаттамасында бекітілді
қолданбалы химия кафедрасы № 9 зертханалық жұмыс Металдардың кернеу қатары және гальваникалық элемент
Жұмыстың мақсаты Металдардың кернеу қатары, гальваникалық элементтің схемасы мен электр қозғаушы күшін оқып үйрену. Жұмыстың мазмұны а) металдардың кернеу қатары б) гальваникалық элементтің құрылысымен танысу Қолданатын реактивтер мен аспаптар а) мырыш түйіршігі; б) мырыш, темір, қалайы, кадмий, қорғасын, мыс және күміс тұздарының ерітінділері; в) милливольтметр, мыс-мырыш электроды, агар-агар көпіршесі
Теориялық бөлімі Кернеу қатары металдардың химиялық активтiгiн сипаттайды. Бұл қатардан үш маңызды салдар шығады: 1. Неғұрлым кернеу қатарында металл солға қарай орналасқан болса, соғұрлым ол химиялық активті болады, тотықсыздандыру қабілеті жоғары, оңай тотығады және өз иондарынан қиын тотықсызданады. Мысалы: натрий металлтүрінде cыртқы бiр электронын берiп, жеңiл тотығады Na0 -
қолданбалы химия кафедрасы Металдардың кернеу қатары 1-кесте.
Металл иондарының тотықтыру қасиетінің күшеюі ®
Металдар атомдарының тотықсыздандыру қасиетінің күшеюі ®
2. Кернеу қатарындағы әрбір металл өзінен кейін тұратын металдарды олардың тұздарының ерітінділерінен ығыстырады. Мысалы: мыс өзінен кейін тұратын күмісті оның тұзынан ығыстырады Cu0 + 2AgNO3 = Cu(NO3)2 + 2Ag0 3. Кернеу қатарындағы сутегінен бұрын тұратын металдардың барлығы ерітінділерден сутек ионын молекулалық түрінде ығыстырады.
Гальваникалық элемент Гальваникалық элементте тотығу-тотықсыздандыру реакциясының энергиясы электр энергиясына айналады. Электр қозғаушы күштi тотықтырғыш пен тотықсыздандырғыш потенциалдарының айырымы арқылы табады. Кернеу қатарында металдар неғұрлым бiр-бiрiнен алыс тұрса, соғұрлым э.қ.к. жоғары болады.
Жұмыстың барысы 1-ші тәжiрибе. Металдардың кернеу қатары Жеті пробиркаға мырыштың, темірдің(II), қалайының, кадмийдің, қорғасынның, мыстың және күмістің тұздарының ерітінділерін құйыңыз. Мырыш тұзының ерітіндісінен басқасына бірдей мырыштың гранулаларын салыңыз. Нені байқадыңыз? Орын алатын реациялардың теңдеулерін жазыңыз. Мысалы: Zn0 + 2AgNO3 = Zn(NO3)2 + 2Ag0 тотықсыздандырғыш: Zn0 – 2e « Zn2+ тотықтырғыш: 2Ag+ + 2e « 2Ag0 Байқаған өзгерістерді кестеге жазыңыз. Металдар бос түрінде өз тұздарынан бөлініп шыққан жағдайда ионның астында плюс, егер металл бос түрінде бөлініп шықпаса минус қойыңыз. қолданбалы химия кафедрасы
Бөлініп шыққан металдарды тотықсыздандыру қабілеті төмендеген сайын бір қатарға орналастырыңыз және олардың нормалды электродты потенциалдарын көрсетіңіз. Металдардың тәжірибе арқылы алынған қатары олардың металдар кернеу қатарындағы орындарымен сәйкес келе ме?
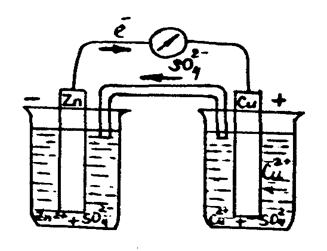
2-тәжiрибе. Даниэль-Якобидің гальваникалық элементiн құру Концентрациялары 1М ZnSО4, CuSO4 және агар-агар толтырылған U-тәрiздi көпірше, мысты және мырышты электродтарды, көлемi 50 миллилитрлiк екi химиялық стакан, штатив, милливольтметр, екi электродты бiр-бiрiмен қосу үшiн қажет болатын сым алыңыз (1 сурет). Екi стаканның бiреуiне 20 мл ZnSО4 құйыныз да оған мырыш электродын батырыңыз, ал екiншiсiне 20 мл CuSО4 ерітіндісін құйыңыз да мыс электродын батырыңыз. Екi стаканды бiр-бiрiне тақау қойып, агар-агар құйылған U-тәрiздi көпіршемен суретте көрсетiлгендей екi стаканды қосыңыз. Екi электродты сым арқылы милливольтметрмен қосыңыз. Электр тоғының пайда болғанын милливольтметр стрелкасының қозғалғанынан байқайсыз.
1 - сурет - Мыс-мырышты гальваникалық элементi.
қолданбалы химия кафедрасы Жұмысты өңдеу 1. Мысты-мырышты гальваникалық элементтiң схемасын салыңыз. 2. Мырыштың анодта тотығу, мыстың катодта тотықсыздану процестердінің теңдеулерін жазыңыз. Гальваникалық элементте жүретін тотығу– тотықсыздану процесінің жалпы теңдеуін жазыңыз. 3. Гальваникалық элементтің электр қозғаушы күшiн есептеңiз.
Бақылау сұрақтары: 1. Күмісті AgNO3 ерітіндісінен ығыстыру үшін қандай металдарды алуға болады? 2. Егер қорғасын пластинкасы темір (II), магний, мыс (II), сынап(II), және күміс нитраттарының ерітінділеріне батырылған болса, қандай металдар және қандай реттілікпен ығысады? Жүретін реакциялардың теңдеулерін жазыңыз.
Қолданбалы химия кафедрасының 17.08.2016 ж. отырысында №1 хаттамасында бекітілді қолданбалы химия кафедрасы № 10 зертханалық жұмыс Тұздардың электролизi
Жұмыстың мақсаты Сулы ерітінділердегі электролиттердің электролизімен танысу, электродтық потенциалды есептеу.
Жұмыстың мазмұны а) Мыс сульфаты ерiтiндiсiнiң электролизi. б) Калий иодидінің электролизі.
Қолданатын реактивтер мен аспаптар а) мыс сульфаты, калий иодиді тұздарының ерітінділері; б) электролиз процесi жүретiн аспап
Теориялық бөлімі
Электролиттің ерітіндісі немесе балқымасы арқылы электр тоғы өткенде жүретін тотығу – тотықсыздану процесі электролиз деп аталады. Электролиз жүргізетін аспап ішіне екі еритін немесе ерімейтін электродтар батырылған электролиттің ерітіндісінен тұрады. Электродтың біреуі сыртқы тоқ көзінің оң полюсына, ал екіншісі теріс полюсына қосылады (1-сурет)
1 - сурет - Электролиз процесi жүретiн аспап
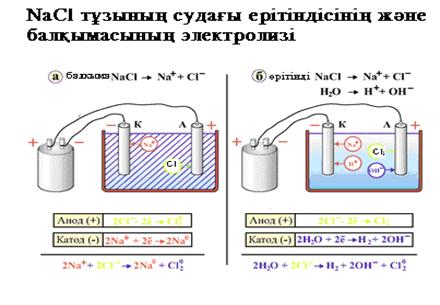
Электролиттің табиғатына және электродтың материалына байланысты электролиздің үш түрін ажыратады: Электролиттің табиғатына және электродтың материалына байланысты электролиздің үш түрін ажыратады: 1) индифферентті электродтарда жүретін тұздың сулы ерітіндісінің электролизі; 2) тұздың балқымасының электролизі; 3) еритін электродта жүретін электролиз немесе металдарды тазарту. 1. Графитті электродтарда жүретін натрий хлоридінің судағы ерітіндісінің қолданбалы химия кафедрасы электролизін қарастырайық. Төменгi схема бойынша катодта сутек ионы тотықсызданып, сутегi молекуласы түзіледі, ал анодта судың молекулалары тотығып оттек бос түрде бөлініп шығады.
Катодты кеңістікте натрий гидроксидi, ал анодты кеңістекте тұз қышқылы түзіледі. 1. Натрий хлоридінің балқымасының электролизі. Электролиз процесі келесі схема бойынша жүреді:
Катодта натрий тотыксызданады, ал анодта хлор тотығады. Электролиз процесі сандық жағынан Фарадей заңымен сипатталады:
мұнда: m – бөлініп шыққан заттың массасы, г I - тоқ күші, A t – уақыт, сек 96500 – Фарадей саны Э – бөлініп шығатын заттың эквиваленттік массасы қолданбалы химия кафедрасы Жұмыстың барысы 1- тәжiрибе. Мыс сульфаты ерiтiндiсiнiң электролизi Электролизерге мыс сульфатының ерiтiндiсiн құйыңыз. Оған графиттен жасалған электродтарды батырып, ерітінді арқылы электр тоғын өткізіңіз.Тәжiрибенi 2-3 минут жүргiзiңiз. Катодта қандай өзгерiс байқалады? Екi электродтарда жүретiн процестерді көрсетiңiз. Анодта қандай газ бөлiнедi?
2-тәжiрибе. Калий йодидiнiң электролизi Пробирканың 3/4 бөлiгiне KI ерiтiндiсiн құйып, оған 5-6 тамшы фенолфталеин және крахмал ерiтiндiсiн қосыңыз. Ерiтiндiнi араластырып электролизерге құйыңыз. Электролизерге графиттен жасалған электродтарды батырып, ерітінді арқылы электр тоғын өткізіңіз. Катодта неге калий бос түрде бөлiнбейдi? Калий, сутегi, йод және оттегiнiң тотығу-тотықсыздандыру потенциалдарын салыстырыңыз. Катодты кеңістікте ерітіндінің түсі қоңыр қызыл түске боялуы электролиз процесі жүргенде қандай иондардың пайда болуымен байланысты. Анодты жєне катодты процестердің теңдеулерін жазыңыз? Анодты кеңістіктегі ерітіндінің көгеруін қалай түсіндіруге болады? Жұмысты өңдеу Лабораториялық дәптерге электролиз схемасын салып, анодтық және катодтық процесті көрсетіп, тотығу-тотықсыздану реакцияларын жазыңдар.
Бақылау сұрақтары: 1. Кальций хлориді ерітіндісінің электролизін өткізгенде, катодта 5,6 г сутек бөлініп шықты. Қандай газ анодта бөлініп шықты? Бөлініп шыққан газдың массасы қаншаға тең? 2. Қорғасын бромидінің балқымасы арқылы 30 минут 3А тең ток өткізгендегі катодта бөлініп шыққан қорғасынның массасын есептеңіз. Қолданбалы химия кафедрасының 17.08.2016 ж. отырысында №1 хаттамасында бекітілді
қолданбалы химия кафедрасы №11 зертханалық жұмыс Металдардың коррозиясы
Жұмыстың мақсаты Коррозияның пайда болуы, химиялық коррозияға әсер ететін факторларды қарастыру.
Жұмыстың мазмұны а) болаттың бетіндегі электрхимиялық құбылыстар; б) көміртектің темірмен жанасу кезіндегі коррозиясы в) хлор ионының активтендіру қасиеті. Жұмыстың теориялық негізі Корозия дегеніміз сыртқы ортаның химиялық және электрохимиялық әсерінен металдардың бұзылуы. Коррозия процесінің жүру механизміне байланысты ол екіге жіктеледі: химиялық және электрохимиялық. Химиялық коррозия дегеніміз металдың сыртқы ортамен химиялық әрекеттесуінен бүлінуі. Темір және оның құймаларынан жасалған бұйымдар ауада күн сәулесі әсерінен су буы және оттегімен химиялық әрекеттесуге ұшырайды:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Тотықсыздандырғыш {Fe0 – 3e → Fe3+ / 12 4 тотығады Тотықтырғыш { 3O2 + 12e → 2O32- / 3 1 тотықсызданады t 2Fe(OH)3 → Fe2O3 + 3H2O
Fe2O3 – қоңыр қызыл түсті. Егер металл құймалардан жасалған бұйымдардың бетінде қоңыр қызыл дақ түссе, ол коррозияның белгісі. Оны болдырмаудың шараларын жасау керек.. Электрохимиялықкоррозия дегеніміз – сыртқы орта әсерінен гальваникалық жұп түзілу нәтижесінде металдың бүлінуі. Егер электролит ерітіндісіне, мысалы, күкірт қышқылына екі металл пластинканы салып, оларды бір-біріне жақындатсақ, гальваникалық элемент түзіледі. қолданбалы химия кафедрасы Гальваникалық элементте теріс электродта тотығу процесі жүреді. Ал коррозия дегеніміздің өзі тотығу процесі. Сонымен, · электрохимиялық коррозия кезінде активтірек металл бұзылады. Мырыш-мыс пластинкасында - мырыш коррозияға ұшырайды.
Zn0 - 2e- → Zn2+
Оң электродта тотықсыздану процесі өтеді. Ерітіндіде Н+ болғандықтан мыс пластинкада сутек ионы тотықсызданады:
2H+ + 2e- → H2
Демек, электрохимиялық коррозия кезінде қышқыл орта болса, активтілігі нашар металдың бетінде сутегі түзіледі.(31-сурет)
Мырышты - мыс пластинкасы натрий хлориді немесе теңіз суына батырылды десек, онда бұл жағдайда мырыш коррозияға ұшырайды. Ал мыс пластинканың бетінде сутегі газ күйінде бөлінбейді. Себебі, бейтарап ортада сутегі ионы тотықсыздануға концентрациясы аз болғандықтан, бұл жағдайда тотықтырғыш ролін суда еріген оттегі атқарады:
О2 + Н2О + 4е- → 4ОН-
Сонымен, мыс пластинкасының маңайында ерітінді сілтіленеді. Коррозия нәтижесінде түзілген мырыш ионы гидроксид ионымен қосылып, мырыш гидроксидін түзеді: Zn2+ + 2 OH- → Zn (OH)2 Ойымызды жинақтасақ, электрохимиялық коррозия бейтарап ортада жүрсе, онда активтілігі нашар металдың маңайында оттегі тотықсызданып, гидроксид ион түзеді. қолданбалы химия кафедрасы Коррозиялық процестегі көп таралған тотықтырғыш көбінесе сутегі ионы мен оттегі молекуласы. Сутегі ионы қатысындағы электродтық процестердің теңдеуі: Mе – n e- ® Mеn+ 2H+ + 2 e- ® H2
Сутегі бөлінуі арқылы жүретін коррозия металға қарағанда сутегі электродының потенциялы оң болған жағдайда ғана орындалады. Бұл жағдайда коррозия жылдамдығы сутегі газының бөліну жылдамдығына, металдың табиғатына, сутегі бөлініп жатқан металдың беттік ауданына тәуелді болады. Оттегі молекуласы қатысындағы электродтық процестердің теңдеуі:
Mе – n e- ® Mеn+ O2 +2H2O + 4e- ® 4OH- Оттегі жұтылуы арқылы жүретін коррозия металға қарағанда оттегі электродының потенциялы оң болған жағдайда ғана орындалады. Бұл жағдайда коррозия жылдамдығы оттегі газының диффузиялану жылдамдығына, демек ерітіндідегі еріген оттегінің концентрациясына тәуелді болады. Жұмыстың жүру барысы 1-тәжірибе. Болаттың бетіндегі электрохимиялық құбылыстар Болаттың бетінде тотықтырғыштардың әсерінен электрохимиялық коррозия байқалады. Бұл процестің нәтижесінде темірдің анодты еруі іске асады. Темірдің ерігенін турнбуль көгі индикаторы қатысында темір(ІІ) ионының әрекетесуінен білеміз. Тәжірибені жүргізу үшін болат пластинканың бетін қайрақпен немесе наждак қағазымен тазалап, сумен жуыңыз, фильтр қағазымен суын сорғытып, кептіріңіз. Одан кейін ферроксилиндикаторға матырылған фильтр қағазын қойыңыз. Ферроксилиндикатордың құрамы: 100 см3 су + 3 г ас тұзы + 0,1 г (K3[Fe(CN)6] + бірнеше тамшы фенолфталеин 2-3 минуттан кейін фильтр қағазындағы түстің өзгеруін, дақтың пішінін, оның таралуын бақылаңыз. Реакциялардың электродтық потенциалына сүйеніп, өзгерістерді түсіндіріңіз. Қажетті теңдеулерді жазыңыз. 2-тәжірибе. Бейтарап ортадағы электрохимиялық коррозия. Екі пробиркаға ас тұзы ерітіндісін құйып, оған мырыш пен мысты жанастыра орналастырамыз. Бір екі тамшы фенолфталеин қосыңдар. Не байқадыңыздар? Катодтық және анодтық үрдісті жазыңдар. 3-тәжірибе. Хлор ионының активтендіру қасиеті. Екі пробиркаға мыс сульфатының сірке қышқылы қосылған ерітіндісін құйыңыз. Олардың біреуіне натрий хлоридін қосыңыз. Одан кейін екі пробиркаға да алюминий сынығын салыңыз. Қайсы пробиркада белсенді түрде газ бөлінеді? қолданбалы химия кафедрасы
Анодтық, катодтық және қосынды процестердің теңдеулерін жазыңыз. Хлор ионының реакция жылдамдығына әсерін түсіндіріңіз. Жұмысты өңдеу Әрбір тәжірибеде жүретін коррозиялық процесті бақылап, олардың қажетті теңдеулерін жазыңдар. Катодтық және анодтық процестің теңдеулерін жазып, коррозияның жылдамдығы неге тәуелді болатынын сипаттап жазыңдар. Бақылау сұрақтары 1. Металдар коррозиясы дегеніміз не? 2. Коррозияның түрлері қандай? 3. Химиялық коррозия мен электрохимиялық коррозияның айырмашылығы неде? 4. Сутегі бөлінуі арқылы жүретін коррозиялар, ол неге тәуелді? 5. Оттегі жұтылуы арқылы жүретін коррозия, оның жылдамдығы неге тәуелді? Қолданбалы химия кафедрасының 17.08.2016 ж. отырысында №1 хаттамасында бекітілді
қолданбалы химия кафедрасы № 12 зертханалық жұмыс КОМПЛЕКСТІ ҚОСЫЛЫСТАР Жұмыстың мақсаты Комплекс қосылыстардың химиялық қасиеттерін, оларды алу әдістерін, комплекстердің тұрақтылығын анықтау. Қос тұздарды комплекс тұздардан айыра білу.
Жұмыстың мазмұны 1. Анионды комплекс қосылыстың түзілуі. 2. Катионды комплекс қосылыстың түзілуі. 3. Қос комплекс ионды қосылысты алу. 4. Fe2+ және Fe3+ иондарын анықтау үшін реакциялар жүргізу.
Теориялық бөлім Молекулаларды өзіне тартып немесе қарама-қарсы зарядталған иондардың күрделі иондарға айналуын комплексті иондар дейді. Комплексті иондардан құралған заттар комплексті қосылыстар деп аталады. Комплексті қосылыстар құрамында бір немесе бірнеше донорлы-акцепторлы байланыс болатын жоғары ретті қосылыстар. Швейцария ғалымы Альфред Вернер (1893 ж.) ұсынған координациялық теориясының негізгі қағидалары: 1. Комплексті қосылыстардағы басты орын комплекстүзушінің үлесіне тиеді. Комплекстүзуші оң зарядталған металл иондары бар. 2. Комплекстүзушінің маңайына теріс зарядталған аниондар лигандалар орналасады. 3. Лигандалардың жалпы саны комплекстүзушінің координацияланған саны деп аталады. 4. Комплекстүзуші мен лигандалар ішкі сфераны түзеді. 5. Ішкі сфераға сыймай қалған иондар комплексті қосылысының сыртқы сферасын түзеді. Қолданылатын реактивтер Висмут(III) нитраты, калий иодиді, мыс сульфаты, калий гексацианоферраты(ІІІ) – (қызыл қан тұзы), темір(ІІІ) хлориді, темір(ІІ) сульфаты, Мор тұзы – (NH4)2SO4*FeSO4, K4[Fe(CN)6] – калий гексацианоферраты (ІІ) – (сары қан тұзы) тұздарының ерітіндісі. Жұмыстың барысы 1-тәжірибе. Аниондық комплекс қосылыстың түзілуі Калий тетраиодовисмутатын алу. 2-3 мл висмут (III) нитраты бар пробиркаға калий иодидінің ерітіндісін тұнба түскенше тамшылатып құйыңыз. Тұнбаның түсі қандай? Содан соң тұнбаға 2-3мл калий иодидінің ерітіндісін тұнба толық еріп кеткенше құйыңыз. Ерітіндіде калий тетраиодовисмутаты түзіледі. Реакция теңдеуін жазыңыз.
қолданбалы химия кафедрасы 2-тәжірибе. Катиондық комплекс қосылыстың түзілуі. а) Никельдің аммиакты комплексін алу. Никель сульфатына натрий гидроксидін қосып никельдің гидроксидін алыңыз. Алынған тұнбаның үстіндегі ерітіндіні раковинаға ақырындап төгіңіз. Тұнбаны төгіп алмаңыз. Тұнбаның түсі қандай? Реакция теңдеуін жазыңыз. Тұнбаға Ni(OH)2 25%-ті аммиактың ерітіндісін тұнба толық еріп болғанша құйыңыз. Гексамминникель гидроксидінің түзілу реакциясының теңдеуін жазыңыз. Никель сульфатындағы никель ионының Ni2+ түсін мына күрделі катионның [Ni(NH3)6]2+ түсімен салыстырыңыз. Ерітіндінің түсі қай ионға байланысты өзгереді? Екі негіздің Ni(OH)2 мен [Ni(NH3)6](OH)2 қайсысы күшті электролит болып есептеледі? Неге? Никель гидроксидінің ерігіштік көбейтіндісін – ЕК және гексамминникель гидроксидінің тұрақсыздық коэффициентін - Ктз оқулықтан тауып алып, салыстырыңыз. б) Мыстың аммиакты комплексін алу. Пробиркаға 2-3мл мыс (ІІ) хлоридін немесе мыс сульфатын құйып алып оған тамшылатып мыс гидроксидінің тұнбасы түзілгенше концентрлі аммиак ерітіндісін (аммоний гидроксидін) қосыңыз. Сонан соң аммиактың артық мөлшерін құйып түзілген тұнбаны ерітіңіз. Осы тәжірибе кезінде мыс гидроксиді түзілуінің және бұл қосылыстың аммиакпен әрекеттесіп комплекс қосылыс тетрааминмыстың гидроксиді түзілу реакцияларының теңдеулерін жазыңыз. Мыс гидроксидінің, тетраамин мыстың гидроксиді ерітінділерінің түстерін салыстырып олардың неге әртүрлі болатының дәлелдеңіздер. Түзілген комплекстік негіздің бірінші ретті және екінші ретті диссоциациясын жазыңыз. Осы комплекстің номенклатура бойынша атын жазыңыз. 3-тәжірибе. Қос комплекстің түзілуі Комплекс катионы мен комплекс анионы бар қосылыстың түзілуі. 2-3мл калий гексацианоферраты(ІІ) бар пробиркаға тұнба түскенше никель сульфатын қосыңыз. Түзілген никель гексацианоферрат (ІІ) тұнбасының түсі қандай? Содан соң тұнба еріп біткенше 25 %-аммиактың ерітіндісін құйыңыз. 1-2 минуттан кейін ерітіндіде ашық қызыл түсті тұздың [Ni(NH3)6]2[Fe(CN)6] кристалы түзіледі. Реакция теңдеуін жазыңыз. 4-тәжірибе. ІІ-ІІІ темір иондарына сапалы реакциялар а) Мор тұзының – (NH4)2Fe(SO4)2×24H2O ерітіндісіне 2-3мл калий гексацианоферратын (ІІІ) қосыңыз. Тұнбаның түзілгенін байқаңыз да түсін анықтаңыз. Тұнба қалай аталады? Ерітіндіде қызыл қан тұзымен қай ионды анықтауға болады? Тұнба калий гидроксидімен әрекеттесе ме? б) Аздап үстіне тұз қышқылы қосылған 2-3мл темір (ІІІ) хлоридіне 2-3мл калий гексациано-ферратын (ІІ) құйыңыз. Тұнбаның түскенін байқаңыз. Тұнбаның түскенін анықтап, реакция теңдеуін жазыңыз. Тұнбаны қалай деп атайсыз? Сары қан тұзымен ерітіндіде қай ионды анықтайды? Тұнбаға натрий гидроксиді әсер ете ме? қолданбалы химия кафедрасы Бақылау сұрақтары: 1. Комплекстүзуші дегеніміз не? Мысалдар келтіріңіз. 2. Комплекстер түрлері (заряд бойынша)? Мысалдар келтіріңіз. 3. Келесі комплексті қосылыстардың координациялық формулаларын жазыңыздар: 3KCN×Fe(CN)3; 2KNO2×NH3×Co(NO2)3. Жұмысты өңдеу Лабораториялық журналға, комплексті қосылыстар ІІ сатысы бойынша түзілетін ескерте отырып, барлық өтетін реакциялардың І және ІІ сатылардың теңдігін жазыңыздар. Комплекстердің тұрақсыз константалырының кестесін қолданып олардың тұрақтылығын түсіндіріңіз.
Қолданбалы химия кафедрасының 17.08.2016 ж. отырысында №1 хаттамасында бекітілді
қолданбалы химия кафедрасы Әртүрлі температурадағы су буының қысымы, кПа
Атмосфералық қысым, кПа
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 1093. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Жұмыстың мақсаты
Жұмыстың мақсаты  НСО-3 + ОН-
НСО-3 + ОН- 7.
7. + 3H2S
+ 3H2S  яғни pH
яғни pH 

 Жұмыстың мақсаты
Жұмыстың мақсаты
 Zn2+Cl2- +H20
Zn2+Cl2- +H20

 « Na+, өйткенi натрийдiң стандартты потенциалы
« Na+, өйткенi натрийдiң стандартты потенциалы