
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Определение подвижных форм тяжелых металлов в донных отложениях и почвах методом ИВАМОпределение подвижных форм металлов Zn и Pb предполагает перевод их из связанных форм в раствор. Для этого применяли вытяжку с помощью ацетатно-амонийного буферного раствора. Сначала брали навеску проб почв и донных отложений 1 г, к которой после добавляли ААБ объемом 10 мл с pH=4,8. В течение часа взбалтывали полученные растворы и затем сутки настаивали их. Расчет концентрации ТМ в пробах почв и донных отложений р. Ички производился по формуле: Х*20мл*10000/al = C (мг/л), где Х – показания прибора (концентрация металлов (мг/дм3) в 20 мл раствора пробы), al – объем аликвоты пробы (мл). Результаты расчетов приведены в таблицах Табл.3.4.6 Результаты определения подвижных форм тяжелых металлов методом вытяжек в пробах почв и донных отложениях воды р. Ички
Кадмий и медь в донных отложениях обнаружены не были. В донных отложениях створа №2 содержание свинца ниже предела обнаружения. С удалением от дороги увеличивается процент водорастворимых форм цинка, а процент водорастворимых форм свинца уменьшается. Таким образом, цинк более подвижен, чем свинец. Водорастворимые формы цинка являются экологически опасными, так как способны к миграции.  Концентрация подвижных форм свинца в пробах почв увеличивается по мере отдаления от МКАД. Возможно, это связано с какими-либо локальными свалками (свинцовые провода, трансформаторная будка) 3.5 Карбонатная система Неорганические соединения углерода находятся в природных водах в виде угольной кислоты и ее производных. В отличие от сильных соляной и серной кислот, которые полностью диссоциируют в растворе, угольная кислота является слабой. Поэтому она диссоциирует не полностью, и в растворе одновременно присутствуют ионы Чтобы определить концентрации ионов
Расчет концентраций карбонат- и бикарбонат-ионов по измеренным величинам щелочности и рН Определение общей щелочности Принцип метода. Определение щелочности проводится объемным ацидиметрическим методом, основанном на взаимодействии бикарбонат- и карбонат-ионов с сильной соляной кислотой. При титровании диссоциированные формы угольной кислоты ( При рН ³ 8.1 в растворе присутствуют в достаточном количестве ионы В диапазоне рН от 4.5 до 8.0 (при рН < 4.5 все формы переходят в Ход определения. К 50 мл исследуемого раствора добавляют 3–4 капли смешанного индикатора и титруют 0.05 N HCl до слабо розовой окраски. Выделяющийся при этом СО2 удаляется продуванием воздухом, пропускаемым через аскаритовую трубку. Вычисление результатов анализа: где Расчет концентраций карбонат- и бикарбонат-ионов по измеренным величинам щелочности и рН
Основные теоретические положения. Слабая угольная кислота диссоциирует в растворе по двум ступеням:
Константы равновесия реакций (2) и (3) представляют собой первую и вторую константы диссоциации угольной кислоты:
где В атмосферном воздухе содержится углекислый газ, парциальное давление (
Перемножив
Однако поверхностные воды далеко не всегда равновесны с углекислой атмосферы. Главная причина неравновесности – продукционно-деструкционные процессы, которые приводят либо к подщелачиванию, либо к подкислению среды, постоянно изменяя соотношение между компонентами карбонатной системы. Расчет концентрационной константы равновесия второй ступени диссоциации угольной кислоты (
Значение
где T – температура в °K (T, °K = 273.16 + T, °С). При температуре 25 °С получим, что По определению общий коэффициент активности ионов i (
Коэффициенты активности свободных ионов в природных водах различной минерализации удовлетворительно описываются в рамках теории Дебая-Хюккеля третьего приближения, в частности, с помощью полуэмпирического уравнения Девиса:
где В соответствии с результатами исследований, проведенных на Можайском водохранилище [Савенко, 2000], примем, что ионные пары Вкладом ионных пар
Теперь, после того как мы рассчитали величины
Расчет концентраций карбонат- и бикарбонат-ионов. Из уравнения (6) следует, что
Подставив выражение для
получим:
Отсюда по измеренным величинам щелочности и рН (
Расчет концентрации ионов Результаты определений величин щелочности и рН в пробах и расчетные значения концентраций ионов
ф – фильтрованная нас – насыщенная СaCO3
Таблица 3.5.2 Расчет концентраций карбонат- и бикарбонат-ионов по измеренным величинам щелочности и pH
ф – фильтрованная нас – насыщенная СaCO3 2. Оценка степени насыщения вод по карбонату кальция Для оценки степени насыщения вод по карбонату кальция проводилось насыщение раствора, которое создавалось путем добавления навески карбоната кальция в исследуемые пробы профильтрованной воды. Затем производилось встряхивание полученного раствора для растворения навески в течении двух суток.
Ионы
По определению степень насыщения раствора относительно CaCO3 (
где Поскольку для вод изучаемого района различия общих коэффициентов активности ионов Ca2+ и
где в числителе и знаменателе находятся концентрации ионов Ca2+ и Для проведения расчетов необходимо определить концентрацию ионов Ca2+ и вычислить содержание карбонат-ионов по измеренным величинам щелочности и рН. Результаты расчетов представлены в табл. 3 (см. образец). Определение концентрации кальция Принцип метода. Определение концентрации ионов кальция проводится объемным трилонометрическим методом, основанном на применении сильного комплексообразователя трилона Б в присутствии индикатора мурексида. Мурексид представляет собой однозамещенную аммониевую соль пурпурной кислоты ( Определение нормальности трилона Б. Пипеткой отмеряют 5 мл 0.1 N раствора MgSO4 и доливают до 50 мл дистиллированной водой. Затем добавляют
Определение кальция. К 50 мл исследуемого раствора добавляют 2.5 мл 2 М NaOH и ~ 0.2 г индикатора мурексида, смешанного с NaCl. Титруют 0.05 N раствором трилона Б до появления четко выраженной лиловой окраски, устойчивой в течение Вычисление результатов анализа:
где Результаты расчетов представлены в таблице 3.5.3 Таблица 3.5.3.Расчет степени насыщения вод у р. Ички по карбонату кальция
ф – фильтрованная нас – насыщенная СaCO3 Полученные результаты свидетельствуют о том, что воды в р. Ички не насыщены по карбонату кальция. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 461. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 ,
,  и
и 
 в растворе, проводят измерения величин рН и общей щелочности (Alk), которая представляет собой сумму анионов слабых кислот – угольной H2CO3, фосфорной H3PO4, кремниевой H2SiO3, сероводородной H2S, борной H3BO3, уксусной CH3COOH и др. По сравнению с угольной кислотой, вклад анионов других слабых кислот пренебрежимо мал, и отличия общей щелочности от карбонатной, как правило, незначительны. Поэтому с достаточным приближением можно принять
в растворе, проводят измерения величин рН и общей щелочности (Alk), которая представляет собой сумму анионов слабых кислот – угольной H2CO3, фосфорной H3PO4, кремниевой H2SiO3, сероводородной H2S, борной H3BO3, уксусной CH3COOH и др. По сравнению с угольной кислотой, вклад анионов других слабых кислот пренебрежимо мал, и отличия общей щелочности от карбонатной, как правило, незначительны. Поэтому с достаточным приближением можно принять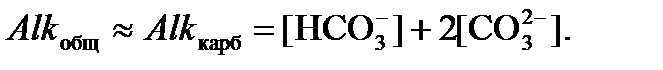 (1)
(1)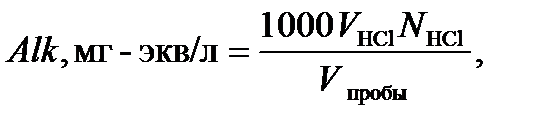 (2)
(2)  – количество HCl, израсходованной на титрование пробы, мл;
– количество HCl, израсходованной на титрование пробы, мл;  – нормальность раствора HCl (0.05 N);
– нормальность раствора HCl (0.05 N);  – объем пробы, мл.
– объем пробы, мл. , (3)
, (3) (4)
(4) , (5)
, (5)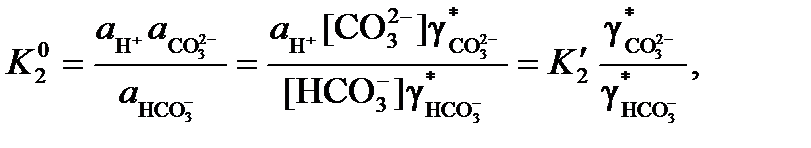 (6)
(6) и
и  – соответственно термодинамическая и концентрационная константы равновесия; а, [ ] и g* – активности, концентрации и общие коэффициенты активности ионов.
– соответственно термодинамическая и концентрационная константы равновесия; а, [ ] и g* – активности, концентрации и общие коэффициенты активности ионов.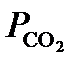 ) которого равно 3.8 ´ 10–4 атм. При равновесии воды с атмосферой концентрация недиссоциированной угольной кислоты (
) которого равно 3.8 ´ 10–4 атм. При равновесии воды с атмосферой концентрация недиссоциированной угольной кислоты (  ) связана с
) связана с  через константу Генри (
через константу Генри (  ):
): . (7)
. (7)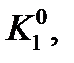
 и
и  с активностью ионов
с активностью ионов  при условии равновесия воды с атмосферой:
при условии равновесия воды с атмосферой: . (8)
. (8)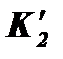 ). В качестве основного параметра в расчетах будем использовать константу
). В качестве основного параметра в расчетах будем использовать константу (9)
(9) зависит от температуры раствора и вычисляется с помощью эмпирического уравнения связи [Робинсон, Стокс, 1963]:
зависит от температуры раствора и вычисляется с помощью эмпирического уравнения связи [Робинсон, Стокс, 1963]: (10)
(10)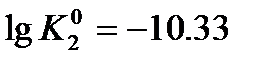 , откуда
, откуда 
 .
. ) равен произведению коэффициента активности свободных ионов (
) равен произведению коэффициента активности свободных ионов (  ) и их доли от общего содержания компонента i в растворе (
) и их доли от общего содержания компонента i в растворе (  ) [Робинсон, Стокс, 1963]:
) [Робинсон, Стокс, 1963]: (11)
(11) (12)
(12) – заряд иона i; A – постоянная величина, равная 0.5115 при 25 °С; I – ионная сила раствора, которую для вод исследуемого района можно принять равной 0.005.
– заряд иона i; A – постоянная величина, равная 0.5115 при 25 °С; I – ионная сила раствора, которую для вод исследуемого района можно принять равной 0.005. = 0.93.
= 0.93. и
и  также можно пренебречь, однако с Ca2+ и Mg2+ связана примерно половина ионов
также можно пренебречь, однако с Ca2+ и Mg2+ связана примерно половина ионов  . Поэтому для расчета общего коэффициента активности карбонат-ионов будем использовать эмпирическое уравнение связи, полученное с учетом температурных зависимостей констант устойчивости ионных пар
. Поэтому для расчета общего коэффициента активности карбонат-ионов будем использовать эмпирическое уравнение связи, полученное с учетом температурных зависимостей констант устойчивости ионных пар  и
и  , приведенных в работе [Робинсон, Стокс, 1963]:
, приведенных в работе [Робинсон, Стокс, 1963]: = 0.40. (13)
= 0.40. (13)
 и
и  , получим искомое значение концентрационной константы равновесия
, получим искомое значение концентрационной константы равновесия  :
: = 1.08 ´ 10–10. (14)
= 1.08 ´ 10–10. (14) (15)
(15) в уравнение
в уравнение (16)
(16) (17)
(17) ) и расчетному значению
) и расчетному значению  мы можем определить концентрации ионов
мы можем определить концентрации ионов  и
и  :
: (18)
(18) (19)
(19) можно проверить по уравнению (15).
можно проверить по уравнению (15).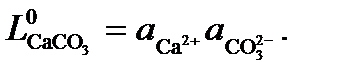 (20)
(20) ) равна [Хамский, 1979]:
) равна [Хамский, 1979]: (21)
(21) и a – соответственно активности ионов в исследуемых растворах в естественном состоянии и в тех же растворах после их насыщения по CaCO3, которое создается путем добавления навески карбоната кальция.
и a – соответственно активности ионов в исследуемых растворах в естественном состоянии и в тех же растворах после их насыщения по CaCO3, которое создается путем добавления навески карбоната кальция. (22)
(22) ). Водный раствор мурексида в сильнощелочной среде (рН > 10) имеет лиловый цвет, обусловленный окраской анионов пурпурной кислоты. В присутствии ионов кальция раствор мурексида окрашивается в красный цвет за счет образующегося комплекса пурпурата кальция –
). Водный раствор мурексида в сильнощелочной среде (рН > 10) имеет лиловый цвет, обусловленный окраской анионов пурпурной кислоты. В присутствии ионов кальция раствор мурексида окрашивается в красный цвет за счет образующегося комплекса пурпурата кальция –  . При титровании такого раствора трилоном Б образуется более прочное комплексное соединение кальция с трилоном, а ионы пурпурной кислоты освобождаются и окрашивают раствор в лиловый цвет.
. При титровании такого раствора трилоном Б образуется более прочное комплексное соединение кальция с трилоном, а ионы пурпурной кислоты освобождаются и окрашивают раствор в лиловый цвет. , (23)
, (23) (24)
(24) – количество трилона Б, израсходованного на титрование пробы, мл;
– количество трилона Б, израсходованного на титрование пробы, мл;  – нормальность раствора трилона Б (0.05 N);
– нормальность раствора трилона Б (0.05 N);