Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Глава 2. Методики полевых исследований, отбора и обработки пробВыбор сред опробования и его обоснование Основным методом изучения загрязнения территорий является эколого-геохимическое картирование. Оно производится путем опробования различных сред (почв, вод, донных отложений и т.д.) для выявления в них геохимических аномалий, которые могут иметь природный или техногенный характер. Воздействие промышленных предприятий и транспорта осуществляется через попадание загрязнителей на поверхность почв и их последующее усвоение корневой системой растений. Одновременно почвы, как депонирующая среда, наряду с промышленными стоками, являются источником вторичного загрязнения донных отложений и природных вод, вследствие чего существует необходимость изучения взаимосвязи систем почва -донные отложения и донные отложения - поверхностные воды. Эколого-геохимическая оценка территории, на которое оказывается долговременное воздействие, должна быть тесно увязана с временным фактором, В контексте временного фактора характер загрязнения и соответствующая среда опробования тесно увязываются в следующую схему: -долговременное загрязнение - почвы, донные отложения; -временное загрязнение - поверхностные воды [3]. При опробовании компонентов окружающей среды используются регулярные и нерегулярные сети наблюдения. Преимущество регулярных квадратных сетей для геохимических аномалий в почвах, на которые воздействует множество источников загрязнения, расположенных по периферии, очевидно. Выбор плотности опробования связан с масштабом карты (по соответствующим нормативным документам). В свою очередь условный масштаб определяется задачами, в т.ч. размером геохимических аномалий. Оптимальной была признана плотность наблюдений 1 проба/км2, с последующей детализацией участков, на которые выпадает основная техногенная нагрузка.[3]  Направление профиля выбрано под углом 45° к линейному источнику загрязнения, в нашем случае полотну МКАД, для определения изменения концентраций в зависимости от удаления источника загрязнения по профилю. Методика изучения загрязнения вод и донных отложений представляет собой определение влияния источников предполагаемого техногенного загрязнения путем размещения пунктов опробования выше и ниже их по течению реки. При наличии множества внешних и внутренних источников загрязнения наиболее рациональным является равномерное опробование водотоков. В данном случае отбор производился в непосредственной близости к предполагаемому источнику загрязнения и в городской черте. Решение задач по выявлению и оценке загрязнения компонентов окружающей среды подразумевает выбор адекватных методов анализа проб. Основными критериями при выборе аналитических методов служат: набор предполагаемых и интересующих химических элементов нижний предел обнаружения, правильность и воспроизводимость результатов анализа. [3] Методика отбора и обработки почв Опробование почв НП по профилю проводилось в районе 97 км МКАД. Профиль приурочен к квартальной просеке, ориентированной под углом 45° к дорожному полотну. Отбор проводился из верхнего гумусового горизонта (до глубины 10-15 см) на полосе отчуждения и на территории парка. На полосе отчуждения была отобрана 1 проба – в непосредственной близости от МКАД (кромка дорожной насыпи). На территории парка пробы отбирались с шагом опробования 20 м до 100 м, далее – 50 м до общей протяженности профиля 400 м. Всего было отобрано 12 проб, каждая из которых упаковывалась в полиэтиленовый пакет с указанием номера на этикетке. Опробование сопровождалось полевой документацией с указанием номера пробы, механического состава, характеристики отложений, характера растительности и рельефа, а так же источника загрязнения. Затем происходило изучение проб в лабораторных условиях. Предварительная подготовка проб к анализу проводилась в лаборатории и включала в себя их просушивание на воздухе и просеивание через сито с диаметром 1 мм. Опробование вод и донных отложений водоемов Опробование воды. Методика изучения загрязнения вод и донных отложений представляет собой определение влияния источников предполагаемого техногенного загрязнения путем размещения пунктов опробования выше и ниже их по течению реки. При наличии множества внешних и внутренних источников загрязнения наиболее рациональным является равномерное опробование водотоков. В качестве поверхностных вод отбирались воды реки Ички, дважды пересекающей МКАД и испытывающей от нее максимальное воздействие. Опробование проводилось: - в непосредственной близости от МКАД, в месте пересечения с ней в 1,5 км к востоку от границы парка (створ 2); - в городской черте, через 400м после выхода реки из парка (створ 1). Отбор воды проводился в пластиковые бутыли объемом 1,5 л, предварительно промытые дистиллированной водой и затем водой отбираемой пробы . Отбор проб производился «под крышку»,с целью ограничить доступ кислорода и последующего окисления воды, с глубины примерно 5 см, каждая проба была промаркирована в соответствии с местом отбора. На обоих створах были произведены замеры параметров реки для последующих расчетов расхода реки. Для расчета скорости течения реки мы измеряли за какое время спичка опущенная на реку пройдет заданное и измеренное нами расстояние. Поперечное сечение реки аппроксимировано прямоугольником, расход считался умножением средней скорости на площадь сечения реки. Табл. 2.3.1 Параметры воды и берега р. Ички (створ 1)
Табл. 2.3.2 Параметры воды и берега р. Ички (створ 2)
Погрешность измерений всех параметров характеризуется шкалой используемых предметов таких как линейка и рулетка таким образом погрешность измерений: ±1см. Опробование донных отложений р. Ички проводилось в местах отбора проб воды из верхней части донных отложений на глубине до 10 см. Пробы отбирались в пластиковые стаканы и закрывалась крышкой, каждый стакан подписывался в соответствие с номером створа. По составу отложений представлен песчано-глинистым материалом аллювия реки. Глава 3. Методы лабораторных исследований Потенциометрия В ходе лабораторных исследований измерение количества ионов натрия, хлора, а также водорода проводилось методом потенциометрии. Потенциометрия - электрохимический метод количественного анализа, основанный на измерении электродвижущей силы гальванического элемента с индикаторным электродом. Суть этого метода заключается в том, что измеряется потенциал между электродом сравнения и индикаторным электродом, а затем строится градуировочный график, выражающий зависимость измеряемого потенциала от концентрации определяемых ионов в лабораторных условиях. Если индикаторный электрод, потенциал которого меняется в зависимости от состава раствора, и электрод сравнения с постоянным потенциалом погрузить в исследуемый раствор, то мы получим гальванический элемент. Электродвижущая сила (э.д.с.) этого элемента зависит от концентрации ионов, к которым чувствителен индикаторный электрод. Например, потенциал стеклянного электрода чувствителен к рН и т.д. Э.д.с. гальванического элемента такого вида нельзя измерить обычным вольтметром; чтобы электроды могли приобрести свои равновесные потенциалы, э.д.с. нужно измерять, не отводя значительного тока от элемента. Прибор, который обычно используют для подобных измерений, называют потенциометром. Такой прибор и был использован нами при проведении анализа воды и водных вытяжек из почв. Электрод сравнения обладает известным потенциалом, не зависящим от исследуемого раствора. В нашей работе мы использовали хлорсеребряный электрод. В действительности это электрод и солевой мостик, объединенные в одном элемента. Трубка находится в контакте с раствором хлорида калия. Раствор хлорида калия также служит мостиком к исследуемому раствору, контакт с которым осуществляется через асбестовые волокна или пористый стеклянный цилиндр. В качестве индикаторных электродов на натрий и водород используют стеклянные электроды, на хлор – электроды с твердыми мембранами, а на кальций – электроды с жидкостными мембранами. Измерение рН проводилось на потенциометре ЭСЛ-43-07. Электрод сравнения (хлорсеребряный) этого потенциометра погружен в раствор электролита и находится в стеклянном корпусе. В качестве индикаторных электродов на натрий и водород используют стеклянные электроды, на хлор – электроды с жидкими мембранами. Схематически стеклянный электрод изображен на рисунке 3.1.1. Он состоит из электрода сравнения (обычно хлор-серебряный электрод), погруженного в раствор электролита. Для стеклянных электродов, чувствительных к ионам водорода, электролитом служит разбавленная соляная кислота. Электрод сравнения и НСl погружают в шарик из специального стекла, представляющего собой проводящую мембрану. Стекло должно иметь определенный химический состав и характеризоваться особыми физическими свойствами. Изменяя его состав, можно получать электроды, селективные к другим ионам. Разность потенциалов, возникающая на стеклянной мембране, является функцией разности логарифмов активностей ионов водорода в соляной кислоте внутри электрода и в исследуемом растворе.
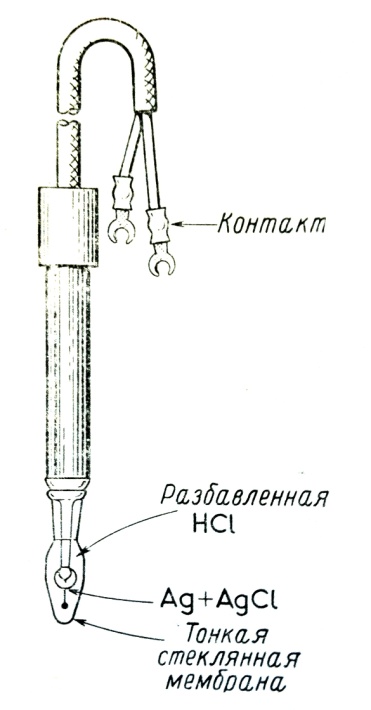
Рис. 3.1.1. Стеклянный электрод
Характерной особенностью стеклянных электродов является то, что в нем электрод сравнения является внутренним, т.е расположен в одном стеклянном корпусе с индикаторным. Такой тип электродов называется комбинированным. Потенциал ионоселективного электрода определяется следующим уравнением:
E = k + RT/ZiF*ln ai/ai*
где Е – потенциал стеклянного электрода, k – константа, Zi – заряд иона i, ai – активность иона в исследуемом растворе, ai* - активность иона в растворе, заполняющем электрод. При 25° С для электрода, селективного к однозарядным ионам это уравнение примет следующий вид: Е = const + 0,059 lg ai. Для стеклянных Н+ селективных электродов это уравнение можно записать, используя рН: Е = const - 0,059 рН. Измерение рNa велось с помощью электрода ЭЛИС-112 Na. Этот электрод, как и ЭСЛ-43-07, относится к классу стеклянных. Электрод ЭЛИТ 261, использованный нами для измерения рCl, относится к другому классу потенциометров. Это электрод с жидкостной ионообменной мембраной. В целом этот электрод похож на стеклянный, так как содержит внутренний электрод сравнения и раствор известного состава. Вместо стеклянной мембраны в нем используется мембрана из тонкого пористого органического полимера, который насыщен раствором жидкого ионита, растворенного в не смешивающемся с водой органическом растворителе. На границах раздела мембраны с растворами возникают потенциалы, но так как состав внутреннего водного раствора постоянен, потенциал мембраны меняется лишь с изменением состава исследуемого раствора, влияющего на потенциал внешней границы раздела. Потенциал мембраны, селективной по отношению к иону i, в растворе, содержащем посторонний ион j той же концентрации, выражается следующим уравнением:
E = const + 2,3RT/ZiF*lg(ai + ujDj/uiDi*aj)
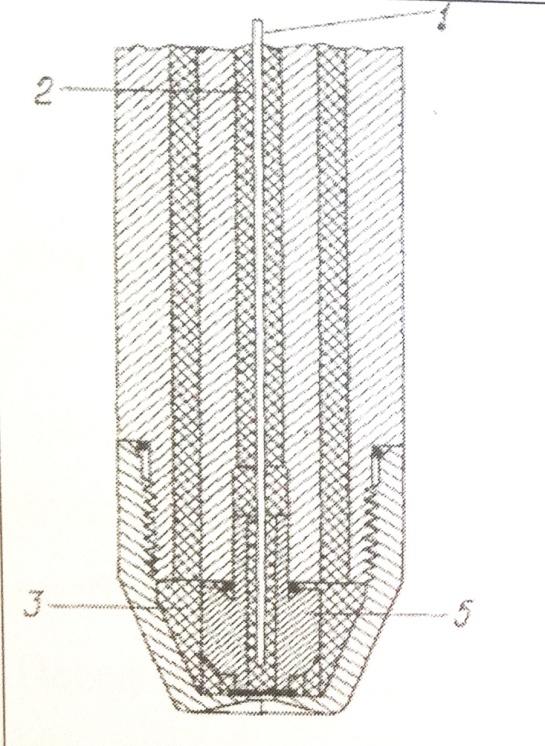
где ui и uj – подвижности двух ионов в мембране, а Di и Dj – коэффициенты распределения i и j соответственно между водной фазой и мембраной. Избирательность мембранного электрода к данному иону прежде всего определяется используемым жидким ионитом и возрастает с увеличением сродства ионита к данному иону по сравнению с другими ионами. Схематически такой электрод изображен на рис. 3.1.2
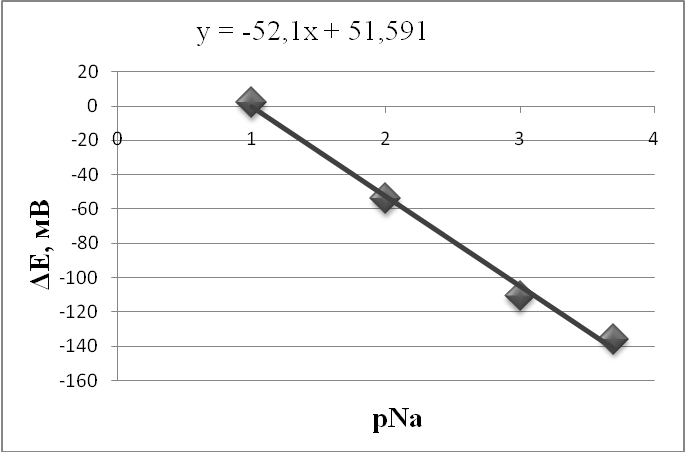
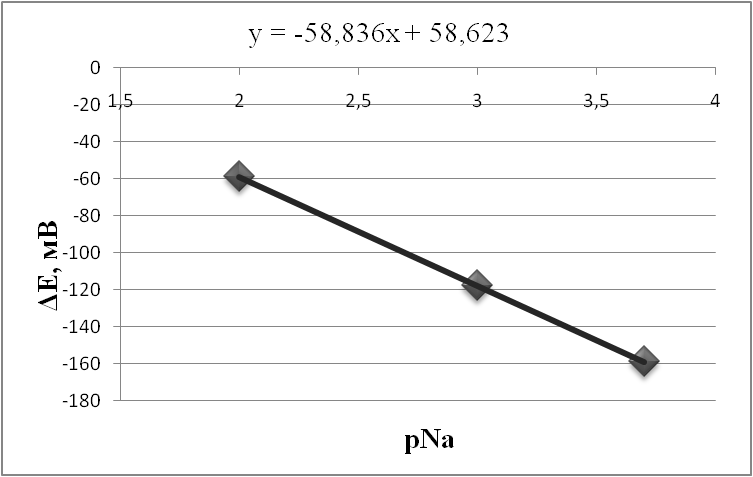
Также существует третий класс электродов (нами не используемый) – электроды с ионоселективной твердой мембраной. Мембраной в таких электродах служит твердое вещество, обладающее свойствами проводника, - монокристалл или таблетка, спрессованная из кристаллического материала. Мы использовали метод потенциометрии для измерения содержания натрия, хлора и водорода (рН) в почвах по профилю; для измерения рН в водах р.Ичка, а также для измерения рН в донных отложениях. Перед началом работ была проведена калибровка электродов. Затем строились градуировочные графики, выражающие зависимость измеряемого потенциала от концентрации определяемого иона. По нему были определены концентрации ионов в пробах. Использовались навески проб массой 10 г. В эти навески добавлялись 50 мл дистиллированной воды, а полученная смесь перемешивались в течение 10 мин. После этого в раствор погружались электроды и проводились необходимые измерения. По калибровочным графикам определялись концентрации в водных вытяжках из почв и рассчитывались содержания элементов в почвах. Таким образом, очевидным достоинством метода является то, что измерение электродом можно производить не только в растворе, но и в пасте. Для определения активностей ионов натрия при низких значениях рН исследуемый раствор подщелачивают раствором Са(ОН)2, чтобы максимально избежать ошибки, возникающей за счет присутствия ионов водорода. Такая недостаточная селективность, являющаяся помехой при измерениях, безусловно, является недостатком метода. Полученные значения по калибровке приведены в табл. 3.1.1 – 3.1.4. По этим данным строились калибровочные графики (рис. 3.1.4-3.1.7) По калибровочным графикам определялись концентрации в водных вытяжках из почв и рассчитывались содержания элементов в почвах. Данные занесены в табл. 4.1.1-3.1.4 Также были построены графики распределения концентраций ионов Na, Cl и Н по исследуемому профилю (рис. 3.1.6-3.1.8)
Табл. 3.1.1 Калибровка потенциометра для рН по стандартным растворам.
Табл. 3.1.2 Калибровка потенциометра для Na до подщелачивания
Рис. 3.1.4. Калибровочный график для измерения концентрации Na до подщелачивания
Табл. 3.1.3 Калибровка потенциометра для Na после подщелачивания
Рис. 3.1.5. Калибровочный график для измерения концентрации Na после подщелачивания
Табл. 3.1.4 Калибровка потенциометра для Сl по стандартным растворам
Рис. 3.1.6. Калибровочный график для измерения концентрации Cl
3.2 Определение окисляемости Окисляемость характеризует общее содержание органических веществ в природных водах. Окисляемость характеризуется величиной ХПК(химическое потребление кислорода). Для определения ХПК используется бихроматный и перманганатный метод. Бихроматный метод Бихроматная окисляемость выше перманганатной, она определяет 80% истинной окисляемости органических веществ. Реактивы: 1. Соль Мора. 2. Бихромат калия 0,2н. 3. сульфат серебра 4. фенилантраниловая кислота 5. серная кислота конц. Ход анализа: Перед определением окисляемости в пробах необходимо провести холостое определение. В коническую колбу объемом 250 мл наливают 100 мл дистиллированной воды, добавляют 10 мл бихромата калия, 0,1 г сульфата серебра и 20 мл серной кислоты конц. охлаждают,.добавляют 2-3капли фенилантраниловой кислоты и оттитровывают солью Мора до темно-зеленой окраски раствора. После этого определяют нормальность соли Мора по формуле: Nс.м.=N * V/ Vс.м. , где N - нормальность бихромата калия; V – объем бихромата калия, добавленного к пробе (10мл); Vс.м. – объем соли Мора, пошедшего на титрование, мл. После холостого производятся определения в пробах. В коническую колбу объемом 250 мл наливают 10 мл исследуемой воды, добавляют 10 мл бихромата калия, 0,1 г сульфата серебра , 20 мл концентрированной серной кислоты ,100мл бидистиллята. Затем раствор охлаждают и после добавления 2-3капель фенилантраниловой кислоты, оттитровывают солью Мора до темно-зеленой окраски раствора. Величину окисляемости рассчитывают по следующей формуле: X=(V1-V2)*N*8*1000/V, где V1- объем соли Мора, пошедшего на холостое титрование, мл; V2- объем соли Мора, пошедшего на титрование пробы, мл; V- объем исследуемой воды, мл; N - нормальность бихромата калия 8 – эквивалентный вес кислорода. В воде взятой из створа 1,объем раствора соли Мора, который пошел на холостое определение равен 11.85 мл, а на пробу 11.75. Нормальность бихромата калия 0.2 Н, объем пробы 10 мл, соответственно окисляемость: Х= (11.85-11.75)*0.2*8*1000/10 Х=16 мг/л. В ходе параллельного измерения значение окисляемости получилось: Х=(12- 11.89)*0.2*8*1000/10 Х=17.6 мг/л Стандартное отклонение для 2 параллельных измерений равно 1.3 мг/л В воде из створа 2 значение ХПК определить не удалось, что говорит об очень малом количестве органического вещества, сопоставимо с погрешностью измерения. В данном случае имеет смысл применение другой методики с использование реактивов с другими концентрациями. В частности возможно уменьшение концентрации соли Мора для получения большей разницы значений объема использованного титранта между холостым и контрольным измерением. По результатам бихроматного определения вода взятая из створа 1 имеет окисляемость 16.8 мг/л О2. Перманганатный метод Перманганатный метод основан на окислении органических веществ перманганатом калия при нагревании. Кроме органических веществ в воде содержатся неорганические восстановители, поэтому чтобы определить содержание органики, необходимо из количества перманганата калия, израсходованного на окисление органических и неорганических веществ, вычесть количество перманганата калия, пошедшего на окисление неорганических восстановителей. Большинство неорганических восстановителей окисляется перманганатом калия на холоду, поэтому может быть оттитровано перед определение окисляемости воды. Реакция окисления перманганатом калия в кислой среде происходит по следующей схеме: MnO4-+8H++5e = Mn2++4H2O Не вошедший в реакцию перманганат калия восстанавливается щавелевой кислотой 2MnO4-+16H++5C2O4 2- = 2Mn2++8H2O+10CO2 Избыток щавелевой кислоты оттитровывался раствором перманганата калия. 1. Серная кислота (1:3). 2. Щавелевая кислота, 0,05н. раствор. 3. Перманганат калия, 0,05н. раствор. Ход анализа: В коническую колбу объемом 250 мл наливали 100 мл исследуемой воды добавляли 5 мл 25% р-ра серной кислоты и быстро титровали на холоду раствором перманганата калия (нормальность раствора находилась титрованием щавеливой кислоты с известной нормальностью) до появления слабо-розовой окраски, неисчезающей в течение минуты При этом окислялись неорганические восстановители. Затем к раствору из бюретки добавляли 10 мл перманганата калия,опускали несколько стеклянных бусинок, (следить, чтобы не было выброса!) закрывали колбу вороночкой и кипятили раствор в течение 10 минут, считая с момента начала кипения. Далее к горячему раствору быстро добавляли10 мл раствора щавеливой кислоты и сразу титровали обесцветившийся раствор раствором перманганата калия до слабо-розовой окраски. Величину окисляемости рассчитывали по следующей формуле: X=(V1-- V3))*N*8*1000/V, где V1- общий объем раствора перманганата калия, прибавленного к пробе воды, мл; V3- объем раствора перманганата калия, израсходованного на окисление 10 мл 0,05н щавелевой кислоты(при определении нормальности), мл; V- объем исследуемой воды, мл; 8 – эквивалентный вес кислорода; N – нормальность раствора перманганата калия Для каждого створа воды проводилось 2 параллельных измерения, за эталон принималось среднее арифметическое, после чего определялось стандартное отклонение. Итак значения ХПК для воды из первого створа: 10.6мг/л О2 11.6 мг/л О2. Среднее значение: 11.1 мг/л О2. Стандартное отклонение для двух параллельных измерений равно 0.5 мг/л. С учетом значения критерия Стьюдента с 95% вероятностью можно утверждать что значение ХПК для первого створа лежит в интервале. Для первого створа окисляемость воды 11.1±4 мг/л О2. Значения ХПК для створа также определялись при 2 параллельных измерениях. Значение при первом определение: 9.80 мг/л О2 при втором: 10.80 мг/л О2 Среднее значение ХПК:10.3 мг/л О2. Стандартное отклонение для двух параллельных измерений равно 0.5. С 95 % вероятностью можно утверждать что значение ХПК для второго створа лежит в интервале 10.3±4 мг/л О2 Итак для второго створа окисляемость воды 10.3±4 мг/л О2. Как уже говорилось выше бихроматный метод определяет 80% истинной окисляемости, а перманганатный порядка 50 % ,таким образом перманганатный метод окисляет органическое вещество относительно недавно поступающее в реку, так как бихроматный окисляет также органическое вещество достаточно давно поступившее в р.Ичку. Анализируя полученные данные можно сделать вывод о том что постоянного источника загрязнения воды органическим веществом не наблюдается, о чем говорит разница между данными полученными в ходе бихроматного и перманганатного метода определения окисляемости. В результате можно сделать вывод, что эколого-геохимическая ситуация связанная с загрязнением органическим веществом не является актуальной для данной территории. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 419. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||