Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Функции минеральных веществ1. Поддержание кислотно-щелочного равновесия – буферности. Буферностьюназывают способность клетки поддерживать слабощелочную реакцию своего содержимого на постоянном уровне (рН около 7,4). Внутри клетки буферность обеспечивается главным образом анионами H2PO4- и НРО42-. Во внеклеточной жидкости и в крови роль буфера играют Н2СО3 и НСО3- 2. Участие в создании мембранных потенциалов 3. Активация ферментов . Катионы Mg2+, Mn2+, Zn2+, Ca2+ и др. необходимы для нормального функционирования многих ферментов; 4. Создание осмотического давления в клетке Катионы калия, натрия, хлора 5. Строительная или структурная функция (соли кальция, азота, фосфора) 6. Катионы К+, Na+, Ca2+ обеспечивают раздражимость живых организмов; II. Органические вещества клетки: белки, жиры, углеводы, нуклеиновые кислоты. 1. Белки -биополимеры, мономерами которых являются аминокислоты, связанные пептидной связью. Существуют 20 типов Аминокислот. Каждый белок характеризуется специфичной аминокислотной последовательностью Структуры молекулы белка Первичная структура белка представляет собою последовательность аминокислот в полипептидной цепи, соединенных пептидными связями.(тип связи ковалентная) Вторичная структура – белковая нить закручена в виде спирали. Между группами СООН одного витка и NH2 другого образуются водородные связи Третичная структура - укладка полипептидной цепи с образованием компактной, плотно упакованной структуры - клубок или глобулы (кератин, колаген) Такая структура поддерживается дисульфидными связями, гидрофобными взаимодействиями, электростатическими. Третичной структурой объясняется специфичность белковой молекулы, ее биологическая активность.  Четвертичная структура – состоит из нескольких глобул. Свойства молекул белка 1. Денатурация -это процесс разрушение структуры белка под действием факторов внешней среды (температура, pH). Денатурация может быть обратимой, а может необратимой. 2.Ренатурация -процесс восстановление структуры белка, возможна если сохранена первичная структура. Если разрушена и первичная структура денатурация необратима. Функции белков
Классификация белков
· Протамины и гистоны – обладают основными свойствами и входят в состав нуклеопротеидов. Играют важную роль в метаболической активности генома; · Проламины и глютенины относятся к белкам растительного происхождения, составляют основную массу клейковины. · Альбумины и глобулины –белки, распространенные в тканях и органах животных. Наиболее богата этими белками сыворотка крови, молоко, яичный белок , мышцы и др.
· Хромопротеиды –белки, в которой простетической группой служит пигмент (гемоглобин, миоглобин, цитохромы). · Нуклеопротеиды белки, связанные с нуклеиновыми кислотами. · Липопротеиды –белки связанные с липидами · Фосфопротеиды –состоят из белка и простетической группы, представленной лабильном фосфатом. · Гликопротеиды - белок связан с углеводами или их производными. · Металлопротеиды белки, содержащие негемированное железо, а также белки связанные с атомами металлов в составе сложных белков ферментов. По форме молекулы (структуре) белки делятся на глобулярные (имеют форму глобулы) и фибриллярные (имеют вытянутую форму). Ферменты-биокатализаторы - вещество ускоряющее химическую реакцию, но не изменяющееся в процессе реакции. Отличие ферментов от неорганических катализаторов:
3. Более эффективны. Эффективность фермента оценивается числом молекул субстрата, превращаемых ферментом за единицу времени – число оборотов. Каждая молекула фермента способна осуществлять от тысячи до миллиардов операций в минуту, при этом биоферменты не расходуются. 4 Очень чувствительны к изменениям физико-химических условий среды. Для каждого фермента имеется оптимальное значение условий, при которых он наиболее эффективно работает: ph , ТоС, концентрация субстрата, концентрация фермент-субстратного комплекса. 5 Действие их может быть заторможеноингибиторами Например: неспецифические (тяжелые металлы) вызывают структурные изменения белковой части, а специфические инактивируют лишь определенные ферменты. 6 Ферментативные реакции обратимы. Один и тот же фермент может катализировать и прямую и обратную реакцию. Локализация ферментов в клетке Ферменты располагаются и действуют в цитоплазме клетки или в определенных органоидах. Ферменты расщепления углеводов содержатся в цитоплазме, а окисления жирных кислот – в митохондриях. В ядре локализованы ферменты синтеза нуклеиновых кислот, а в хлоропластах содержатся ферменты, участвующие в синтезе углеводов. Выделенные из клетки ферменты не утрачивают каталитические свойства. На этом основано широкое использование их в народном хозяйстве.
Углеводы - Сn(Н2О)n. Углеводы (сахариды) — органические соединения, состоящих из углерода, кислорода и водорода.
Классификация (по способности к гидролизу) 1. Простые сахара или моносахариды 2. Олигосахариды – соединения, состоящие из 2-10 последовательно соединенных молекул простых сахаров 3. Сложные или полисахариды состоят более чем из 10 молекул сахаров Моносахариды – простые сахара с эмпирической формулой Сn(Н2О)n. В зависимости от числа углеродных атомов моносахариды делятся на триозы, пентозы, гексозы и гептозы. В природе наиболее распространены пентозы (рибоза и дезоксирибоза) и гексозы (глюкоза и фруктоза) Дисахариды– сахара, образующиеся в результате конденсации двух моносахаридов Полисахариды образованы путем соединения многих моносахаридов. Наиболее часто встречающимся мономером является глюкоза.
В зависимости от типа гликозидных связей полисахариды бывают линейными (неразветвленными – целлюлоза) и разветвленными (крахмал, хитин). Полисахариды делят на:
Функции углеводов 1. Энергетическая являются основным источником энергии у организмов. 2. Структурная входят в состав клеток всех организмов 3. Опорная функция (только у растений- жесткая клеточная стенка из целлюлозы) 4. Запаса питательных веществ. Крахмал у растений, гликоген у животных. 5. Защитная. Вязкие секреты (слизи) выделяемые животными богаты углеводами. Они защищают полые органы от механических повреждении, проникновения вредных вирусов и бактерий. (пищевод, кишки, бронхи и желудок)
Липиды – сложные эфиры жирных кислот и спирта. Нерастворимы в воде, но растворимы в неполярных растворителях. Присутствуют во всех клетках. Липиды состоят из атомов водорода, кислорода и углерода. Виды липидов: I. Простые липиды. Представляют собой спиртовые эфиры жирных кислот. К ним относят природные жиры и воска.
II. Cложные липиды При гидролизе этих липидов образуются помимо спирта и кислот также и другие соединения. К ним относятся фосфолипиды, гликолипиды. Фосфолипиды – липид, в состав которого также входит остаток фосфорной кислоты III. Стероиды В состав липидов входит спирт холесторол. К стероидам принадлежит ряд очень важных веществ: гормоны коры надпочечников и половых желез, витамин д, желчные кислоты, холестерин. IV. ПигментыКаротиноиды (это животные и растительные пигменты), порфирины, к ним относится биологически важные пигменты (гемоглобин, хлорофилл, билирубин); флавины (лактофлавин молока, рибофлавин). Биологические функции 1. Структурная - входят в состав внутриклеточных структур; (фосфолипиды, воски др) 2. Энергетическая - выделяют энергию -38,9кДж; 3. Защитная - защищает клетку и организм от резких колебаний температуры и механических повреждений 4. Являются источником метаболической воды 5. Регуляторная. Входят в состав витаминов (A, D, E) и гормонов. Углеводы и жиры способны в организме превращаться друг в друга. Белки также могут преобразовываться в жиры и углеводы.
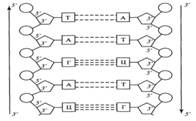
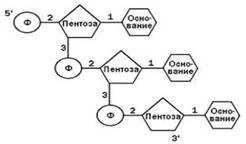
Нуклеиновые кислоты Нуклеиновые кислоты были открыты в 1868 г. швейцарским ученым Ф. Мишером. Нуклеиновые кислоты – биополимеры, мономерами которых являются нуклеотиды. ДНК Дезоксирибонуклеиновая кислота (ДНК) – линейный полимер, имеющий вид двойной спирали. Пространственная структура молекулы ДНК была смоделирована американскими учеными Джеймсом Уотсоном и Френсисом Криком в 1953 г. Строение Каждый нуклеотид ДНК состоит из: - азотистого основания пуринового (аденин и гуанин) или пиримидинового (тимин и цитозин) - пятиуглеродного сахара – дезоксирибозы - фосфатной группы. Этапы исследований ДНК
Основные черты модели:
Последовательность нуклеотидов в молекуле ДНК определяет ее специфичность, а также специфичность белков организма, которые кодируются этой последовательностью. Эти последовательности индивидуальны и для каждого вида организмов, и для отдельных особей. Функции ДНК
Репликация ДНК Репликация ДНК – процесс удвоения ДНК. Это сложный процесс осуществляемый ферментами. В основе репликации лежит способность нуклеотидов к комплементарному взаимодействию с образованием водородных связей между А и Т, Г и Ц. Этапы репликации:
РНК Рибонуклеиновая кислота (РНК) – линейный полимер, состоящий из одной цепи нуклеотидов. Строение Каждый нуклеотид РНК состоит из: - азотистого основания пуринового (А – аденин или Г – гуанин) или пиримидинового (У - урацил или Ц – цитозин) - пятиуглеродного сахара – рибозы - фосфатной группы.
2. Виды РНК.
Синтезируется в ядре при участии фермента РНК-полимеразы. Комплементарна участку ДНК, на котором происходит синтез. Ее функция – снятие информации с ДНК и передача ее к месту синтеза белка – на рибосомы. Составляет 5% РНК клетки.
Синтезируется в ядрышке. Одноцепочный линейный полимер, в комплексе с белками формирует рибосомы. Составляет 85% РНК клетки.
Транспортирует аминокислоты к месту синтеза белка. Самая маленькая из всех РНК и состоит из 70—90 нуклеотидов. Число различных видов тРНК 20-61 видов. Все они имеют сходную пространственную конфигурацию. Благодаря внутрицепочным комплементарным взаимодействиям молекула тРНК приобретает характерную вторичную структуру в виде клеверного листа. В тРНК выделяют четыре петли или плеча: · Акцепторная – служит местом прикрепления аминокислоты; · Антикодоновая – узнает кодон в матричной РНК в процессе трансляции · Две боковые
Функции РНК
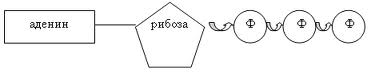
АТФ Аденозинтрифосфорная кислота – универсальный природный аккумулятор энергии. АТФ представляет собой нуклеотид, состоящий из:
При отщеплении одного остатка фосфорной кислоты освобождается 40 кДж/моль энергии. Синтез АТФ происходит в основном в митохондриях ( в хлоропластах синтезированные АТФ расходуются в темновой фазе). Световая энергия солнца и энергия заключенная в потребляемой пище запасается в молекулах АТФ. Запас АТФ в клетке не велик.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 254. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |