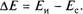Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
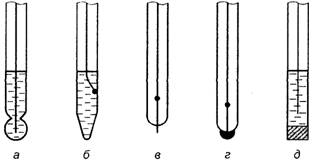
Потенциометрические анализаторыПотенциометрический метод основан на измерении электродных потенциалов, функционально связанных с концентрацией (активностью) определяемого вещества в растворе. Электроды представляют собой окислительно-восстановительные системы. Измеряемый потенциал отвечает равновесному состоянию, установившемуся на электроде между окисленной и восстановленной формой определяемого вещества, и в общем виде может быть определен по уравнению Нернста:
где Е — электродный потенциал, В; Абсолютное значение электродного потенциала непосредственно измерить нельзя, для его измерения применяют гальванический элемент, в котором один электрод является индикаторным (измерительным), а другой — электродом сравнения. Индикаторный электрод помещают в контролируемую жидкую среду. Потенциал индикаторного электрода ЭДС гальванической цепи, составленной из индикаторного электрода и электрода сравнения, помещенных в контролируемую жидкую среду, составит 
Рисунок 7.5. Ионоселективные электроды: а — стеклянный мембранный электрод; металлические электроды с напыленным слоем металла (б), проволочный (в), точечный (г); д — электрод с твердой мембраной Потенциометрический метод применяется для измерения концентраций кислот, оснований, солей в водных и неводных средах, а также для контроля рН водных растворов прямым потенциометрическим измерением. Возможности потенциометрического метода расширились с появлением ионоселективных электродов (рис.7.5). В конструкцию такого электрода входит мембрана, проницаемая только для определяемого иона, тем самым обеспечивается избирательный анализ одних ионов в присутствии других. В стеклянном мембранном электроде ионообменной мембраной служит шарик из стекла определенного сорта, припаянного к стеклянной трубке. Трубка заполнена стандартным (внутренним) раствором с постоянной активностью ионов водорода, и в нее опушен проводник — серебряная проволока. Разность потенциалов между стеклянной ионообменной мембраной и внутренним полуэлементом (система проводник—внутренний раствор) составляет потенциал стеклянного электрода. В состав стеклянной ионообменной мембраны входят атомы натрия, способные к активному электрохимическому обмену с контролируемой средой при рН > 10. При рН > 12, вследствие интенсивного электрохимического обмена, электрод «выщелачивается». Металлические индикаторные электроды с напыленным слоем металла на нейтральную поверхность (рис. 7.5, б), проволочный (рис. 7.5, в) или припаянный одним концом к нейтральной поверхности в виде капли — точечный (рис. 7.5, г) в контролируемой среде вступают в электрохимическое взаимодействие с ионами, присутствующими в этой среде. Наибольшей селективностью при потенциометрическом контроле многокомпонентных технологических сред обладают индикаторные электроды, изготовленные из благородных металлов (платина, золото, иридий и т. д.). На рис. 7.5, д представлен индикаторный ионоселективный электрод с разделительной твердой мембраной (кристалл, пленка, таблетка), выполняющий ту же функцию, что и стеклянный шарик в стеклянном мембранном электроде. Автоматический потенциометрический контроль технологических водных низкоконцентрированных растворов и суспензий используется для управления процессами нейтрализации в технологических средах.
|
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 331. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
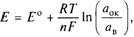
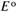 — стандартный электродный потенциал — потенциал электрода, измеренный в стандартных условиях (25 °С, 101,325 кПа,
— стандартный электродный потенциал — потенциал электрода, измеренный в стандартных условиях (25 °С, 101,325 кПа, 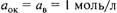 ), В; п — число электронов, обменивающихся между окисленной и восстановленной формами вещества;
), В; п — число электронов, обменивающихся между окисленной и восстановленной формами вещества; 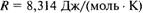 — универсальная газовая постоянная; Т — абсолютная температура, К;
— универсальная газовая постоянная; Т — абсолютная температура, К; 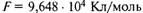 — постоянная Фарадея;
— постоянная Фарадея; 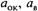 — активность окисленной и восстановленной форм вещества соответственно, моль/л.
— активность окисленной и восстановленной форм вещества соответственно, моль/л.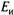 определяется концентрацией (активностью) ионов в растворе. В качестве электрода сравнения используют стандартные электроды (например, каломельный электрод), имеющие постоянный потенциал
определяется концентрацией (активностью) ионов в растворе. В качестве электрода сравнения используют стандартные электроды (например, каломельный электрод), имеющие постоянный потенциал 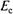 . Потенциал электрода сравнения зависит от температуры, поэтому его располагают в контролируемой среде в непосредственной близости от индикаторного электрода.
. Потенциал электрода сравнения зависит от температуры, поэтому его располагают в контролируемой среде в непосредственной близости от индикаторного электрода.