Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
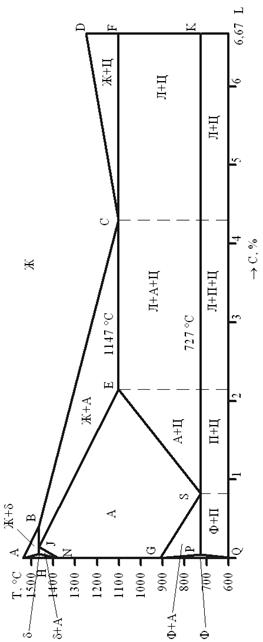
Компоненты диаграммы и их свойстваКомпонентами диаграммы являются железо, углерод и цементит. 1. Железо – переходный металл серебристо-светлого цвета. Имеет высокую температуру плавления – 1539 °С± 5 °С. В твердом состоянии железо может находиться в двух модификациях. Полиморфные превращения происходят при температурах 911 °С и 1392 °С. При температуре ниже 911 °С существует Feα с объемно-центрированной кубической решеткой. В интервале температур 911...1392 °С устойчивым является Feγ с гранецентрированной кубической решеткой. Выше 1392 °С железо имеет объемно-центрированную кубическую решетку и называется Feδ или высокотемпературное Feα. Высокотемпературная модификация Feα не представляет собой новой аллотропической формы. Критическую температуру 911 °С превращения Feα ↔ Feγ обозначают точкой A3 , а температуру 1392 °С превращения Feδ ↔ Feγ – точкой А4. При температуре ниже 768 °С железо ферромагнитное, а выше – парамагнитное. Точка Кюри железа 768 °С обозначается А2.
Железо технической чистоты обладает невысокой твердостью (80 НВ) и прочностью (предел прочности σВ =250 МПа, предел текучести σТ =120 МПа) и высокими характеристиками пластичности (относительное удлинение δ=50 %, a относительное сужение ψ= 80 %). Свойства могут изменяться в некоторых пределах в зависимости от величины зерна. Железо характеризуется высоким модулем упругости, наличие которого проявляется и в сплавах на его основе, обеспечивая высокую жесткость деталей из этих сплавов. Железо со многими элементами образует растворы: с металлами – растворы замещения, с углеродом, азотом и водородом – растворы внедрения.  2. Углерод относится к неметаллам. Обладает полиморфным превращением, в зависимости от условий образования существует в форме графита с гексагональной кристаллической решеткой (температура плавления – 3500 °С, плотность – 2,5 г/см3) или в форме алмаза со сложной кристаллической решеткой (температура плавления – 5000 °С). В сплавах железа с углеродом углерод находится в состоянии твердого раствора с железом и в виде химического соединения – цементита (Fe3C), а также в свободном состоянии в виде графита (в серых чугунах). 3. Цементит (Fe3C) – химическое соединение железа с углеродом (карбид железа), содержит 6,67 % углерода. Аллотропических превращений не испытывает. Кристаллическая решетка цементита состоит из ряда октаэдров, оси которых наклонены друг к другу. Температура плавления цементита точно не установлена (1250…1550 °С). При низких температурах цементит слабо ферромагнитен, магнитные свойства теряет при температуре около 217 °С. Цементит имеет высокую твердость (более 800 НВ, легко царапает стекло), но чрезвычайно низкую, практически нулевую, пластичность. Такие свойства являются следствием сложного строения кристаллической решетки. Цементит способен образовывать твердые растворы замещения. Атомы углерода могут замещаться атомами неметаллов: азотом, кислородом; атомы железа – металлами: марганцем, хромом, вольфрамом и др. Такой твердый раствор на базе решетки цементита называется легированным цементитом. Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение при структурообразовании чугунов. |
||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 203. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |