Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
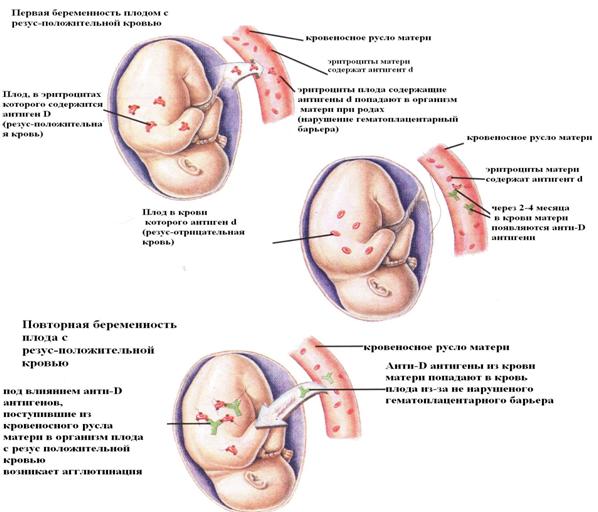
Механизмы развития резус - и АВО-конфликта при беременности.Механизм развития резус конфликтной беременности представляется следующим образом: иммунные антитела, образовавшиеся в организме резус - отрицательной женщины, беременной резус - положительным плодом, обладают способностью в отличие от антител системы АВ0, проникать через плаценту в организм плода, вызвать гемолиз его эритроцитов, в результате чего повреждаются кроветворные ткани, печень, головной мозг. Во время родов, когда нарушается целостность плацентарного барьера, в кровь новорожденного ребенка поступает особенно много антител и развивается гемолитическая болезнь новорожденных. Гемолитическая болезнь новорожденных - это болезнь, которая возникает в результате гемолиза эритроцитов плода и новорожденного, вызванного антителами матери. Наиболее часто встречаются два варианта гемолитическая болезни новорожденных: резус -конфликт и АВ0 -конфликт. Резус - конфликтразвивается в случае беременности Rh ˉ - матери с Rh - плодом (чаще всего при повторной беременности). Сначала происходит иммунизация матери Rh - эритроцитами плода, которые могут проникать в организм матери во время родов или при дефектах плаценты. Наиболее вероятна иммунизация во время родов, поэтому резус -конфликт возникает чаще всего в условиях повторной беременности Rh - плодом. В ответ на поступление Rh - эритроцитов матери синтезируются антитела против D - антигена. Эти антитела (IgG) способны проникать через плаценту в организм плода и вызывает гемолиз его эритроцитов.
АВ0-конфликт. Чаще всего возникает в ситуациях, когда мать имеет группу крови 0 (I), а плод - А (II) или В (III). Нормальные изоаглютинины в системе АВ0 принадлежат к классу IgМ. Эти антитела не проникают через плаценту и поэтому не могут быть причиной АВ0-конфликта. Но в 10% здоровых людей, имеющих группу крови 0 (I), являются антитела против аглютиногенив А и В, представлены IgG. Наличие этих антител не зависит от предыдущей иммунизации. Агглютинины IgG проникают через плаценту и могут вызвать гемолиз эритроцитов плода с группами крови А (II), В (III). Среди детей-первенцев гемолитическая анемия как результат АВ0-конфликта встречается с такой же частотой, как и у детей, рожденных после вторых, третьих и последующих родов, в отличие от резус-конфликта, где частота гемолитической анемии увеличивается с ростом количества родов.  Антитела новорожденный может получить с молоком матери, что тоже будет способствовать поддержанию болезни. Физиология тромбоцитов Тромбоциты - это безъядерные клеточные элементы, появляются в результате отшнуровки от мегакариоцитов в костном мозге, при этом каждая из этих самых больших клеток костного мозга порождает около 500 тромбоцитов (кровяных пластинок). Нормальное количество тромбоцитов составляет 170 000-400 000/мкл крови; при снижении уровня числа тромбоцитов до 50 000/мкл (тромбоцитопения) начальная стадия остановки кровотечения нарушается. В покое, при отсутствии повреждений, тромбоциты не активируются неповрежденным эндотелием. Это можно объяснить особыми свойствами гликокаликса мембраны клеток эндотелия, для которого у тромбоцитов нет рецепторов. Кроме того, эндотелиальные клетки отдают в просветы сосудов факторы, противодействующие активации тромбоцитов. Прямое тормозящее воздействие на активацию тромбоцитов оказывает простациклин = простагландин I2, эйкозаноид, который образуется и выделяется клетками эндотелия, а также монооксид азота (NO). Третий продукт клеток эндотелия, который косвенно тормозит агрегацию тромбоцитов, гепарин. Гепарин тормозит образование и активность тромбина (через антитромбин III) и индуцированную тромбином активацию тромбоцитов. При травматизации первым запускается сосудисто-тромбоцитарный гемостаз. Благодаря нему может самостоятельно прекратиться кровотечение из небольших сосудов. Но при повреждении крупных сосудов этого механизма недостаточно - здесь он выступает только первичным гемостазом, с которого начинаются все фазы остановки кровотечения.
После повреждения сосудов последовательно запускаются этапы сосудисто-тромбоцитарного гемостаза. 1. Рефлекторный спазм сосудов начинается сразу после повреждения.2. Адгезия.3. Активация (скопление) тромбоцитов.4. Необратимая агрегация.5. Ретракция тромбоцитарного тромба. При повреждении сосудов открываются лежащие под эндотелием волокна коллагена, к которым тотчас же прикрепляются тромбоциты. Прикрепление (адгезия, ) осуществляется с помощью белка, образуемого клетками эндотелия и мегакариоцитами (фактор фон Виллебранда, vWF), который вместе с фибронектином и ламинином образует молекулярные мосты между волокнами коллагена и специфическим комплексом рецепторов (GPIb-IX-V) на мембране тромбоцитов. При дефекте этого гликопротеинового комплекса (GP) прикрепление тромбоцитов к коллагену становится невозможным. Непосредственно после адгезии происходит активация тромбоцитов (скопление) . Этот процесс активации состоит в основном из трех этапов: секреции различных веществ, изменения формы тромбоцитов и агрегации кровяных пластинок. Первым этапом является секреция агонистов (ADP, тромбоксан А2, серотонин), вследствие чего происходит активация тромбоцитов. Эти тромбоциты становятся клейкими и образуют агрегат, «тромбоцитарная пробка» (белый тромб). Изменения формы тромбоцитов являются морфологическим эквивалентом их активации. Эту фазу еще называют обратимой агрегацией тромбоцитов. Затем происходит необратимая агрегации,ее признаки: а) реорганизация мембраны тромбоцитов и б) сокращение актин-миозиновых компонентов тромбоцитарного цитоскелета - ретракция сгустка (выделяемая затем как отдельный этап). Реорганизация плазматической мембраны приводит к экспозиции рецепторного комплекса, гликопротеина (GP) IIb/IIIa, на мембране тромбоцита. Фибриноген плазмы, равно как и «клеящие вещества» фибриноген и тромбоспондин, выделяемые активированными тромбоцитами, связываются с GP IIb/IIIa и вызывают агрегацию тромбоцитов. Прежде чем тромбоциты начнут склеиваться друг с другом, они сначала должны быть привлечены к поврежденному месту в достаточном количестве. Те тромбоциты, которые активированы прикреплением к субэндотелиальному коллагену, выделяют вещества, за счет которых тромбоциты, плавающие в крови, «призываются на помощь». Все активированные тромбоциты склеиваются вместе и образуют за короткое время (<1 мин) белый тромб. С агрегацией и контракцией завершается первичный гемостаз, т.е. образование белого тромбоцитарного агрегата. При нормальных условиях этот процесс длится 2-4 мин (время остановки кровотечения).
Связь сосудисто-тромбоцитарного и коагуляционного гемостаза хорошо видна на рисунке ниже. Факторы свертывания крови Факторы, принимающие участие в каскадах свертывания крови, обозначаются по договоренности римскими цифрами, при этом активное состояние соответствующего компонента маркируется через «а». Ранее часто использовались собственные имена, которые вместе с цифровой номенклатурой приведены в таблице. Как и в системе комплемента, работа системы свертывания - это каскад реакций активации ферментов, центральное место в котором занимает фактор X. В активной форме фактор X образует совместно с фактором Va, фосфолипидами и Ca2+ ферментативный комплекс прототромбиназу, которая переводит неактивный прототромбин в активный тромбин. Ca2+ обеспечивает при этом фиксацию протромбиназного комплекса на отрицательно заряженных фосфолипидах клеточной мембраны, за счет чего его активность многократно возрастает.
Коагуляционный гемостаз
Фаза активации.Активация фактора X может происходить посредством факторов, входящих в состав внешней и внутренней систем свертывания. Фактор Xa является конечным итогом систем свертывания. Внешний путь активациизапускается тканевым тромбопластиномиз поврежденной ткани. Фактор тканевой тромбопластин активирует фактор VII, который как фактор IXa образует с Ca2+ и фосфолипидами комплекс, активирующий фактор активации X. Внутренний путь свертываниязапускается взаимодействием фактора XII с отрицательно заряженной поверхностью сосуда в присутствии высокомолекулярного кининогена и калликреина. В последствии активируются факторы XI и IX. Фактор IXa образует вместе с фосфолипидами, Ca2+ и фактором VIIIa комплекс, который активирует фактор X в фактор Xa, вследствие чего наконец возникает тромбин.Эта сериновая протеаза регулирует не только активацию тромбоцитов, но действует через протеазоактивированные рецепторы как эффективный митоген клеток эндотелия и клеток гладкой мускулатуры. О том, насколько насколько важен комплекс из факторов VIIIa и IXa для работы внутренней системы свертывания, можно судить по симптомам, которые появляются при отсутствии одного из этих факторов. При классической гемофилии А,наиболее частом врожденном нарушении процессов свертывания крови, недостает фактора VIII, при гемофилии B- фактора IX. Симптомы при обеих формах гемофилии одинаковы, однако гемофилия А встречается в 5 раз чаще, чем гемофилия В. Пациенты страдают обильными кровоизлияниями (гематомами) прежде всего в области конечностей и головы, долго длящимися кровотечениями после повреждений, кровотечениями в суставах (гемартрозами), особенно локтевых и коленных суставов, которые приводят со временем к неподвижности сустава. Долговременное лечение гемофилии возможно либо полученным из плазмы, либо рекомбинантным фактором VIII. Фаза коагуляции.Фаза активации заканчивается с образованием ферментативно активного тромбина. В последующей коагуляционной фазе тромбин отщепляет от фибриногена низкомолекулярные пептиды (фибринопептиды). Так образуются мономеры фибрина,которые через нековалентные связи (например, водородные мостики) складываются (коагулируют) в полимеры фибрина. Возникший сгусток все же недостаточно стабилен. Лишь в результате воздействия фактора XIII, который активируется тромбином, происходит образование ковалентных связей между γ-карбоксилгруппами остатков глютамина одного мономера фибрина и ε-аминогруппами остаков лизина другого мономера фибрина. Фаза ретракции.Нити фибрина укладываются над тромбоцитарным агрегатом и связываются через мембранный рецептор гликопротеин IIb/IIIa с тромбоцитами. При адгезии фибрина на тромбоцитах и окружающей ткани принимает участие также еще «заякоривающий белок» фибронектин (см. рис. 8-11). Возникающий при вторичном гемостазе тромбин способствует не только агрегации тромбоцитов, но и активации их сократительной актин-миозиновой системы. Под тягой сокращающихся тромбоцитов на сети фибриновых нитей тромб сжимается и становится значительно меньше своего изначального объема (ретракция).Таким образом происходит дальнейшее укрепление тромба и механическое закрытие раны изнутри. Более развернуто каскадная система изображена ниже
Рис. Свертывание крови и фибринолиз. Внешний путь активации: повреждение ткани является причиной контакта крови с составными частями разрушенных клеток, в которых находится тканевой тромбопластин. Этот липидно-белковый комплекс активирует фактор VII, который образует комплекс с Ca2+ и фосфолипидами (P-Lip), который активирует фактор X. Внутренний путь активации: Реакция запускается активацией фактора XII (фактор Хагемана) на отрицательно заряженной поверхности. При активации задействованы также другие белки, например высокомолекулярный кининоген и калликреин. Следом активируются факторы IX и XI. Фактор IXa образует вместе с фосфолипидами (P-Lip), Ca2+ и активированным фактором VIII ферментативный комплекс, который активирует фактор X. Возникающий после этого комплекс (P-Lip, Ca2+, Xa, Va) обозначается как протромбин активатор или протромбиназа; он запускает образование фибрина. Синим залиты неактивные (покоящиеся) профакторы; розовым - активированные факторы с ферментативной активностью; желтым - процессы активации совместно действующих комплексов. Красные стрелки указывают на ферментативно активируемые процессы. В нижней (залитой серым цветом) части рисунка нарисованы факторы, переводящие при фибринолизе плазминоген в плазмин. Плазмин является протеазой, которая снова может растворить связанный фибрин, возникающий как конечный продукт свертывания. Стрепто- и стафилокиназы являются бактериальными активаторами плазминогена, которые не встречаются в физиологических условиях, однако могут быть применены для растворения тромба терапевтически. |
|||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 307. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |