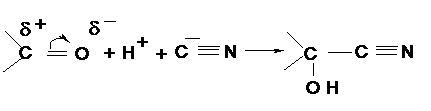Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Алициклические углеводородыИзомерия циклопарафинов: структурная и пространственная. Номенклатура. Основные способы получения алициклических соединений. Химические свойства: реакции замещения, окисления до двухосновных кислот. Превращения алициклических соединений в ароматические. Риформинг. Гипотеза напряжения Байера и современные представления об относительной прочности циклов. Конформации циклов. Циклогексан и циклопентан.
Методические указания На примере циклоалканов следует рассмотреть структурную и пространственную изомерию, иметь понятие о конформации, об устойчивости и напряженности циклов, их строении. Неустойчивость трех- и четырехчленных циклов можно объяснить теорией напряжения Байера. Если в цикле нет угловых напряжений или напряжений, возникающих в результате действия сил отталкивания, такой цикл энергетически выгоден и поэтому устойчив. Циклогексан, чтобы избежать углового напряжения, может принять две конфигурации – «ванна» и «кресло», но последняя конформация энергетически беднее, поэтому циклогексан имеет форму «кресла». В циклопентане нет углового напряжения, однако торсионное (поворачивающее) напряжение, связанное с тем, что атомы водорода у разных атомов находятся в частично или полностью заслоненных положениях, значительно. Чтобы его уменьшить, один из атомов углерода выводится из плоскости цикла и циклопентан принимает конформацию «конверт».
Вопросы для самопроверки 1. Напишите структурные формулы всех изомерных циклоалканов состава С5Н10 и назовите их. Какие виды изомерии возможны? 2. Напишите уравнения реакций циклопропана, циклобутана и циклопентана с бромом и бромоводородом. Поясните различие в устойчивости циклов.  3. Напишите уравнение реакции окисления циклогексанона.
Ароматические углеводороды (арены) Причины выделения ароматических соединений в особый ряд. Источники ароматических соединений: нефть, каменноугольная смола, коксовый газ. Ароматизация нефти. Развитие представлений о строении бензола. Формула Кекуле и современные электронные представления о строении бензола. Понятие об ароматическом характере. Правило Хюккеля. Гомологический ряд бензола. Номенклатура и изомерия. Получение гомологов бензола реакцией алкилирования. Физические свойства бензола и его гомологов. Химические свойства ароматических углеводородов. Общая характеристика. Реакции присоединения: водорода, галогенов, озона. Реакции электрофильного замещения (алкилирование, ацилирование, галогенирование, нитрование, сульфирование). Правила замещения в бензольном ядре. Заместители первого и второго рода. Электронная трактовка правил ориентации. Влияние заместителей на активность бензольного ядра. Окисление бензола и его гомологов. Понятие о многоядерных ароматических углеводородах с конденсированными и неконденсированными ядрами. Нафталин. Фенантрен. Антрацен. Дифенил. Трифенилметан. Понятие о канцерогенных веществах. Понятие о небензоидных ароматических соединениях. Использование ароматических углеводородов в промышленности.
Методические указания В химическом отношении ароматические соединения проявляют ряд особенностей, которые принять называть термином «ароматические свойства», т.е. они обладают так называемым «ароматическим характером» Молекула бензола симметрична и неполярна, но легко поляризуема. Наличие в ней подвижной системы π-электронов (ароматический секстет) привлекает электрофильные реагенты, которые замещают один или несколько атомов водорода, образуя продукты электрофильного замещения. Электрофильное замещение – одна из самых характерных для ароматических углеводородов видов реакций. К этому виду относятся реакции галогенирования, сульфирования, нитрования, алкилирования. Электрофильные реагенты – это частицы, «имеющие средство к электронам», образующие химическую связь за счет пары электронов атакуемой молекулы. К ним относятся катионы или молекулы с незаполненными валентными орбиталями. В незамещенном бензоле электронная плотность распределена равномерно по всему бензольному кольцу. Введение заместителей в бензольное ядро нарушает эту равномерность, появляется чередующаяся полярность углеродных атомов бензольного кольца. Различают: 1) заместители 1-го ряда, электронодонорные, активирующие бензольное ядро, орто- и пара-ориентанты, они ускоряют реакции электрофильного замещения и 2) заместители второго рода, электроноакцепторные, они уменьшают электронную плотность на ядре, замедляют электрофильное замещение, ориентируют вступающий заместитель в мета-положение, т.е. по месту наибольшей электронной плотности, при общем уменьшении электронной плотности в ядре. Характер ориентирующего влияния заместителей в ароматическом кольце связан с одновременным проявлением вызываемых ими индукционного и мезомерного электронных эффектов. Влияние индукционного эффекта сказывается на всей электронной системе кольца, затухая по мере удаления от заместителя. Действие мезомерного эффекта (сопряжения) выражено в основном в орто- и пара-положениях по отношению к заместителю. При наличии двух заместителей и более в бензольном кольце ориентация может быть согласованной и несогласованной, но действие заместителей 1-го рода всегда сильнее, чем действие мета-ориентантов.
Вопросы для самопроверки 1. Напишите формулы изомерных алкилбензолов состава С8Н10 и назовите их. 2. Напишите уравнения реакций сульфирования (1 моль) а) фенола; б) бензойной кислоты. Назовите образующееся соединение по систематической номенклатуре. 3. Из толуола получите хлористый бензил и пара-хлортолуол. Поясните механизмы реакций. 4. Получите изопропилбензол из бензола двумя способами. Изложите современные представления о строении бензола.
Одноатомные спирты Классификация гидроксисоединений по строению углеродного скелета и по атомности. Изомерия. Номенклатура спиртов. Способы получения спиртов: гидролизом галогеналкилов; действием металлорганических соединений на альдегиды и кетоны; гидратацией непредельных соединений, восстановлением карбонильных соединений. Физические свойства. Водородная связь, ее влияние на температуру кипения спиртов. Химические свойства. Общая характеристика. Реакции с разрывом связей С – ОН и О – Н. Реакции со щелочными металлами, галогеноводородными кислотами, галогенидами фосфора, тионилхлоридом. Образование простых эфиров. Получение сложных эфиров органических и минеральных кислот. Дегидратация, окисление и дегидрирование спиртов. Химические особенности первичных, вторичных и третичных спиртов. Понятиео непредельных спиртах.
Методические указания Все основные химические свойства спиртов связаны с наличием в молекулах функциональной спиртовой группы – ОН. Следует обратить внимание на реакции общие для всех спиртов, а также на реакции, отличающиеся друг от друга первичные, вторичные и третичные спирты. Для спиртов характерны два типа реакций: 1) реакции с разрывом связи О – Н (замещение водорода); 2) реакции с разрывом связи С – ОН (замещение группы – ОН). Приведите примеры таких реакций. При изучении способов получения спиртов и их химических свойств обратите внимание на тесную генетическую связь спиртов с другими классами органических соединений. Галогеналканы при щелочном гидролизе образуют спирты, что используется для получения последних. Поясните, почему спирты имеют высокие температуры кипения?
Вопросы для самопроверки 1. Напишите структурные формулы изомерных спиртов состава С4Н9ОН и назовите по номенклатуре ИЮПАК. 2. Получите вторичный и третичный бутиловые спирты реакцией Гриньяра и напишите для них реакции межмолекулярной дегидратации. 3. Реакцией гидратации изобутилена получите соответствующий спирт и напишите уравнение реакции его окисления. 4. Получите этанол тремя способами и напишите для него реакции дегидрирования и этерификации с уксусной кислотой.
Многоатомные спирты Классификация. Двухатомные спирты (гликоли). Получение гидролизом дигалогенопроизводных и галогенгидринов, гидратацией окисей, реакцией Вагнера. Физические свойства. Особенности химических свойств. Окисление. Внутри- и межмолекулярное выделение воды. Этиленгликоль: техническое получение и применение. Глицерин. Получение из жиров, брожением сахаристых веществ и из пропилена. Физические свойства глицерина. Химические свойства: образование глицератов, галогенгидринов, сложных эфиров, дегидратация, окисление. Применение глицерина в промышленности. Понятие о спиртах высшей атомности.
Методические указания Свойства двухатомных спиртов (гликолей) и трехатомного спирта глицерина в основном сходны со свойствами одноатомных, причем в реакцию может вступить одна или несколько гидроксильных групп. Например, этиленгликоль может образовывать два типа простых эфиров: СН2 – ОН – СН2 – ОСН3 монометиловый эфир этиленгликоля СН3О – СН2 – СН2 – ОСН3 диметиловый эфир этиленгликоля Гликоли, глицерин и другие многоатомные спирты образуют комплексное окрашенное соединение с гидроксидом меди (растворение осадка), что является качественной реакцией на многоатомные спирты. Следует обратить внимание на реакции внутри- и межмолекулярной дегидратации этиленгликоля и глицерина и особенно на окисление, в результате которого образуются продукты с различной степенью окисленности атома углерода. Особое место в ряду многоатомных спиртов занимает глицерин, который распространен в природе, участвует в построении молекул различных липидов и поэтому образуется при их гидролизе, обеспечивает взаимосвязь процессов обмена углеводов и жиро. Этиленгликоль и глицерин широко применяются в различных отраслях химической и пищевой промышленности.
Вопросы для самопроверки 1. Напишите уравнение рекции глицерина с гидроксидом меди. 2. Получите глицерин двумя способами. Где используется глицерин в пищевой промышленности? 3. Напишите уравнения реакций последовательного окисления глицерина. 4. Напишите уравнения реакций внутри- и межмолекулярной дегидратации этиленгликоля. 5. Какие соединения образуются при заимодействии глицерина с: а) уксусной кислотой (3 моль); б) азотной кислотой (3 моль). Где они применяются?
Фенолы Изомерия и номенклатура. Выделение фенолов из каменноугольной смолы. Получение фенолов из сульфокислот, из галогенопроизводных, из ароматических аминов. Физические свойства фенолов. Химические свойства. Образование фенолятов, алкилирование и ацилирование фенолов, действие галогенов, азотной и серной кислот, каталитическое гидрирование. Кислотные свойства фенольного гидроксила. Фенол и его применение в промышленности. Двухатомные фенолы. Пирокатехин, резорцин, гидрохинон. Понятие о хинонах; хингидрон. Трехатомные фенолы. a- и b-Нафтолы. Общие представления о свойствах, применение. Фенольные соединения в природе и промышленности. Фенольные антиоксиданты.
Методические указания На примере фенолов можно показать влияние бензольного ядра на свойства функциональной группы, связанной с ним непосредственно. В то время как спирты не обладают заметными кислотными свойствами, фенолы являются слабыми кислотами и образуют соли (феноляты) с водными растворами щелочей. Кислотные свойства фенолов обусловлены взаимодействием, сопряжением неподеленной пары р-электронов атома кислорода с π-электронами бензольного ядра (ароматическим секстетом), что способствует устойчивости образующегося в щелочной среде фенолят-аниона. Кислотные свойства фенолов усиливаются при наличии в кольце электроноакцепторных заместителей, которые еще больше способствуют делокализации электронов атома кислорода. Так, пикриновая кислота (2,4,6-тринитрофенол) является сильной кислотой. В свою очередь ОН – группа за счет положительного мезомерного эффекта (+М-эффект) облегчает, ускоряет реакции электрофильного замещения, которые идут в орто- и пара-положения бензольного ядра, т.е. по месту наибольшей электронной плотности. Например, даже при обработке фенола бромной водой выпадает осадок 2,4,6-трибромфенола. Для двухатомных фенолов с орто- и пара-положением гидроксильных групп (пирокатехин и гидрохинон) особенно характерна легкая окисляемость в орто- и пара-бензохиноны.
Вопросы для самопроверки 1. Напишите уравнения реакций фенола с: водным раствором NaOH, уксусным ангидридом, бромной водой. 2. Получите из толуола пара-крезол и подтвердите его кислотные свойства. 3. Напишите уравнение реакции окисления и восстановления гидрохинона. 4. Получите из фенола фенетол (этилфениловый эфир) и фенилацетат, пикриновую кислоту. 5. С помощью каких реакций можно отличить орто-крезол от изомерного ему бензилового спирта?
Простые эфиры Строение. Изомерия. Номенклатура. Способы получения: действием водоотнимающих средств на спирты, действием галогенопроизводных на алкоголяты, присоединением спиртов к алкенам. Физические свойства. Химические свойства: расщепление иодистоводородной кислотой, металлическим натрием. Образование оксониевых соединений. Понятие о циклических простых эфирах. Окись этилена, получение и техническое использование. Понятие об органических пероксидах и гидропероксидах.
Методические указания Простые эфиры общей формулы R – O – R можно рассматривать как соединения, образующиеся при отнятии молекулы воды от двух молекул спирта в результате межмолекулярной дегидратации. Простые эфиры – малореакционноспособные соединения в отличие от сложных эфиров. Они не гидролизуются в обычных условиях, не вступают во взаимодействие с металлическим натрием, на них не действуют щелочи и большинство кислот. Разрыв эфирной связи происходит только в жестких условиях: при нагревании, действии концентрированных кислот (HI, HBr, H2SO4) или расплавленного натрия. При низких температурах с сильными кислотами (HCl, H2SO4) простые эфиры образуют оксониевые соли, при этом протон кислоты присоединяется к кислороду эфира за счет его неподеленной пары р-электронов. На свету при хранении простые эфиры окисляются с образованием гидропероксидов (опасность взрыва). К циклическим эфирам относятся окись этилена, которая широко используется в органическом синтезе.
Вопросы для самопроверки 1. Получите диизопропиловый эфир двумя способами. 2. Напишите уравнения реакций взаимодействия метилпропилового эфира с иодистоводородной кислотой, с металлическим натрием (расплав). 3. Напишите структурные формулы простых эфиров состава С4Н10О и назовите их по рациональной и систематической номенклатурам.
Карбонильные соединения Строение, изомерия и номенклатура альдегидов и кетонов. Природа карбонильной группы (s- и p-связи). Получение альдегидов и кетонов: окислением спиртов, пиролизом солей карбоновых кислот, гидролизом дигалогенопроизводных, гидратацией ацетилена и его гомологов. Оксосинтез. Получение ароматических карбонильных соединений реакциями Фриделя — Крафтса и Гаттермана — Коха. Физические свойства. Химические свойства. Общая характеристика. Реакции с нуклеофильными реагентами: взаимодействие с синильной кислотой, магнийгалогеналкилами, гидросульфитом натрия, аммиаком, гидроксиламином, гидразином и его производными, образование полуацеталей и ацеталей. Полимеризация алифатических альдегидов. Альдольная и кротоновая конденсации. Восстановление альдегидов и кетонов. Окисление альдегидов и кетонов. Реакция серебряного зеркала. Реакция с фелинговой жидкостью. Отличие свойств альдегидов от свойств кетонов. Понятие о непредельных альдегидах и кетонах.
Методические указания Альдегиды и кетоны содержат карбонильную или оксогруппу
Основные реакции альдегидов и кетонов можно разделить на два типа: реакции присоединения по месту разрыва π-связи карбонильной группы и реакции, обусловленные высокой подвижностью атомов водорода при α-углеродах по отношению к карбонильной группе. Примером реакций такого типа может служить присоединение синильной кислоты с образованием оксинитрила:
К этому же типу относятся реакции с аммиаком, гидроксиламином, гидразином и их производными, которые протекают аналогично другим реакциям нуклеофильного присоединения, но с последующим отщеплением воды от продукта присоединения. Важной реакцией альдегидов и кетонов является реакция альдольно-кротоновой конденсации, которая имеет место при наличии подвижных атомов водорода при α-углеродном атоме по отношению к карбонильной группе. Кроме реакций, являющихся общими для альдегидов и кетонов, есть реакции, характеризующие различие их свойств.
Вопросы для самопроверки 1. Получите пропаналь и пропанон двумя способами. 2. С помощью каких реакций можно отличить бутаналь от бутанона? 3. Напишите уравнения альдольно и кротоновой конденсации для пропаналя и метилэтилкетона. 4. Напишите уравнения реакций уксусного альдегида с : а) этиловым спиртом (НСl); б) фелинговой жидкостью; в) изопропилмагнийбромидом; г) фенилгидразином. 5. Напишите уравнения реакций взаимодействия ацетофенона с гидроксиламином и синильной кислотой.
|
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 581. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
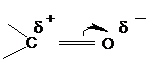 , которая сильно поляризована и определяет почти все химические свойства этих соединений.
, которая сильно поляризована и определяет почти все химические свойства этих соединений.