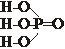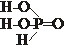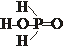Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ИСПРАВЛЕННЫЙ ПЕРЕЧЕНЬ ЗНАНИЙ, УМЕНИЙ И НАВЫКОВСтр 1 из 4Следующая ⇒ (целевые установки, учебные достижения)
МОДУЛЬ I.СОСТАВ И СТРОЕНИЕ ВЕЩЕСТВА
Тема 1. Атомно-молекулярное учение и стехиометрия
1. Показывать знание законов атомно-молекулярного учения (сохранения массы, постоянства состава, кратных отношений, простых объемных отношений, Авогадро). 2. Проводить расчеты по соотношениям, которые связывают массу, объем (для газов), количество, молярную массу и молярный объем (для газов) вещества, вычислять состав вещества по его формуле. 3. Выполнять расчеты по газовым уравнениям, по уравнению Клапейрона-Менделеева, приводить объем газообразного вещества к нормальным условиям. 4. Устанавливать простейшие и истинные формулы газообразных соединений по их составу и относительной плотности по другому газу. 5. Проводить простые стехиометрические расчеты по уравнениям реакций: по известной массе (объему) одного вещества вычислять массы (объемы) остальных веществ, участвующих в реакции. 6. Проводить сложные стехиометрические расчеты: при избытке или недостатке вещества, при наличии примесей в веществе, при неполном выходе реакции вследствие её обратимости. 7. Знать закон эквивалентов, проводить расчеты по закону эквивалентов: вычислять эквивалентную и атомную массу химического элемента, используя закон эквивалентов и правило Дюлонга и Пти; вычислять эквивалентные массы кислот, оснований, солей и оксидов по уравнениям реакций. 8. Определять стехиометрическую валентность элементов по формулам соединений и записывать формулы соединений по известной стехиометрической валентности элементов.
Тема 2. Классификация, свойства и номенклатура неорганических соединений 
1.(9). Владеть международной номенклатурой неорганических соединений и ионов, знать тривиальные названия распространенных неорганических (HCl, NaOH, NH3, CaO, Ca(OH)2, Na2CO3, NaHCO3, KClO3, NaСl,) и органических (СН4, С2Н6, С2Н4, С2Н2, С6Н6, С2Н5ОН, СН3СООН) соединений. 2.(10). Знать основные признаки классификации неорганических соединений (по составу, по свойствам), приводить примеры: оксидов (основные, кислотные, амфотерные, несолеобразующие), оснований (типичные, амфотерные; растворимые, нерастворимые; однокислотные, двухкислотные, трехкислотные), кислот (безкислородные и кислородные; одноосновные, двухосновные, трехосновные, сильные и слабые), солей (нормальные, кислые, основные, оксосоли, соли-кристаллогидраты). 3.(11). Показывать знание характерных химических свойств соединений основных классов. 4.(12). Устанавливать формулу ангидрида кислоты и кислоты, соответствующей данному ангидриду. 5.(13). Знать наиболее распространенные способы получения соединений основных классов. 6.(14). Показывать знание генетической связи между основными классами неорганических соединений (цепочки превращений).
Тема 3. Окислительно-восстановительные реакции
1.(15). Определять степень окисления элементов в любом соединении, отличать ОВР от реакций, протекающих без изменения степени окисления элементов. 2.(16). Находить в ОВР окислитель, восстановитель и среду. 3.(17). Устанавливать тип ОВР: межмолекулярная, внутримолекулярная, диспропорционирование, конпропорционирование. 4.(18). Определять стехиометрические коэффициенты методом электронного баланса. 5.(19). Вычислять эквивалентные массы восстановителей и окислителей.
Тема 4. Строение атома, периодический закон и Периодическая система Д.И. Менделеева
1.(20). Знать названия, обозначения, заряд и относительную массу частиц, входящих в состав атома. 2.(21). Объяснять, чем отличаются изотопы одного и того же химического элемента, записывать символы изотопов, вычислять атомную массу химического элемента по его изотопному составу. 3.(22). Понимать теоретические основы (принцип квантования, корпускулярно-волновая двойственность, принцип неопределенности) и знать экспериментальные факты, на которых основана современная модель строения атома. 4.(23). Объяснять понятие «атомная орбиталь» и знать наглядные формы её представления, изображать формы граничной поверхности s-, p- и d-орбиталей. 5.(24). Знать квантовые числа: названия, обозначения, физический смысл, значения, взаимосвязь. 6.(25). Знать закономерности формирования электронных оболочек многоэлектронных атомов: принцип наименьшей энергии, правила Клечковского, принцип Паули, правило Хунда. 7.(26). Записывать электронную формулу атома по атомному номеру элемента и указывать в атоме валентные электроны; для валентных электронов уметь записывать графическую формулу. 8.(27). Определять значения квантовых чисел для любого электрона в электронной оболочке атома. 9.(28). Знать формулировку периодического закона, структуру двух основных форм Периодической системы (8- и 18-клеточной), признак разделения элементов на семейства s-, p-, d- и f-элементов. 10.(29). Объяснять физический смысл атомного номера, периода и группы, знать отличия побочной подгруппы от главной в 8-клеточной форме Периодической системы. 11.(30). Знать и объяснять закономерности изменения в периодах и группах характеристик атомов (радиус и ионизационный потенциал) и свойств элементов и простых веществ (металлические и неметаллические свойства, электроотрицательность, окислительно-восстановительные свойства). 12.(31). Объяснять по электронному строению атома и месту элемента в Периодической системе химические свойства элемента, а также состав и свойства его оксидов и гидроксидов.
Тема 5. Химическая связь и строение вещества
1.(32). Объяснять содержание основных характеристик химической связи (длина, энергия, валентный угол, дипольный момент) и закономерности изменения длины и энергии связи в однотипных молекулах: неорганических (HF–HCl––HBr–HI, H2O–H2S–H2Se–H2Te) и органических (C2H6–C2H4–C2H2). 2.(33). Объяснять причину образования ковалентной связи и её свойства (направленность, насыщаемость, полярность, неполярность, валентный угол, дипольный момент). 3.(34). Изображать схемами метода валентных связей обменный механизм образования химической связи в молекулах H2, N2, F2, HF, H2O, H2O2, NH3, CO2. 4.(35). Различать в молекулах N2 и CO2 5.(36). Знать простейшие молекулы (CO) и ионы (NH 6.(37). Знать и иллюстрировать примерами основные типы гибридизации (sp, sp2, sp3, sp3d2); определять тип гибридизации по геометрическому строению молекулы (иона) и значению валентного угла и, наоборот, знать геометрическое строение молекул (ионов), соответствующее определённому типу гибридизации (при отсутствии несвязывающих орбиталей). 7.(38). Объяснять влияние несвязывающих орбиталей на строение молекул аммиака и воды. 8.(39). Объяснять методом молекулярных орбиталей образование и свойства двухатомных молекул и молекулярных ионов, содержащих элементы первого и второго периодов Периодической системы. 9.(40). Объяснять природу ионной связи; знать, между какими элементами она возникает и как она влияет на свойства веществ; объяснять закономерность изменения степени ионности в ряду однотипных соединений. 10.(41). Объяснять металлическую связь и её свойства теорией электронного газа. 11.(42). Знать, между какими молекулами образуется водородная связь и как она влияет на свойства соединений (температуру и энтальпию кипения, плотность, растворимость). 12.(43). Знать, между какими молекулами имеет место ориентационное, индукционное и дисперсионное взаимодействия и как они влияют на свойства соединений. 13.(44). Знать агрегатные состояния вещества (твердое, жидкое, газ, плазма) и как они отличаются по виду частиц и энергии связи между ними. 14.(45). Для твердого состояния знать классификацию кристаллов по виду частиц в узлах кристаллической решетки и типу взаимодействия межу ними (атомные, ионные, металлические, молекулярные) и характерные физико-химические свойства веществ с тем или иным типом кристаллов. МОДУЛЬ II.ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ РЕАКЦИЙ
Тема 6. Основы химической термодинамики
1.(46). Знать предмет химической термодинамики и параметры стандартного состояния, объяснять понятие «химическая система» и знать типы систем (открытая, закрытая, изолированная, неизолированная). 2.(47). Знать классификацию реакций в химической термодинамике (экзотермические и эндотермические, изохорные и изобарные, самопроизвольные и несамопроизвольные). 3.(48). Объяснять понятия внутренней энергии и энтальпии системы (вещества) и знать их взаимосвязь (первый закон термодинамики). 4.(49). Уметь записывать термохимические уравнения реакций, знать их особенности. 5.(50). Определять, не проводя вычислений, тип реакции (экзотермическая или эндотермическая) при известном и неизвестном значении энтальпии этой реакции. 6.(51). Знать определение понятия «стандартная энтальпия образования вещества»; уметь вычислять её, если известны масса (объем – для газа) простого вещества, взаимодействующего без остатка с другим простым веществом, и количество выделяющегося при этом тепла. 7.(52). По энтальпии образования вещества вычислять количество тепла, которое выделяется или поглощается при получении любой массы (объема – для газа) этого вещества. 8.(53). Вычислять энтальпию реакции по закону Гесса посредством алгебраических преобразований данных термохимических уравнений; вычислять энтальпию реакции по следствию закона Гесса. 9.(54). Вычислять количество тепла, которое выделяется или поглощается при получении известной массы (объема – для газа) продукта или при израсходовании известной массы или объема (для газов) реагента. 10.(55). Объяснять физико-химический смысл энтропии системы и стандартной энтропии вещества; определять по уравнению реакции, не проводя расчетов, как изменяется энтропия (увеличивается, уменьшается) при её протекании. 11.(56). Вычислять энтропию реакции и по полученному результату определять направление её протекания в изолированной системе (второй закон термодинамики). 12.(57). Вычислять энергию Гиббса химической реакции при стандартной и нестандартной температуре и делать выводы о возможности и направлении её самопроизвольного протекания в неизолированной закрытой системе. 13.(58). Определять, не проводя вычислений, направление реакции по знакам энтальпии и энтропии этой реакции. 14.(59). Сравнивать термодинамическую устойчивость соединений по справочным значениям их стандартной энергии Гиббса образования.
Тема 7. Химическое равновесие
1.(60). Знать термодинамические признаки химического равновесия; объяснять состояние химического равновесия с позиций химической кинетики, приводить примеры обратимых реакций. 2.(61) Записывать выражение закона действующих масс для равновесия обратимых гомо- и гетерогенных реакций. 3.(62). Вычислять исходную концентрацию реагентов при известных равновесных концентрациях реагентов и продуктов; вычислять равновесную концентрацию всех веществ при известной исходной концентрации реагентов и степени их превращения в продукты. 4.(63). Вычислять константу равновесия при известных равновесных концентрациях реагентов и продуктов или вычисленных по п. 3. 5.(64). Вычислять температуру, при которой константа равновесия равна единице. 6.(65). Устанавливать по принципу Ле Шателье направление смещения химического равновесия при изменении условий проведения реакции.
Тема 8. Основы химической кинетики
1.(66). Объяснять предмет химической кинетики и его отличие от химической термодинамики. 2.(67). Знать принципы классификации реакций на гомогенные и гетерогенные; простые и сложные; последовательные, параллельные и цепные; моно-, би- и тримолекулярные; приводить примеры соответствующих реакций. 3.(68). Знать закон действующих масс для скорости реакций, записывать кинетические уравнения реакций; для сложных реакций различать кинетический порядок и молекулярность реакции. 4.(69). Устанавливать кинетический порядок реакции по зависимости её скорости от концентрации реагентов, вычислять константу скорости реакции по данным о зависимости её скорости от концентрации реагентов. 5.(70). Объяснять физический смысл энергии активации и причину увеличения скорости реакции при повышении температуры; знать правило Вант-Гоффа и уравнение Аррениуса, проводить по ним прямые и обратные расчёты. 6.(71). Объяснять сущность катализа, приводить примеры каталитических реакций, вычислять увеличение скорости или константы скорости реакции при использовании катализаторов (при известных значениях энергии активации реакции без катализатора и при использовании катализатора).
МОДУЛЬ III.РАСТВОРЫ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Тема 9. Способы выражения концентрации растворов
1.(72). Знать названия, обозначения, определения и соответствующие определениям формулы шести способов выражения концентрации растворов: массовая доля, молярная, эквивалентная, титр, моляльность и мольная доля. 2.(73). Проводить расчеты на переход от одного способа выражения концентрации к другому. 3.(74). Проводить расчеты параметров раствора (концентрация, масса, объем, плотность), полученного методом растворения чистого вещества (твердого, жидкого, газообразного), разбавления водой данного раствора или выпариванием воды из раствора. 4.(75). Вычислять концентрацию раствора, получаемого смешиванием двух растворов с известной концентрацией. 5.(76). Вычислять массу вещества или объем раствора, необходимые для проведения реакции с другим раствором и массу (объем) вещества полученную при проведении данной реакции. 6.(77). Знать закон эквивалентов для реакций в растворах, вычислять концентрацию раствора кислоты или щёлочи по результатам основно-кислотного титрования. 7.(78). Проводить вычисления, связанные с коэффициентом растворимости вещества.
Тема 10. Образование и свойства растворов неэлектролитов и электролитов
1.(79). Знать сущность химической теории растворения, проводить вычисления, связанные с энтальпией растворения и гидратацией вещества. 2.(80). Приводить примеры растворов неэлектролитов, уметь вычислять свойства растворов неэлектролитов: понижение давления пара, повышение и понижение температур кипения и замерзания, осмотическое давление. 3.(81). Вычислять молекулярную массу неэлектролита по температурам кипения или замерзания его раствора. 4.(82). Приводить примеры растворов электролитов, объяснять механизм их электролитической диссоциации, записывать схемы диссоциации кислот, оснований, солей (средних, кислых, основных). 5.(83). Объяснять смысл константы и степени диссоциации электролита, уметь записывать выражения для константы диссоциации слабых электролитов. 6.(84). Знать закон разбавления Оствальда (его формулировку и математическое выражение) и проводить по нему расчеты. 7.(85). Вычислять водородный показатель растворов сильных и слабых электролитов. 8.(86). По справочным значениям произведения растворимости вычислять концентрацию насыщенного раствора данного малорастворимого вещества и объем воды, необходимый для растворения данной массы малорастворимого вещества.
Тема 11. Реакции в растворах электролитов
1.(87). Записывать в молекулярном и ионном виде уравнения ионообменных реакций с участием и образованием нерастворимого вещества, газа, слабого электролита, перевода кислых и основных солей в нормальные. 2.(88). Устанавливать направление ионообменной реакции, если в левой и правой частях её уравнения имеются нерастворимые вещества или слабые электролиты. 3.(89). Определять по формуле соли тип её гидролиза и среду её раствора. 4.(90). Записывать молекулярные и ионные уравнения гидролиза солей. 5.(91). Сравнивать соли по полноте их гидролиза (без расчетов). 6.(92). Устанавливать, что происходит с гидролизом данной соли (усиление, ослабление, изменений нет) при разбавлении раствора и введении в её раствор других веществ. 7.(93). Вычислять степень гидролиза соли и водородный показатель её раствора, если известна концентрация H+- или OH–-ионов в этом растворе; вычислять концентрацию H+- и OH–-ионов в растворах солей, если известен водородный показатель этих растворов.
Тема 12. Электрохимические процессы
1.(94). Объяснять физико-химический смысл электродного потенциала металла, знать свойства ряда напряжений и его условного разделения на три части, знать приблизительное расположение наиболее известных металлов (Na, Mg, Al, Zn, Fe, Cu, Au) в ряду напряжений. 2.(95). Записывать электрохимические схемы гальванических и концентрационных элементов, катодные и анодные полуреакции и токообразующие реакции. 3.(96). Вычислять ЭДС гальванических и концентрационных элементов при стандартных и нестандартных условиях. 4.(97). Записывать катодные и анодные полуреакции и суммарные реакции электролиза расплавов и растворов солей в электролизёре с инертным и активным анодом. 5.(98). Проводить количественные расчеты по законам Фарадея. 6.(99). Приводить примеры и описывать применение электролиза в химической промышленности (получение водорода и щелочей), в металлургии (получение и рафинирования металлов) и при нанесении покрытий. 7.(100). Знать закономерности протекания электрохимической коррозии металлов и способы их защиты от коррозии.
ЗАДАНИЯ БАНКА-600, переработанные согласно рекомендаям экспертов Тема 1. Атомно-молекулярное учение и стехиометрия
1. Объём некоторого количества аммиака при н.у. равен 5,6 л. Вычислите
2. Масса ортофосфорной кислоты равна 9,8 г. Определите
3. Масса газообразного кислорода равна 48 г. Вычислите
4. Углекислый газ массой 77 г занимает объём 40 л при 106,6 кПа. Вычислите
5. Объем аммиака при температуре 100 °С и давлении 200 кПа составляет 62 л. Вычислите:
6. Относительная плотность газообразного оксида азота по водороду равна 15. Определите
7. Плотность некоторого газа при н.у. равна 1,25 г/л. Вычислите
8. Относительная плотность газа по водороду равна 8. Вычислите
9. Относительная плотность газа по кислороду равна 2. Вычислите
10. Массовая доля углерода в его газообразном соединении с водородом равна 85,7 %, относительная плотность соединения по водороду равна 21. Определите
11. Массовая доля углерода в его газообразном соединении с водородом равна 85,7 %, относительная плотность соединения по водороду равна 14. Определите
12. Массовая доля углерода в его соединении с водородом равна 92,3 %, относительная плотность его пара по воздуху равна 2,69. Определите
13. Массовая доля углерода в его газообразном соединении с водородом равна 82,8 %, плотность вещества при н.у. 2,59 г/л. Определите
14. При сгорании серы образовалось 3 л газообразного оксида серы (IV), измеренного при 17 °С и 202650 Па. Вычислите (г)
15. Бертолетова соль KClO3 количеством 1 моль при нагревании разлагается с образованием хлорида калия и кислорода. Вычислите
16. При разложении 126 г дихромата аммония (NH4)2Сr2O7 образовались оксид хрома (III), азот и вода. Вычислите
17. При взаимодействии карбоната кальция с соляной кислотой выделился газ, объем которого при 27 °С и 101325 Па составил 1 л. Вычислите массы (г)
18. При взаимодействии 165 г железа с соляной кислотой выделился водород. Определите
19. Полученный при прокаливании карбоната магния газ занимает объем 127 л при 600 °С и давлении 104 кПа. Определите массы (г)
20. Углекислый газ, полученный при сжигании 150 г каменного угля, занимает объем 691,2 л при 600 °С и давлении 105 кПа. Определите
21. При сжигании 1 моль газообразного углеводорода образовалось 88 г углекислого газа и 18 г воды. Определите
22. При сжигании 11,2 л газообразного углеводорода (объём измерен при н.у.) образовалось 22 г углекислого газа и 18 г воды. Определите
23. При окислении 2 г двухвалентного металла образовалось 2,8 г оксида. Определите
24. При взаимодействии 2,8 г оксида двухвалентного металла с водой образовалось 3,7 г щёлочи. Определите
25. При взаимодействии 4,6 г одновалентного металла с водой выделилось 2,24 л (н.у.) водорода. Определите
26. Кислород объёмом 67,2 л (н.у.) полностью провзаимодействовал с кальцием. Вычислите
27. Магний массой 50 г сожгли в 30 л (н.у.) кислорода. Вычислите
28. При восстановлении 320 г оксида железа (III) водородом получается
29. Из технического карбида кальция СаС2 массой 1 кг получен ацетилен объёмом 224 л (н.у.). Вычислите
30. Оксид меди (II) массой 20 г полностью восстановили водородом. Вычислите
31. Раствор, содержащий 3,48 г сульфата алюминия, прилили к раствору, содержащему 0,4 г гидроксида натрия. Определите
32. Оксид магния массой 4 г внесли в раствор, содержащий 15 г азотной кислоты. Определите
33. При прокаливании известняка массой 500 г, содержащего 80 % карбоната кальция, образовался газ. Определите
34. При действии избытка соляной кислоты на 10 г сплава меди с алюминием выделилось 6,72 л водорода (н.у.). Определите
35. В кристаллогидрате сульфата меди (II) массовая доля воды составляет 36 %. Определите
36. В оксиде некоторого четырехвалентного металла массовая доля кислорода равна 40 %. Определите
37. В хлориде некоторого трехвалентного металла массовая доля металла равна 20 %. Определите
38. Массовая доля двухвалентного металла в его карбонате составляет 40 %. Определите
39. При взаимодействии двухвалентного металла массой 13,08 г с разбавленной серной кислотой выделяется 4,48 л водорода (н.у.). Определите металл и укажите
40. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Определите
41. Ортофосфорная кислота массой 9,43 г взаимодействует без остатка с 10,8 г гидроксида калия. Определите
42. Сульфид мышьяка содержит 39 % серы, эквивалентная масса которой равна 16. Определите
43. На восстановление 3,6 г оксида двухвалентного металла требуется 1,12 л водорода (н.у.). Вычислите
44. В оксиде меди на 1 г кислорода приходится 3,97 г меди. Определите
45. При взаимодействии 0,9 г трёхвалентного металла с соляной кислотой выделился водород. Молярная масса эквивалента металла равна 9 г/моль. Определите
46. При взаимодействии металла массой 65,4 мг с разбавленной серной кислотой выделяется 22,4 мл водорода (н.у.). Удельная теплоемкость металла равна 0,39 Дж/(г∙К). Определите
47. На окисление 0,8 г металла израсходовано 224 мл кислорода (н.у.). Удельная теплоемкость металла равна 0,66 Дж/(г∙К). Определите
48. Приведены эмпирическая и структурная формулы ортофосфорной кислоты
Определите
49. Приведены эмпирическая и структурная формулы фосфористой кислоты
Определите
50. Приведены эмпирическая и структурная формулы фосфорноватистой кислоты
Определите
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 217. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
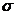 -связь и
-связь и 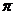 -связь, определять в них кратность химической связи; на примере молекул C2H6–C2H4–C2H2 и H2–N2 объяснять влияние кратности связи на ее энергию.
-связь, определять в них кратность химической связи; на примере молекул C2H6–C2H4–C2H2 и H2–N2 объяснять влияние кратности связи на ее энергию.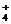 ), в которых химическая связь образуется по донорно-акцепторному механизму; определять в них степень окисления, стехиометрическую и электронную валентность элементов.
), в которых химическая связь образуется по донорно-акцепторному механизму; определять в них степень окисления, стехиометрическую и электронную валентность элементов.