
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
1. Изменение энтропии в химической реакции равно … . 1) сумме энтропий продуктов реакции 2) разности сумм энтропий исходных веществ и продуктов реакции 3) сумме энтропий исходных веществ 4) разности сумм энтропий конечных и исходных веществ
2. Энтропия идеально построенного кристалла при Т → 0 К стремится к … . 1) – ∞ 2) 0 3) + ∞ 4) – 273
3. Увеличение энтропии системы происходит в ряду превращений … . 1) Н2О (г) → Н2О (ж) → Н2О (т) 2) СО2 (г) → СО2 (т) → СО2 (г) 3) I2 (т) → I2 (ж) → I2 (г) 4) О2 (г) → О2 (ж) → О2 (г)
4. В результате реакций: 4Fе (т) + 3О2 (г) = 2Fе2О3 (т) ;
Н2 (г) + Сl2 (г) = 2НСl (г)
энтропия систем соответственно … . 1) увеличивается, практически не изменяется 2) уменьшается, увеличивается 3) увеличивается, увеличивается 4) уменьшается, практически не изменяется
5. Для вычисления 1) 2)
3) 4)
6. Энтропия практически не изменяется в реакции … . 1) 2) 3) 4)
7. Энергия Гиббса (изобарно-изотермический потенциал) определяется по уравнению … . 1) G = Н + ТS 2) G = S + ТН 3) G = Н – ТS 4) G = S – ТН
8. Условием возможности химической реакции является … . 1) увеличение энтальпии 2) уменьшение энтропии 3) уменьшение изобарно-изотермического потенциала 4) увеличение энергии Гиббса
9. Химическая реакция возможна при любых температурах, если … . 1) ΔН < 0 и ΔS < 0 2) ΔН > 0, а ΔS < 0 3) ΔН < 0, а ΔS > 0 4) ΔН > 0 и ΔS > 0 
10. Химическая реакция возможна при достаточно высоких температурах, если … . 1) ΔН < 0 и ΔS < 0 2) ΔН > 0 и ΔS < 0 3) ΔН < 0 и ΔS > 0 4) ΔН > 0 и ΔS > 0
11. Осуществить реакцию N2 (г) + 2О2 (г) = 2NО2 (г) – Q … . 1) невозможно ни при каких температурах 2) можно при любых температурах 3) можно при низких температурах 4) можно при высоких температурах
12. При стандартных условиях термодинамически возможна реакция … . 1) 2N2 (г) + О2 (г) = 2N2О (г), ΔН0 > 0 2) 4NН3 (г) + 3О2 (г) = 2N2 (г) + 6Н2О (г), ΔН0 < 0 3) 2Сl2 (г) + 2Н2О (г) = 4НСl (г) + О2 (г), ΔН0 > 0 4) 2NО (г) + О2 (г) = 2NО2 (т), ΔН0 < 0
13. При стандартных условиях термодинамически более устойчивым соединением является … . 1) Н2О (ΔG 2) Н2S (ΔG 3) Н2Sе (ΔG 4) Н2Те (ΔG
14. Изменение энергии Гиббса (свободной энергии) в химической реакции равно … . 1) сумме энергий Гиббса продуктов реакции 2) сумме энергий Гиббса исходных веществ 3) разности сумм энергий Гиббса исходных веществ и продуктов реакции 4) разности сумм энергий Гиббса продуктов и исходных веществ
15. Температура, при которой равновероятны оба направления реакции
N2 (г) + 3Н2 (г)
равна … К.
1) 92,182 2) 466,6 3) 2,1·10–3 4) 18,3
16. Из водородных соединений элементов VIА группы
Н2О (г), Н2S (г), Н2Sе (г), Н2Те (г) (ΔG0298, кДж/моль: –229 –34 + 71 + 138)
термодинамически из простых веществ можно получить … . 1) Н2Sе и Н2S 2) Н2О и Н2S 3) Н2Те и Н2S 4) Н2Sе и Н2О
17. При стандартных условиях из простых веществ термодинамически можно получить … . 1) Сl2О (г) и СuО (т) (ΔG
2) СаСl2 (т) и НСl (г) (ΔG
3) С2Н4 (г) и С2Н6 (г) (ΔG
4) NО (г) и NН3 (г) (ΔG
18. Из значений изменений энергий Гиббса (ΔG
СаО (т) + SО3 (г) = СаSО4 (т) (ΔG ВаО (т) + SО3 (г) = ВаSО4 (т) (ΔG СuО (т) + SО3 (г) = СuSО4 (т) (ΔG FеО (т) + SО3 (г) = FеSО4 (т) (ΔG
следует, что наиболее выраженными оснóвными свойствами обладает … . 1) СuО 2) СаО 3) ВаО 4) FеО
19. Знаки изменения свободной энергии реакций:
РbО2 (т) + Рb (т) = 2РbО (т) (ΔG SnО2 (т) + Sn (т) = 2SnО (т) (ΔG
показывают, что для атомов свинца и олова более характерными в химических соединениях являются степени окисления соответственно … . 1) +4 и +2 2) +2 и +4 3) +4 и +4 4) +2 и +2
ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ ХИМИЧЕСКАЯ КИНЕТИКА
1. Гомогенной является реакция … . 1) СаСО3 (т) + 2НСl (р-р) = СаСl2 (р-р) + Н2О (ж) + СО2 (г) 2) 2SО2 (г) + О2 (г) = 2SО3 (г) 3) S (т) + О2 (г) = SО2 (г) 4) С (т) + СО2 (г) = 2СО (г)
2. Гетерогенной является реакция … . 1) Zn (к) + Н2О (г) = ZnО (к) + Н2 (г) 2) Н2 (г) + I2 (г) = 2НI (г) 3) 4НСl (г) + О2 (г) = 2Сl2 (г) + 2Н2О (г) 4) 2Н2О (г) = 2Н2 (г) + О2 (г)
3. Увеличение скорости химической реакции при повышении температуры обусловлено увеличением … . 1) энергии активации молекул 2) числа активных молекул 3) общего числа молекул 4) объёма системы
4. При увеличении концентрации вещества А в 2 раза и уменьшении концентрации вещества В в 2 раза скорость реакции 2А + В = 2АВ … . 1) возрастёт в 2 раза 2) возрастёт в 4 раза 3) уменьшится в 2 раза 4) не изменится
5. На каталитический характер реакции указывает увеличение интенсивности … . 1) горения угля при его измельчения 2) горения фосфора при внесении его в атмосферу кислорода 3) разложения пероксида водорода в присутствии оксида марганца(IV) 4) окисление серы при подаче кислорода
6. Скорость гетерогенной реакции
А (г) + В (т) = АВ (г)
определяется уравнением … . 1) 3)
7. Для увеличения скорости гомогенной реакции 2NО + О2 = 2NО2 в 1000 раз давление необходимо увеличить в … раз(а). 1) 2 2) 5 3) 10 4) 20
8. Константа скорости химической реакции – это … . 1) скорость движения реагирующих веществ в газообразном состоянии 2) число соударений реагирующих частиц 3) скорость реакции при равных концентрациях реагирующих веществ 4) скорость реакции при единичных концентрациях реагирующих веществ
9. К изменению константы скорости химической реакции может привести изменение … . 1) давления или объёма системы 2) температуры системы 3) концентрации исходных веществ 4) концентрации продуктов реакции
10. Если при неизменной температуре концентрацию водорода в системе N2 (г) + 3Н2 (г) увеличить в 3 раза, то скорость прямой реакции … . 1) увеличится в 3 раза 2) уменьшится в 3 раза 3) увеличится в 27 раз 4) увеличится в 9 раз
11. Если при неизменной температуре давление в системе
FеО(т) + СО(г) увеличить в 2 раза, то скорость прямой реакции … . 1) увеличится в 2 раза 2) уменьшится в 2 раза 3) увеличится в 4 раза 4) увеличится в 6 раз
12. Если при неизменной температуре давление в системе
СО (г) + Н2 (г) уменьшить в 4 раза, то скорость обратной реакции … . 1) не изменится 2) увеличится в 4 раза 3) уменьшится в 4 раза 4) уменьшится в 16 раз
13. Для увеличения скорости реакции 2СО (г) в 4 раза концентрацию оксида углерода(II) необходимо увеличить в … раза. 1) 1,5 2) 2 3) 2,5 4) 3
14. Температурный коэффициент скорости большинства химических реакций принимает значения в пределах … . 1) 1 – 4 2) 2 – 4 3) 2 – 6 4) 1 – 6
15. Если температурный коэффициент скорости химической реакции равен 3, то ее скорость при повышении температуры на 20 0С … . 1) увеличится в 3 раза 2) увеличится в 9 раз 3) уменьшится в 3 раза 4) увеличится в 6 раз
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
1. Константа равновесия обратимой химической реакции изменяется при … . 1) изменении давления 2) изменении температуры 3) введении катализатора 4) изменении концентрации реагирующих веществ
2. Химическое равновесие смещается влево при понижении температуры в системе … . 1) С (т) + Н2О (г) 2) Н2 (г) + Сl2 (г) 3) РСl5 (г) 4) СО (г) + Сl2 (г)
3. Понижение температуры вызывает смещение химического равновесия вправо в системе … . 1) СО (г) + Н2О (г) 2) С (т) + СО2 (г) 3) 4НСl (г) + О2 (г) 4) Н2 (г) + I2 (г)
4. Повышение давления практически не влияет на химическое равновесие в системе … . 1) 2SО2 (г) + О2 (г) 2) N2 (г) + 3Н2 (г) 3) FеО (т) + СО (г) 4) 3NО2 (г) + Н2О (ж)
5. Химическое равновесие смещается вправо при повышении давления в системе … . 1) 2NО (г) + О2 (г) 2) 2Н2О (г) 3) N2О4 (г) 4) СаСО3 (т) 6. Для подавления окисления оксида углерода (II) по реакции
2СО (г) + О2 (г)
необходимо … . 1) уменьшить температуру 2) увеличить давление 3) уменьшить давление 4) ввести катализатор
7. Фактором, способствующим термическому разложению известняка по реакции
СаСО3 (т)
является … . 1) повышение температуры 2) повышение давления 3) введение катализатора 4) увеличение концентрации оксида углерода(IV)
8. Смещение химического равновесия в системе
Н2 (г) + Сl2 (г)
влево вызывает … . 1) повышение температуры 2) понижение температуры 3) добавление катализатора 4) увеличение давления
9. Повышение выхода оксида углерода(II) по реакции
СО2 (г) + Н2 (г)
вызывает … . 1) увеличение давления 2) уменьшение давления 3) увеличение концентрации водорода 4) увеличение концентрации оксида углерода(IV)
10. Подавление разложения оксида марганца (IV) следует при …
4МnО2 (т)
1) повышении температуры 2) повышении давления 3) понижении давления 4) введении катализатора 11. Для подавления прямой реакции
СаСО3 (т)
необходимо … . 1) понизить температуру 2) понизить давление 3) повысить температуру 4) ввести катализатор 12. Для смещения химического равновесия в системе
SО2 (г) + Сl2 (г)
влево необходимо … . 1) понизить температуру 2) понизить давление 3) ввести катализатор 4) повысить концентрацию оксида серы (IV) 13. Для увеличения выхода продуктов реакции
2Рb(NО3)2 (т)
необходимо … . 1) понизить температуру 2) уменьшить давление 3) увеличить давление 4) увеличить температуру 14. Для повышения эффективности синтеза аммиака по реакции
N2 (г) + 3Н2 (г)
необходимо … . 1) повысить температуру 2) повысить давление 3) понизить концентрацию азота 4) повысить концентрацию аммиака
15. Для эффективного окисления азота по реакции
N2 (г) + О2 (г)
необходимо … . 1) повысить температуру 2) повысить давление 3) понизить температуру 4) понизить давление |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 520. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 реакции NН4NО2 (т) = N2 (г) + 2Н2О (ж) следует воспользоваться уравнением … .
реакции NН4NО2 (т) = N2 (г) + 2Н2О (ж) следует воспользоваться уравнением … .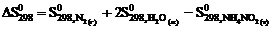
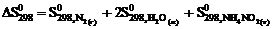

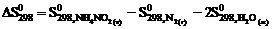
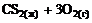 =
= 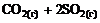
 =
= 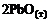
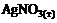 =
= 
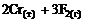 =
= 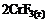
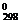 = –229 кДж/моль)
= –229 кДж/моль) 2NН3 (г) (ΔН0 = –92,38 кДж, ΔS0 = –0,198 кДж/К),
2NН3 (г) (ΔН0 = –92,38 кДж, ΔS0 = –0,198 кДж/К), = k · сА 2)
= k · сА 2)