
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Основные положения теории окисления-восстановленияСтр 1 из 21Следующая ⇒ ISBN 978-5-98276-393-8
Приведены материалы для выполнения лабораторных работ по курсу общей химии. Изложен теоретический материал и дано описание экспериментального выполнения семи лабораторных работ по разделам: «Окислительно-восстановительные и электрохимические процессы» (окислительно-восстановительные реакции, гальванический элемент, электролиз), «Коррозия и защита металлов» (коррозия металлов, защита от коррозии), «Дисперсные системы» (коллоидные растворы), «Химия воды» (жесткость воды). Для студентов всех специальностей первого курса ВолгГАСУ (кроме специальностей «Финансы и кредит», «Монументально-декоративное искусство», «Архитектура», «Дизайн архитектурной среды»). УДК 54 (076.5) ББК 24я73 ISBN 978-5-98276-393-8
ОГЛАВЛЕНИЕ ПРАВИЛА ПО ТЕХНИКЕ БЕЗОПАСНОСТИ.. 4 ЛАБОРАТОРНАЯ РАБОТА «ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ». 5 ЛАБОРАТОРНАЯ РАБОТА «ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ». 26 ЛАБОРАТОРНАЯ РАБОТА «ЭЛЕКТРОЛИЗ». 36 ЛАБОРАТОРНАЯ РАБОТА «КОРРОЗИЯ МЕТАЛЛОВ». 46 ЛАБОРАТОРНАЯ РАБОТА «ЗАЩИТА ОТ КОРРОЗИИ». 57 ЛАБОРАТОРНАЯ РАБОТА «КОЛЛОИДНЫЕ РАСТВОРЫ». 66 ЛАБОРАТОРНАЯ РАБОТА «ЖЕСТКОСТЬ ВОДЫ. МЕТОДЫ УМЯГЧЕНИЯ И ОПРЕДЕЛЕНИЯ ЖЕСТКОСТИ». 78 СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ... 96
ПРАВИЛА ПО ТЕХНИКЕ БЕЗОПАСНОСТИ 1. Прежде чем приступить к выполнению лабораторной работы, изучите методику ее проведения, получите инструктаж по технике безопасности (с последующей росписью в журнале) и разрешение преподавателя на выполнение работы.  2. Ознакомьтесь с расположением выключателей вентиляции и общего рубильника, отключающего электроснабжение лаборатории. 3. Выполнение работы разрешается только на специально оборудованном рабочем месте. Хождение по лаборатории, не связанное с проведением эксперимента, запрещено. 4. При выполнении работы соблюдайте максимальную осторожность. Помните, что невнимательность и небрежность могут повлечь несчастные случаи. 5. Все опыты с токсичными и неприятно пахнущими веществами проводить в вытяжном шкафу. Не пробовать вещества на вкус, а запах вещества испытывать только в случае, если это предусмотрено методикой эксперимента. 6. Будьте осторожны при работе с растворами кислот и щелочей, остерегайтесь попадания на кожу и одежду; в случае попадания быстро промойте пораженное место сильной струей воды. 7. Не зажигайте газовые горелки без разрешения преподавателя. При нагревании пробирку держите наклонно под углом 45°, направляя открытое отверстие пробирки от себя и от окружающих. Следует два-три раза прогреть пламенем пробирку по всей длине, а затем нагревать только нижнюю часть, заполненную жидкостью. 8. Во избежание загрязнения реактивов не ссыпайте и не сливайте обратно в склянки излишне взятые количества веществ. Взяв реактив для проведения опыта, сразу закройте склянку пробкой и поставьте на место. Не путайте пробки, закрывая склянки. 9. По окончании работы доложите преподавателю о полученных результатах, рабочее место приведите в порядок и сдайте дежурному или лаборанту. ЛАБОРАТОРНАЯ РАБОТА Цель работы: изучение закономерностей и условий протекания окислительно-восстановительных реакций.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ 1.1. Электроотрицательность элементов и образование Известно, что атомы объединяются в молекулы за счет образования между ними химической связи, которая возникает в результате перераспределения электронов между атомами. Существует несколько видов химической связи: ковалентная неполярная, ковалентная полярная, ионная, металлическая, но во всех случаях характеристики связи и то, какой вид связи образуется, зависит от такого свойства участвующих в ней атомов, как электроотрицательность. Эта характеристика позволяет судить, насколько легко атом отдает свои электроны и насколько активно принимает на вакантные места своей электронной оболочки электроны других атомов. Часто электроотрицательность определяют как относительную способность атомов элемента оттягивать на себя общую электронную пару, образующую химическую связь. Сравнивая электроотрицательности взаимодействующих атомов, можно определить, какой из них будет присоединять электрон (в случае ионной связи) или оттягивать на себя электронную пару (в случае полярной ковалентной связи), а какой будет отдавать электрон, полностью или частично. По одному из методов для количественной оценки электроотрицательностей вычисляют среднее арифметическое величин энергии ионизации и сродства к электрону. Энергия ионизации — энергия, необходимая для отрыва электрона от атома с превращением его в положительный ион. Она тем меньше, чем меньше число электронов на последнем энергетическом уровне и чем больше радиус атома. Сродство́ атома к электрону — энергия, выделяющаяся при присоединении электрона к свободному атому. Сродство металлов к электрону, как правил, близко к нулю или отрицательно. Для неметаллов это величина всегда положительная и тем больше, чем ближе к инертному газу расположен неметалл в Периодической таблице, т.е. чем более заполнен последний энергетический Для удобства используют не абсолютные значения электроотрицательности, а относительные, т.е. отнесенные к электроотрицательности лития, для которого относительная электроотрицательность принята равной единице. В соответствии с изменением радиусов атомов и числа электронов на последнем энергетическом уровне, электроотрицательность элементов в Периодической таблице (см. рис. 1) возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов подгруппы одной и той же группы Периодической таблицы. Элементы главных и побочных подгрупп рассматриваются раздельно, так как строение их электронных оболочек значительно отличается. Для этого как раз удобен использованный длиннопериодный вариант Периодической таблицы Д.И. Менделеева, в котором вставные декады элементов побочных подгрупп служат переходом между элементами главных подгрупп того же периода. Важнейшие химические элементы представляют в виде ряда электроотрицательности:
Сравним два типа химической связи: ионную и ковалентную полярную. Принято считать, что образование ионной связи сопровождается полным переносом электронов от одних атомов к другим, вследствие чего образуются разноименно заряженные частицы (катионы и анионы), которые притягиваются друг к другу, образуя молекулы. Например, ионы Na+ и Cl– соединяются в молекулу NaCl. Также принято считать, что при ионной связи электрические заряды каждого из атомов противоположны по знаку и равны целому числу: единице, как в данном случае, двум, трем и т.д. При образовании ковалентной полярной связи происходит не отдача, а только смещение связующих электронов в сторону более
электроотрицательного атома. Например, электронно-графическая формула бромистого водорода HBr: ..
.. Электрон водорода, участвующий в образовании связи, показан знаком "×". В молекуле HВr более электроотрицательный атом брома оттягивает к себе электронную пару. Поэтому атом водорода несет на себе некоторый избыточный положительный заряд, а атом брома — такой же по абсолютному значению избыточный отрицательный заряд. На самом деле эти заряды значительно меньше, чем (+1) или (–1), но, для упрощения, при подсчете электронов, принадлежащих каждому из атомов, полностью приписывают связующую пару электронов более электроотрицательному атому брома. Такое допущение означает, что у брома стало восемь электронов, а водород лишен электрона, т.е. брому условно приписывают заряд (–1), а водороду (+1). Таким образом, для молекул с ковалентным типом связи условно считают, что электронные пары, связывающие данный атом с другим атомом, так же как и при образовании ионной связи, полностью переданы более электроотрицательному атому. Отсюда следует определение степени окисления: Степень окисления — условный электрический заряд, который приписывается атому в составе молекулы при допущении, что молекула построена по ионному типу. Степени окисления атомов принято проставлять над символами атомов в соединении с указанием знака впереди числа: +1 –1 +1 +4 –2 +1+5–2 +1 –2 HCl, H2SO3, HNO3, H2O2.
В качестве другого примера рассмотрим распределение электронов в молекуле пероксида водорода H2O2 (по ранее применявшейся номенклатуре перекись водорода). Его электронно-графическая формула: .. .. H: O : O : H ·· ·· В этом соединении оба атома кислорода имеют степень окисления, равную (–1), так как общая электронная пара двух атомов кислорода принадлежит им в равной степени. Эта связь — ковалентная неполярная. Перетягиваются только электронные пары, образующие связи с атомами водорода. Степень окисления атомов водорода в этом соединении, как и в молекуле воды, равна (+1). Радикал [O2]2– может или отдатьдва электрона, или столько же присоединить. В зависимости от этого перекись водорода выполняет функции либо восстановителя, либо окислителя. Такое свойство называется окислительно-восстановительной двойственностью, подробнее об этом в разделе 1.4.
Основные положения теории окисления-восстановления При протекании химических реакций происходит разрушение существующих химических связей и образование новых, что, в большинстве случаев, сопровождается перераспределением электронов между атомами за счет отдачи и принятия электронов атомами или ионами. Закономерности этих процессов обобщены в положениях теории окисления-восстановления: 1. Процесс отдачи электронов атомом, молекулой или ионом называется окислением. Например: Аl – 3ē → Al+3; Н2 – 2ē → 2H+; 2Cl– – 2ē → Cl2. В процессе окисления простого вещества атом, бывший до того электронейтральным, приобретает избыточный положительный заряд. Если считать, что электроны полностью покинули электронную оболочку атома, то положительный заряд равен числу отданных электронов: Аl0 – 3ē → При окислении степень окисления повышается: Sn+2 – 2ē → Sn+4. 2. Процесс присоединения электронов атомом, молекулой или ионом называется восстановлением. Например: S + 2ē → S–2; Cl2 + 2ē → 2Сl–; Fe+3 + ē → Fe+2. В процессе восстановления простого вещества атом приобретает избыточный отрицательный заряд, равный по абсолютной величине числу принятых электронов: S0 + 2ē → S–2. При восстановлении степень окисления понижается (именно поэтому в английском языке и других европейских языках процесс восстановления обозначается термином reduction — понижение). 3. Атомы, молекулы или ионы, отдающие электроны и претерпевающие в ходе реакции процесс окисления, называются восстановителями, так как отдаваемые ими электроны обеспечивают процесс восстановления другого участника реакции, принимающего электроны. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями, так как, благодаря их действию, происходит процесс окисления другого участника реакции. Вo время реакции окислители восстанавливаются. 4. В окислительно-восстановительных процессах количество электронов, отданных в процессе окисления, всегда должно быть равно количеству электронов, принятых в процессе восстановления. Например: +2 –2 0 0 +1 –2 CuО + Н2 = Сu + H2O окислитель Cu+2 + 2ē → Cu0 (восстановление); восстановитель H02 –2ē → 2H+ (окисление). В этой реакции атом водорода отдает один электрон (а молекула водорода в целом — два электрона); водород является восстановителем.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 465. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

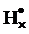 Br:
Br: Al+3.
Al+3.