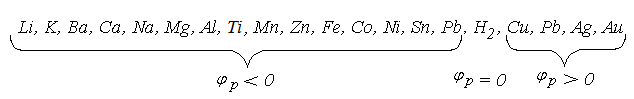Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
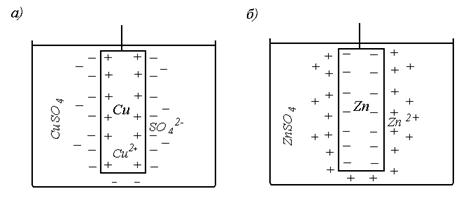
Процессы, проходящие на анодеНа аноде всегда присутствует несколько видов ионов. К ним относятся: ионы вещества анода, ионы воды, анионы растворённого в воде электролита.В связи с этим на аноде могут проходить разные физико-химические процессы. Один из таких процессов связан с окислением анода. Окисление выражается в том, что под действием приложенного к электродам напряжения электроны вещества анода покидают анод и поступают во внешний проводник, замыкая электрическую цепь. Металл анода заряжается положительно. Например, в электролите на основе CuSO4 и опущенном в него аноде, изготовленном из меди, анод отдаёт во внешнюю электрическую цепь электроны (е-) по реакции Cu0 – 2е- = Cu2+. В результате отдачи анодом электронов в системе «анод — электролит» могут создаться такие энергетические условия, при которых положительно заряженные ионы меди анода Cu2+ переходят в электролит.Происходит растворение вещества анода, что соответствует изменению его формы и качества поверхностного слоя, то есть обработке анода. Аноды, изготовленные из материалов, способных передавать ионы в раствор, получили название растворимых. Процессы растворения анода положены в основу методов обработки заготовок, осуществляемых со снятием с поверхности заготовки припуска. К ним относят, например, электрохимическую размерную обработку и электрохимическое полирование. Для того чтобы в системе «электролит – электроды» проходил электрический ток, на аноде должен окисляться один из видов анионов, образовавшихся в растворе. У поверхности анода в электролите присутствует несколько видов ионов. В частности, такими ионами являются ионы воды и кислотные остатки растворённого в воде вещества. Так, при использовании в качестве электролита водного раствора соли хлористого натрия NaCl, как показано ранее, кислотным остатком являются анионы Cl-. При определённых условиях протекания процесса анионы хлора могут окисляться на аноде, отдавая ему электроны, с образованием молекул хлора Cl2 и выделением их в виде газа по реакции  2Cl- – 2е- = Cl2↑. Выделение хлора на аноде является крайне нежелательным процессом при проведении операций электрохимической обработки заготовок. Однако использование процессов такого типа может стать основой получения на аноде электрохимическим методом некоторых газов, в том числе и хлора. Анионы вещества, находящиеся в электролите, достигая поверхности анода, могут вступать с ним в химическую реакцию и образовывать на аноде солевую плёнку.Как правило, образование плёнки резко увеличивает электрическое сопротивление поверхности анода, в результате чего процесс электролиза замедляется или вообще прекращается. Появление на поверхности анода оксидных плёнок получило название пассивации анода. Пассивация как технологический метод обработки заготовок используется для получения анодного покрытия поверхностей заготовок в виде оксидных плёнок. Именно таким способом осуществляют нанесение покрытий на заготовки при оксидировании, анодировании, фосфатировании. Кроме анодов растворимых, которые отдав свои электроны во внешнюю цепь, переходят при определённых условиях в раствор, существуют и нерастворимые аноды.Нерастворимые аноды также передают свои электроны во внешнюю цепь, обеспечивая прохождение в цепи электрического тока.Однако свои ионы в электролит они не выделяют. К нерастворимым анодам относятся аноды, изготовленные из свинца, графита, серебра, платины и ряда других неактивных металлов. В тех случаях, когда при электролизе используются нерастворимые аноды, на аноде может идти окисление воды с выделением молекулярного кислорода 2 H2O – 2е-® O2↑+ 4H+. При наличии на аноде несколько ионов различных видов окисляется преимущественно один из них. Идут при этом и попутные реакции, однако, как правило, их относят к нежелательным, поскольку снижают эффективность основного процесса, необходимого для осуществления электрохимической обработки заготовки. Возможность преимущественного реагирования на аноде ионов того или иного вида определяется значением его электродного потенциала. Электродный потенциал вещества. Электродным потенциалом вещества j(В) называют разность электрических потенциалов, возникающую между электродом, опущенным в электролит, и находящимся в контакте с ним электролитом.На поверхности раздела фаз «металл — электролит» образуется так называемый двойной электрический слой, характеризующийся тем, что тонкие приграничные слои каждой фазы получают противоположные по знаку заряды. Двойной электрический слой подобен плоскому конденсатору, внутренняя обкладка которого находится в твёрдой фазе, а внешняя — в жидкости параллельно поверхности электрода. При опускании электрода в электролит может происходить как окисление металла электрода Ме0 и переход его в виде ионов Меn+ в раствор, так и обратный процесс — восстановление ионов металла Меn+ из раствора и осаждение их на электроде в виде чистого металла Ме0. При равенстве скоростей обоих процессов между ними устанавливается динамическое равновесие Ме0 – nе-«Меn+. Смещение равновесия в сторону прямой или обратной реакции, то есть окисление металла электрода или восстановление ионов металла из раствора, зависит во многом от степени активности металла электрода. В случае использования в качестве электрода активного металла (например, Mg, Al, Fe, Zn) преобладает прямая реакция — окисление материала электрода. Часть атомов металла оставляет свои электроны на электроде (Ме0®Меn+ + nе-) и переходит в раствор в виде ионов, а поверхность металла приобретает отрицательный заряд. Ионы Меn+, которые находятся в электролите, притягиваются к поверхности, поэтому приграничный слой раствора заряжается положительно. Таким образом, на границе «металл — раствор» образуется двойной электрический слой и возникает разность потенциалов. Если электрод изготовлен из малоактивного металла (например, Cu, Ag, Au, Hg), то его ионы (соответственно Cu2+,Ag+, Au3+, Hg2+) проявляют заметную окислительную способность. В таком случае наблюдается обратный процесс, при котором некоторая часть ионов из раствора подходит к металлической пластине, восстанавливается и осаждается на поверхности (Меn+ + nе-® Ме0). Благодаря осаждению ионов металла на поверхности, пластина заряжается положительно и притягивает к себе отрицательно заряженные ионы кислотного остатка, находящиеся в растворе. Приэлектродный слой раствора заряжается отрицательно, а на границе раздела фаз «металл — раствор» возникает двойной электрический слой. На рисунке 3.2, а представлена схема образования двойного электрического слоя при опускании электрода из меди в электролит CuSO4.
Рис. 3.2. Электродные потенциалы: а —пассивного металла; б — активного металла В системе «электролит — электрод» создаются такие энергетические условия, при которых часть ионов Cu2+, находящихся в растворе, осаждаются на электроде и заряжает его положительно. Электрод и приэлектродный слой электролита создают так называемый двойной электрический слой, имеющий избыток отрицательно заряженных ионов SO42-. Измеренная разность потенциала электрода и двойного электрического слоя и составит электродный потенциал меди. Медь относится к группе пассивных металлов. Если проделать такую же операцию с активным металлом, например, с цинком, опустив цинковую пластину в электролит, состоящий из соли этого металла, например, ZnSO4, то металл отдаст свои ионы Zn2+ в раствор. Электрод в этом случае зарядится отрицательно (рис. 3.2, б). Электродные потенциалы обозначают символом j с соответствующим индексом а или к, обозначающим соответственно анод и катод. Определение электродного потенциала вещества проводят в специальных условиях, сопоставляя его с нормальным электродным потенциалом водородного электрода, на поверхности которого в стандартных условиях протекает реакция Н2 = 2Н+ + 2е-. Для водородного электрода и водных систем электродный потенциал условно принимается равным нулю Все металлы по значению равновесного электродного потенциала выстраивают в ряд активности (рис. 3.3). У металлов, стоящих слева от водорода, электродный потенциал отрицательный, а справа, за водородом — положительный.
Рис. 3.3. Ряд активности металлов |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 429. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
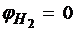 . Определённый таким образом относительный электродный потенциал электрода из другого вещества называется равновесным электродным потенциаломjр.
. Определённый таким образом относительный электродный потенциал электрода из другого вещества называется равновесным электродным потенциаломjр.