
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Коергизм при действии ксенобиотиков на разные участки рецепторной молекулыНизкомолекулярные вещества способны атаковать биологически активные протеины различными способами. Образуемые при этом связи токсиканта и протеина являются как специфическими (с активным центром энзима, аллостерическим центром энзима, рецепторной структурой и т.д.), так и неспецифическим (с сульфгидрильными, гидроксильными, аминогруппами белков и т.д.). Рецепторный ареал биологически активного протеина часто представляет собой относительно небольшой участок связывания субстрата и окружающий его периферический отдел. Решить вопрос о специфичности и неспецифичности (конкурентности и неконкурентности) действия токсиканта на рецепторную молекулу, как правило, чрезвычайно сложно. Лишь для некоторых энзимов и рецепторных протеинов изучены молекулярные механизмы их взаимодействия с отдельными токсикантами. Так, установлены закономерности взаимодействия ФОС с активным центром холинэстеразы и влияние так называемых реактиваторов холинэстеразы (оксимов) на этот процесс (см. раздел "Противоядия"). Показано, что морфин и N-аллилморфин очевидно реагируют с различными участками одной и той же молекулы опиатного рецептора. Антагонизм между веществами, по-видимому, основан на том, что рецептор к морфину при взаимодействии с одним из этих соединений принимает конформацию, затрудняющую взаимодействие с другим. N-этилмалеинимид, р-хлормеркуробензоат, цистеин, ионы ртути и мышьяка и другие вещества способны связываться с SH-группами белковых молекул, изменяя их конформацию. Таким образом, функциональные свойства молекул изменяются вследствие модификации структуры рецептора.  В холинэргических рецепторах пункт связывания ацетилхолина соседствует с -S-S- связью белковой молекулы, восстановление или окисление которой оказывает влияние на способность рецептора взаимодействовать с АХ. Восстановить дисульфидную связь можно с помощью Различные функциональные группы белков легко взаимодействуют с алкилирующими агентами, например с ипритами, формальдегидом, промежуточными продуктами метаболизма хлорированных углеводородов (дихлорэтан и т.д.), арсенидами, солями ртути и т.д. По большей части это ковалентные, и, следовательно, практически необратимые связи. Если рецепторная структура инактивирована за счет ковалентного связывания с токсикантом, то восстановление её активности возможно только путем синтеза de novo. В ходе токсикологических экспериментов при изучении коергизма между неконкурентными токсикантами, как правило, выявляется их способность одновременно изменять как сродство биомишени к эндогенным субстратам и ксенобиотикам-агонистам, так и активность соответствующей биомолекулы. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 359. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
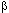 -меркаптоэтанола, окислить - гипосульфитом натрия. В опытах in vitro оба вещества существенно изменяют реакцию биопрепаратов на ацетилхолин, а также токсиканты, обладающие холиномиметической и холинолитической активностью.
-меркаптоэтанола, окислить - гипосульфитом натрия. В опытах in vitro оба вещества существенно изменяют реакцию биопрепаратов на ацетилхолин, а также токсиканты, обладающие холиномиметической и холинолитической активностью.