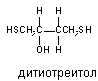Студопедия
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
|
ГЛАВА 2.3. ДЕЙСТВИЕ ТОКСИКАНТОВ НА МЕХАНИЗМЫ РЕГУЛЯЦИИ КЛЕТОЧНОЙ АКТИВНОСТИ
Существование высших форм организации живого стало возможным только благодаря кооперативному взаимодействию частей в рамках целостного организма. Так как состояние клеток, в силу их специфических свойств, определяет функциональное состояние организма в целом, клеточная активность должна регулироваться в соответствии с потребностями макроорганизма. Таким образом, кооперация, прежде всего, означает регуляцию. Можно выделить три основных механизма регуляции клеточной активности: прямое межклеточное взаимодействие, нервный и гуморальный контроль. Каждый из этих механизмов может стать объектом токсического воздействия.
1. Прямое межклеточное взаимодействие
Самая простая форма взаимодействия - влияние на соседние клетки продуктами собственного метаболизма. Межклеточное пространство для большинства тканей составляет около 15 нм, поэтому метаболиты за счет простой диффузии преодолевают это расстояние с большой скоростью. Кроме того между отдельными клетками возможен прямой обмен веществом через области межклеточных контактов, так называемые коннексоны. Во многих тканях клетки вырабатывают специальные биологически активные вещества, влияющие на функциональное состояние соседних структур. Особенно богато такими локальными биорегуляторами сосудистое русло. Здесь синтезируются и действуют оксид азота, эндотелины, лейкотриены, тромбоксаны, простогландины, фактор агрегации тромбоцитов. К числу таких веществ относится большая группа цитокинов и т.д. Механизм действия некоторых токсикантов может быть связан с активацией процесса образования этих веществ, ингибированием разрушения, имитацией их действия (агонисты). Так, полагают, что в основе регулирующего действия оксида азота на тонус сосудов лежит его способность образовывать с некоторыми эндогенными SH-содержащими веществами нестабильные нитрозотиолы. Период полусуществования такого соединения в организме 3 - 5 секунд:

Падение артериального давления, наблюдаемое при отравлении такими веществами, как NaNO2, нитропруссид, органические нитраты и нитриты может быть обусловлено образованием нитрозотиолов, т.е. вещества в данном случае могут проявлять свойства агонистов NO.
Тесный контакт между клетками обеспечивает сдерживание их размножения. Механическое разобщение клеток (пороз) провоцирует клеточный рост. Установлено, что у клеток злокачественных опухолей повреждены структуры, воспринимающие сигналы контактного ингибирования, поэтому даже в условиях полного окружения другими клетками они продолжают бурно размножаться. Не исключено, что в этом состоит один из механизмов канцерогенного действия токсикантов.
2. Механизмы гуморальной регуляции
С увеличением массы тела и сложности организации многоклеточного организма механизмы межклеточного взаимодействия становятся недостаточными для обеспечения регуляции его функций. Формируются специальные типы клеток, функция которых состоит в контроле за физиологической активностью других клеточных систем (эндокринные железы). Их влияние передаётся через кровь и межклеточную жидкость. В качестве переносчиков информации (веществ-регуляторов) выступают продукты метаболизма этих специальных клеток (гормоны). В регулируемых же клетках формируется специальный рецепторный аппарат, чутко реагирующий на изменение концентрации в окружающей среде соответствующих регуляторов (см. раздел "Селективные рецепторы"). Активация рецепторов приводит к изменению функциональной активности клеток. Рецепторная система усиливает воспринимаемый сигнал. Так, инсулин или глюкагон, концентрация которых в плазме составляет около 0,1 нМ, регулирует уровень глюкозы, содержание которой в крови - около 5 мМ. Гормоны модулируют специфическую активность определенных энзимов, влияют на скорость их синтеза и разрушения, регулируют транспорт химических веществ через биологические мембраны.
Действие гормона на органы и системы определяется его концентрацией в крови, а также наличием и количеством рецепторов чувствительных к нему в данной ткани. Концентрация гормона, в свою очередь, зависит от интенсивности процессов его синтеза и разрушения. Возможна интоксикация гормональными препаратами при их необоснованном введении или применении в дозах, существенно превышающих рекомендуемые.
Так как поступивший в кровь гормон разносится по всему организму, специфичность действия определяется характером распределения в тканях соответствующих рецепторов. Если рецепторы к гормону имеются у всех клеток организма, то и действие он оказывает на все органы и ткани (инсулин, катехоламины и т.д.).
Можно выделить две основные группы гормонов с учетом механизма их действия.
1. Гормоны, регулирующие процессы синтеза белка. К числу таких относятся эстроген, андроген, тироксин, трииодтиронин, соматотропин, глюкокортикоиды, инсулин, АКТГ и некоторые другие. Эти гормоны усиливают белковый синтез. Их действие нарушается блокаторами синтеза белка: актиномицином, пуромицином и др. (см. выше). Индуцирующая активность гормонов по-разному реализуется в разных тканях. Эффект наступает после продолжительного латентного периода (от нескольких часов, до суток). Практически значимыми являются проблемы, связанные с хроническим отравлением этими гормонами или их синтетическими аналогами.
2. Гормоны, регулирующие содержание вторичных месенджеров (цАМФ, цГМФ, диацилглицерол, фосфоинозитиды и др.) в клетках. К числу гормонов, действующих подобным образом относятся катехоламины, окситоцин, вазопрессин, инсулин, глюкогон, паратгормон и другие. Аналогичным образом действуют такие биологически активные вещества, как простогландины, серотонин, гистамин, ангиотензин и др. Эти гормоны взаимодействуют с соответствующими рецепторами, локализующимися на клеточной поверхности, что и приводит к изменению содержания в клетках регуляторов клеточной активности (см. выше). Распределение этих рецепторов в тканях определяет характер действия на них гормонов.
Гормоны, относящиеся к этой группе, действуют быстро. Латентный период продолжается несколько минут. Эффект не блокируется ингибиторами синтеза белка, но усиливается некоторыми веществами, например ингибиторами фосфодиэстераз (энзимы, активирующие процесс разрушения циклических нуклеотидов в клетках). Возможно острое отравление гормонами данной группы или их синтетическими аналогами. Например, в эксперименте острое отравление инсулином (острую гипогликемию) можно вызвать у крыс, предварительно голодавших в течение нескольких суток.
3. Механизмы нервной регуляции
Высший уровень регуляции функционального состояния клеток, органов, систем появляется с формированием у живых организмов нервной системы. Структурной единицей нервной системы является нервная клетка (нейрон), осуществляющая контакт, как с большим количеством других нейронов, так и клетками периферических органов. Мозг человека, по некоторым данным состоит из 1010 нейронов, каждый из которых имеет около 104 контактов с другими клетками. Под контролем нервной системы находятся все органы и системы организма. Так как скорость передачи сигнала по нервным волокнам велика, то и эффект реализуется с минимальным латентным периодом. Это свойство нервной системы чрезвычайно важно, поскольку позволяет организму быстро реагировать на изменяющиеся условия окружающей среды, используя органы чувств, управляя двигательной активностью, регулируя состояние внутренних органов.
Между собой и с периферическими структурами нервные клетки связаны нервными волокнами. Передача информации по волокнам осуществляется с помощью электрического и химического механизмов. Распространение сигнала по волокну имеет электрическую природу. Область контакта между окончанием нервного волокна и иннервируемой клеткой называется синапсом. Нервный импульс, достигнув нервного окончания (пресинаптические структуры), вызывает высвобождение химического вещества (нейромедиатора), которое, диффундируя через пространство, отделяющее нервное окончание от поверхности иннервируемой клетки (синаптическая щель), действует на селективные рецепторы (постсинаптические) и вызывает их возбуждение. Возбуждение рецептора приводит к изменению потенциала постсинаптической мембраны. Таким образом, инициируется ответная реакция клетки, находящейся под контролем нейрона. Выделившийся в синаптическую щель нейромедиатор взаимодействует с постсинаптическими рецепторами, подвергается энзиматическому расщеплению либо обратному захвату пресинаптическими структурами. Часть высвободившегося нейромедиатора взаимодействует с пресинаптическими рецепторами, возбуждая их, и по механизму обратной связи прерывает дальнейший выброс и активирует обратный захват.
Для передачи нервного импульса в синапсах в качестве медиаторов различные нейроны используют различные химические вещества. Нейромедиаторы синтезируются в пресинаптических структурах и находятся здесь в связанной форме, главным образом в специальных клеточных органелах, так называемых синаптических везикулах. В каждой везикуле, в среднем, содержится до 104 молекул нейромедиатора.
В настоящее время в ЦНС и на периферии идентифицировано более 17 типов регуляторных систем (классификация по строению нейромедиатора), на которые оказывают влияние, в том числе, и токсиканты: холинергическая (мускариночувствительная - 4 подтипа, никотиночувствительная - 2 подтипа), адренергическая (9 подтипов), дофаминергическая (5 подтипов), серотонинергическая (5 подтипов), ГАМК-ергическая (2 подтипа), глутаматергическая (4 подтипа), глицинергическая (1 подтип), гистаминергическая (3 подтипа), опиоидная (4 подтипа), пуринергическая (6 подтипов), пептидергическая (более 5 типов) и т.д.
Помимо "классических" медиаторов нервного импульса в нервной ткани определяются другие вещества, как правило пептидной природы, модулирующие эффекты нейромедиаторов на синаптические рецепторы. В настоящее время таких нейромодуляторов в ЦНС млекопитающих идентифицировано более 60 (таблица 1). Помимо ЦНС эти вещества определяются и в других органах (сосуды, желудочно-кишечный тракт и др.). Некоторые из них одновременно являются гормонами (см. выше).
Таблица 1. Некоторые пептидные модуляторы нервной системы млекопитающих
| Рилизинг-гормоны (РГ) гипоталамуса - тиреотропин-РГ - гонадотропин-РГ
- соматотропин-РГ - кортикотропин-РГ
| | Гормоны нейрогипофиза - вазопрессин - окситоцин
- нейрофизин
| Пептиды гипофиза - АКТГ - пролактин - лютеинизирующий гормон - соматотропин - 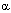 -меланотропин - -меланотропин - 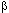 -эндорфин
- тиреотропин - глицил-глутамин -эндорфин
- тиреотропин - глицил-глутамин
| | Гастро-интестинальные пептиды - гастрин - субстанция Р - нейротензин - энкефалины - инсулин - глюкагон - секретин - бомбезин
- соматостатин - мотилин
| | Другие пептиды - ангиотензин 11 - брадикинин - карнозин - кальцитонин
- нейропептид Y
| В основе действие токсикантов на передачу нервного импульса лежат следующие механизмы (рис. 1):
- влияние на синтез, хранение, высвобождение и обратный захват нейромедиатора;
- непосредственное действие на селективные рецепторы;
- изменение сродства рецепторных структур к нейромедиаторам;
- изменение скорости синтеза, разрушения и распределения рецепторов в тканях;
- модификация состояния механизмов сопряжения между рецептором и эффекторной системой клеток.
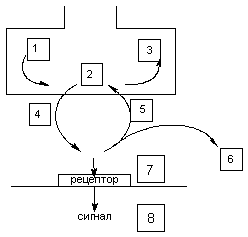
Рисунок 1. Места действия токсикантов на синапс. Схема этапов оборота нейромедиатора, воздействуя на которые токсикант может инициировать токсический процесс:
1 - синтез
2 - хранение
3 - метаболизм
4 - выделение
5 - обратный захват
6 - разрушение
7 - рецептор
8 - механизм проведения сигнала
4. Особенности токсического повреждения механизмов регуляции клеточной активности
В результате токсического действия ксенобиотиков на регуляторные механизмы формируются нарушения восприятия, памяти, мышления, двигательной активности, гемодинамики, дыхания, вегетативных процессов, метаболизма в органах и тканях и др. При этом обращают на себя внимание следующие закономерности:
1. Чем в большей степени токсикант структурно напоминает естественный биорегулятор, тем специфичнее его действие на организм, при этом, в зависимости от свойств, он либо имитирует эффект биорегулятора (агонист), либо блокирует его (антагонист). Таким образом, влияют на синаптические механизмы нервной регуляции многие алкалоиды (атропин, никотин, анабазин, мускарин, скополамин, курарин и т.д.) и огромное количество синтетических ядов.
2. Будучи аналогом биологически активного вещества, токсикант, тем не менее, может оказывать влияние лишь на часть эффектов, контролируемых в организме этим биорегулятором. Лучше всего этот феномен изучен для веществ, действующих на холинэргические синапсы (нейромедиатор - ацетилхолин). С помощью ацетилхолина нервный импульс передается в центральной нервной системе, вегетативных ганглиях, нервно-мышечных синапсах, нервных окончаниях парасимпатических волокон, иннервирующих гладкомышечные образования и железистую ткань. Однако рецепторы, взаимодействующие с медиатором, в перечисленных структурах имеют существенные особенности и оказываются чувствительными лишь к некоторым токсикантам. Так, алкалоид атропин действует преимущественно на нервные окончания парасимпатических волокон и некоторые виды холинергических синапсов ЦНС. При этом нервно-мышечные и ганглионарные синапсы остаются интактными. Алкалоид никотин, напротив, преимущественно действует на нервно-мышечные и ганглионарные синапсы.
Помимо различий структурно-функциональной организации рецепторов неодинаковое сродство органов и тканей к токсикантам - аналогам биорегуляторов, может быть обусловлено особенностями токсикокинетики ксенобиотиков.
3. Вещества, изменяющие количество нейромедиатора, находящегося в синаптической щели в момент передачи нервного импульса, как правило, обладают высокой токсичностью. Это обусловлено тем обстоятельством, что степень возбуждения постсинаптических рецепторов определяется количеством образующихся комплексов медиатор - рецептор в единицу времени, а, следовательно, зависит от концентрации медиатора в синаптической щели. В основе токсического действия таких веществ лежит нарушение механизмов синтеза нейромедиаторов (гидразин и его производные), их высвобождения (тетанотоксин, ботулотоксин) и разрушения (ФОС, карбаматы).
Действие токсикантов на рецепторы не редко сопровождается существенным изменением количественных и качественных характеристик последних.
4.1. Изменение числа рецепторов, вызываемое действием ксенобиотиков.
Число селективных рецепторов на клеточной мембране определяется соотношением скоростей процессов их разрушения и синтеза. Период полуобращения известен для очень ограниченного количества рецепторов. В среднем это время для различных рецепторов колеблется от трех суток до нескольких недель.
Поскольку рецепторы представляют собой белковые молекулы, их биосинтез ничем не отличается от синтеза других белков. Достаточно подробно, например, изучен процесс синтеза никотинэргического рецептора. После "сборки" полипептидной цепи на соответствующих полисомах белковая молекула встраивается в мембрану шероховатого эндоплазматического ретикулума, а затем с фрагментами этой мембраны переходит в везикулы аппарата Гольджи. Везикулы перемещаются в окончания нервных отростков с цитоплазматическим током, сливаются с клеточной мембраной, а в следствие экзоцитоза, молекула оказывается на поверхности клетки. Время синтеза рецепторной структуры составляет около 150 минут.
Некоторые ксенобиотики (особенно при длительном воздействии на организм) в состоянии оказывать влияние на синтез, биодоступность и разрушение тех или иных рецепторов. В итоге изменяются свойства как биорецепторных систем, так и организма в целом, в частности, его чувствительность к токсикантам.
4.1.1. Уменьшение количества рецепторов при воздействии токсикантов
Уменьшение количества рецепторов, как правило, является следствием длительного действия токсиканта - агониста эндогенного лиганда рецептора, либо самого лиганда в несвойственных организму концентрациях. Примерами рецепторов, для которых экспериментально доказана возможность такой реакции, являются рецепторы к ацетилхолину, инсулину, пролактину, а также рецепторы с тирозинкиназной активностью. В данном случае разрушение интернализировавшегося рецептора и его синтез идут параллельно. При хроническом стимулировании структуры развивается постепенное, но стойкое снижение числа рецепторов за счет неспособности процессов синтеза компенсировать усиленный распад рецептора.
Указанный эффект имеет особое значение при длительном использовании некоторых лекарств. Так, прием агонистов 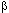 2-адренорецепторов (изопреналин) лицами, страдающими бронхиальной астмой, со временем приводит к нарушению механизмов нервной регуляции дыхательных путей. Систематический прием психофармакологических препаратов может приводить к нарушению функций ЦНС. 2-адренорецепторов (изопреналин) лицами, страдающими бронхиальной астмой, со временем приводит к нарушению механизмов нервной регуляции дыхательных путей. Систематический прием психофармакологических препаратов может приводить к нарушению функций ЦНС.
4.1.2. Увеличение числа мембраносвязанных рецепторов при воздействии токсикантов
Противоположным, описанному выше, является процесс увеличения числа рецепторов при действии ксенобиотиков. Это может быть следствием длительной блокады рецепторов антагонистом эндогенного лиганда (нейромедиатора, гормона), либо повреждения токсикантом проводящих путей, по которым нервный импульс поступает к клеткам-мишеням. До настоящего времени не ясно, является ли увеличение числа рецепторов следствием угнетения процесса их разрушения или усиления синтеза.
Для клеток, способных к дифференциации (клетки иммунной системы), имеет значение индукция экспрессии рецепторов. В этой связи хорошо изученной является модуляция числа рецепторов интерлейкина-2. Количество этих рецепторов может быть оценено как путем определения количества связывающегося клетками вещества, так и с помощью специфических моноклональных антител. В процессе индукции иммунного ответа незрелые Т-лимфоциты стимулируются таким образом, что начинают синтезировать рецепторы интерлейкина и встраивать их в клеточную мембрану. Вследствие этого у клеток и появляется способность взаимодействовать с этими биологически активными веществами, что необходимо для дальнейшей дифференциации и специализации Т-клеток.
4.2. Десенсибилизация рецепторов
Термин "десенсибилизация" используют в нескольких смыслах. Иногда это понятие применяют для обозначения явления снижения выраженности реакции клеток на токсикант, развивающегося вследствие уменьшения числа рецепторов к нему (см. выше). Более правильно этим термином обозначать явление быстро развивающегося понижения реактивности рецепторно-эффекторного комплекса клеток вследствие действия на него агониста. То есть, в узком смысле слова, десенсибилизация - это переход рецептора в новое состояние (иную конформацию) после его взаимодействия с агонистом, при котором продолжение действия вещества не приводит к дополнительной активации эффекторной системы. Рецептор, находящийся в этой конформации переходит в неактивное состояние. Этот феномен в эксперименте выявляется при действии на биологический объект различных ксенобиотиков в возрастающей концентрации.
Каково значение явления десенсибилизации в обычных физиологических условиях остаётся не ясным. Между тем известно, что в нормальных условиях в активном состоянии находится лишь малая часть рецепторов к эндогенным лигандам.
РАЗДЕЛ 3. ТОКСИКОМЕТРИЯ
ГЛАВА 3.1. ЗАВИСИМОСТЬ "ДОЗА-ЭФФЕКТ" В ТОКСИКОЛОГИИ
1. Общие замечания
Спектр проявлений токсического процесса, определяются строением токсиканта. Однако выраженность развивающегося эффекта является функцией количества действующего агента.
Для обозначения количества вещества, действующего на биологический объект, используют понятие - доза. Например, введение в желудок крысе весом 250 г и кролику весом 2000 г токсиканта в количестве 500 мг, означает, что животным введены дозы равные соответственно 2 и 0,25 мг/кг (более подробно понятие "доза" будет рассмотрено ниже).
Зависимость "доза-эффект" может быть прослежена на всех уровнях организации живой материи: от молекулярного до популяционного. При этом в подавляющем большинстве случаев будет регистрироваться общая закономерность: с увеличением дозы - увеличивается степень повреждения системы; в процесс вовлекается все большее число составляющих её элементов.
В зависимости от действующей дозы практически всякое вещество в определенных условиях может оказаться вредным для организма. Это справедливо для токсикантов, действующих как местно (таблица 1), так и после резорбции во внутренние среды (таблица 2).
Таблица 1. Зависимость между концентрацией формальдегида во вдыхаемом воздухе и выраженностью токсического процесса
| Концентрация (см3/м3 - ppm)
| Клинические проявления
| | 0,01 - 0,05
| Раздражение глаз
| | 0,05 - 1,00
| Непереносимый запах
| | 0,05 - 3,00
| Раздражение верхних дыхательных путей
| | 3,00 - 10,00
| Сильное раздражение слизистой дыхательных путей
| | 10,00 - 30,00
| Раздражение глубоких дыхательных путей
| | 50,00 - 100,00
| Воспалительный процесс в легких; токсический отек
| (P.M. Misiak, J.N. Miceli, 1986)
Таблица 2. Зависимость между концентрацией этанола в крови и выраженностью токсического процесса
| Концентрация мг/100 мл
| Клинические проявления
| | 20 - 99
| Изменение настроения; прогрессирующее нарушение координации движений, сенсорных функций; изменение поведения
| | 100 - 199
| Выраженные нарушения мышления; увеличение времени реакции на внешние раздражители; атаксия
| | 200 - 299
| Тошнота; рвота; выраженная атаксия
| | 300 - 399
| Гипотермия; дизартрия; амнезия; 1 стадия анестезии
| | 400 - 700
| Кома; угнетение дыхания; смерть
| (T.G. Tong, D. Pharm, 1982)
На проявление зависимости "доза-эффект" оказывает существенное влияние внутри- и межвидовая изменчивость организмов. Действительно, особи, относящиеся к одному и тому же виду, существенно отличаются друг от друга по биохимическим, физиологическим, морфологическим характеристикам. Эти отличия в большинстве случаев обусловлены их генетическими особенностями. Еще более выражены, в силу тех же генетических особенностей, межвидовые различия. В этой связи дозы конкретного вещества, в которых оно вызывает повреждение организмов одного и того же и, тем более, разных видов, порой очень существенно различаются. Следовательно, зависимость "доза-эффект" отражает свойства не только токсиканта, но и организма, на который он действует. На практике это означает, что количественную оценку токсичности, основанную на изучении зависимости "доза-эффект", следует проводить в эксперименте на различных биологических объектах, и обязательно прибегать к статистическим методам обработки получаемых данных.
2. Зависимость "доза-эффект" на уровне отдельных клеток и органов
Предварительные замечания
Самым простым объектом, необходимым для регистрации биологического действия токсиканта, является клетка. При изучении механизмов токсического действия это положение не редко опускают, концентрируя внимание на оценке характеристик взаимодействии химического вещества с молекулами-мишенями (см. выше). Такой упрощенческий подход, оправданный на начальных этапах работы, совершенно не допустим при переходе к изучению основной закономерности токсикологии - зависимости "доза-эффект". На этом этапе необходимо изучить количественные и качественные характеристики реакции всего эффекторного аппарата биообъекта на возрастающие дозы токсиканта, и сопоставить их с закономерностями действия ксенобиотика на молекулярном уровне.
2.2. Основные понятия
Рецепторная концепция действия токсикантов на клетку или орган предполагает, что в его основе лежит реакция вещества с определенной биологической структурой - рецептором (см. раздел "Механизм действия"). Наиболее глубоко эти представления развивались в ходе исследований на моделях взаимодействия ксенобиотиков с селективными рецепторами эндогенных биорегуляторов (нейромедиаторов, гормонов и др.). Именно в такого рода опытах установлены базовые закономерности, лежащие в основе зависимости "доза - эффект". Общепризнанно, что процесс образования комплекса вещества с рецептором подчиняется закону действующих масс. Однако гипотетичными до настоящего времени остаются представления, позволяющие связать количественные и качественные характеристики этой первичной реакции и выраженность эффекта со стороны целостной биологической системы. Для преодоления возникающих сложностей принято выделять две токсикометрические характеристики ксенобиотика:
1. Афинность - отражает степень сродства токсиканта к рецептору данного типа;
2. Эффективность - характеризует способность веществ вызывать определенный эффект после взаимодействия с рецептором. При этом ксенобиотики, имитирующие действие эндогенного биорегулятора, называются его агонистами. Вещества, блокирующие действие агонистов, называются антагонистами.
2.3. Афинность
Измерение афинности токсиканта к рецептору, по сути, представляет собой экспериментальное изучение зависимости между количеством вещества, добавляемого в инкубационную среду, и количеством образующегося в результате взаимодействия токсикант-рецепторного комплекса. Обычный методический прием - радиолигандные исследования (см. выше).
При использовании закона действующих масс для определения афинности необходимо учитывать, что исследователю известны количественные характеристики содержания в среде только одного из участников процесса - токсиканта [P]. Количество рецепторов [R]T, участвующих в реакции, всегда не известно. Существуют методические приемы и допущения, позволяющие в ходе эксперимента и на этапе анализа обработки полученных результатов преодолеть эту сложность.
2.3.1. Описание взаимодействия "токсикант-рецептор" в соответствии с законом действующих масс
В простейшем случае для описания процесса образования комплекса вещества и рецептора применяют кинетические характеристики реакции второго порядка.
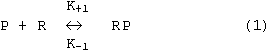
В соответствии с законом действующих масс:
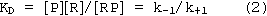
KD - константа диссоциации комплекса "токсикант-рецептор".
1/KD - константа ассоциативного процесса, является мерой сродства токсиканта к рецептору.
Поскольку общее количество рецепторов в изучаемой системе (культура клеток, изолированный орган и т.д.) есть сумма свободных [R] и вступивших во взаимодействие с веществом [RP] рецепторов, то:
[R]T = [RP] + [R] (3)
С учетом уравнений (2) и (3), имеем
[RP]/[R]T = y = [P]/([P] + KD) (4)
Степень насыщения рецептора токсикантом "у" есть отношение связавшегося с веществом рецептора к общему количеству рецепторов. Поскольку количество образовавшегося комплекса [RP] может быть определено экспериментально появляется возможность рассчитать значение КD в соответствии с уравнением (4). В графическом представлении зависимость насыщения рецептора от концентрации токсиканта в среде имеет вид гиперболы, что также может быть использовано для определения значения константы диссоциации.
2.3.2. Более сложные модели взаимодействия "токсикант-рецептор"
Экспериментально получаемые кривые связывания токсиканта на рецепторах не редко более крутые или более пологие, чем следует ожидать, исходя из закона действующих масс. Иногда выявляются кривые со сложной зависимостью степени насыщения рецептора токсикантом от его концентрации. Эти отклонения обычно объясняют тремя обстоятельствами:
1. Реакция между веществом и рецептором не является бимолекулярной. В этом случае требуется иная форма задания зависимости, чем представленная уравнением (4):
y = [P]n/([P]n + KD) (5)
где n (константа Хила) - формально отражает число молекул токсиканта, принимающих участие в образовании одного комплекса "токсикант-рецептор".
2. Популяция рецептора, с которым взаимодействует токсикант, гетерогенна. Так, если в биологическом объекте в равных количествах содержатся два подтипа рецептора, различающихся в 3 раза величиной константы ассоциации комплекса "токсикант-рецептор", то суммарное значение константы Хила, исследуемой зависимости будет равно 0,94. При больших различиях значений констант ассоциации интегральная её величина в ещё большей степени будет отличаться от 1,0.
3. Определенное влияние на процесс образования комплекса "токсикант-рецептор" оказывают такие явления, как изменение конформации рецептора, кооперативности его отдельных субъединиц, различные аллостерические эффекты. Так, нередко кривая связывания токсиканта с рецептором имеет S-образный вид. Это свидетельствует о взаимном влиянии соседних участков связывания токсиканта с макромолекулой (например, образование комплекса с одной субъединицей рецептора приводит к изменению его сродства к другим, свободным субъединицам). Подобный эффект наблюдается при изучении связывания ацетилхолина препаратом тканевых мембран, содержащих холинорецептор. Увеличение концентрации свободного [3Н]-ацетилхолина в инкубационной среде сопровождается возрастанием афинности вещества к рецепторным протеинам (рисунок 1). Местный анестетик прилокаин при добавлении в инкубационную среду нарушает явление кооперативности рецепторов и, тем самым, ограничивает увеличение сродства к ним ацетилхолина. Об этом свидетельствует изменение формы кривой зависимости "связывание - концентрация токсиканта" и превращение её из S-образной в обычную гиперболическую.
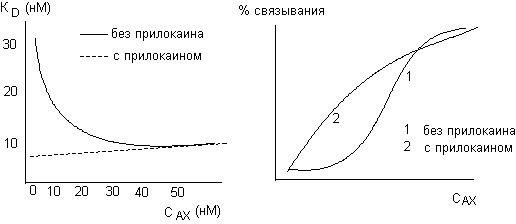
Рисунок 1. Влияние прилокаина на процесс связывания ацетилхолина с холинорацептором (J.B. Cohen et al., 1974)
2.4. Эффективность
В многочисленных опытах показано, что между способностью вещества образовывать комплекс с рецептором определенного вида и выраженностью формирующегося при этом биологического эффекта (например, сокращение гладкомышечных волокон стенки кишечника, изменение сердечного ритма, выделение секрета железой и т.д.) далеко не всегда прослеживается прямая зависимость. Для описания результатов экспериментальных исследований, в которых эта зависимость изучалась, предложен ряд теорий.
Как указывалось ранее, все токсиканты, взаимодействующие с рецептором условно могут быть подразделены на агонисты и антагонисты. В этой связи ниже, при обозначении концентрации токсиканта в среде, будут использоваться соответственно символы: [А] - концентрация агониста; [В] - концентрация антагониста.
2.4.1. Оккупационные теории
Самая первая из предложенных теорий принадлежала Кларку (1926), который предположил, что выраженность наблюдаемого эффекта линейно связана с количеством рецепторов, оккупированных токсикантом ([RP]/[R]).
Как следует из уравнения (4)
[RA]/[R]T = [A]/([A] + KA) = EA/EM (6)
где ЕА - выраженность эффекта от действия агониста в примененной концентрации;
ЕМ - максимально возможный эффект со стороны исследуемой биологической системы;
КА - константа диссоциации комплекса "агонист-рецептор".
Согласно теории Кларка 50% выраженности эффект развивается при такой дозе агониста, при которой оккупировано 50% рецепторов ([А]50). Эта доза вещества называется среднеэффективной (ЕД50).
Аналогично, в соответствии с законом действия масс, с рецептором взаимодействует и антагонист, не вызывая при этом эффекта
КВ = [В][R]/[ВR] (8)
где КВ - константа диссоциации комплекса "рецептор-антагонист".
Если агонист и антагонист действуют на рецептор одновременно, то, естественно, количество рецепторов, способных связаться с агонистом понижается. Общее количество рецепторов в биообъекте может быть обозначено как
[R]T = [R] + [RA] + [RB] (9)
В соответствии с рассматриваемой теорией токсикант может быть либо агонистом, либо антагонистом. Однако результаты многочисленных исследований указывают на то, что подобная классификация веществ оказывается недостаточной для описания наблюдаемых эффектов. Так установлено, что максимальный эффект, вызываемый различными агонистами, действующими на одну и туже рецепторную систему, не одинаков.
Для преодоления этого противоречия Стефенсоном (1956) были предложены три допущения:
- максимальный эффект может быть вызван агонистом даже в том случае, если оккупирована лишь незначительная часть рецепторов;
- развивающийся эффект не линейно связан с количеством оккупированных рецепторов;
- токсиканты обладают неодинаковой эффективностью (относительной возбуждающей активностью), т.е. способностью вызывать эффект, взаимодействуя с рецептором. Следовательно, вещества с различной эффективностью для того, чтобы вызвать одинаковый по выраженности эффект, должны оккупировать различное количество рецепторов.
В соответствии с этими представлениями сила эффекта зависит не только от числа занятых рецепторов, но и от величины некоего стимула "S", формирующегося при образовании комплекса "токсикант-рецептор":
ЕА/ЕМ =  (S) = (S) =  (e[RA]/[R]T) = (e[RA]/[R]T) =  (eyA) (10) (eyA) (10)
где е - безразмерная величина, характеризующая эффективность агониста. По Стефенсону - это мера способности токсиканта вызывать эффект, при образовании комплекса с рецептором. Количественно Стефенсон определил е = 1, при условии, что максимальный эффект от действия вещества на биосистему составляет 50% от теоретически возможной ответной реакции этой биосистемы на возбуждающий стимул.
Фурхготт (1964) предположил, что значение "е" прямо зависит от общей концентрации рецепторов в биологической системе [R]Т, и ввел дополнительное понятие "внутренняя эффективность" вещества (  ), величина которой обратно пропорциональна концентрации рецепторов в системе ), величина которой обратно пропорциональна концентрации рецепторов в системе
 = е/[R]Т (11) = е/[R]Т (11)
Как следует из уравнения (10)
ЕА/ЕМ =  ( (  [R]ТуА) (12) [R]ТуА) (12)
Подстановка выражения (6) в уравнение (12) приводит к
ЕА/ЕМ =  (е[А]/([А] + К)) (13) (е[А]/([А] + К)) (13)
Если концентрация готовых к взаимодействию с агонистом рецепторов уменьшается в q раз (при необратимой блокаде рецепторов антагонистом), то реальная эффективность изучаемого вещества становится равной qе, тогда уравнение (13) принимает вид
ЕА*/ЕМ* =  (qe[A*]/([A*] + K)) (14) (qe[A*]/([A*] + K)) (14)
Данная закономерность графически представлена на рисунке 2.
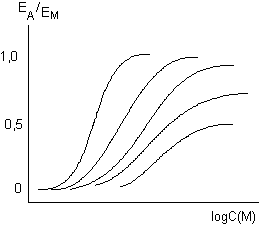
Рисунок 2. Действие гистамина на препарат тонкой кишки морской свинки в условиях возрастающей блокады рецепторов дибенамином (ЕД50 = 0,24мкМ; КА = 10мкМ; е = 21) (R.F. Furchgott, 1966)
Еще одна концепция, позволяющая описать зависимость между действующей концентрацией вещества и выраженностью развивающегося эффекта, предложена Ариенсом (1954). Автор предлагает характеризовать исследуемое вещество величиной, обозначаемой как "внутренняя активность" ( 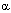 Е) Е)
( 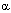 Е) = ЕА.MAX/EM (15) Е) = ЕА.MAX/EM (15)
Поскольку теоретически возможный максимальный эффект можно определить в эксперименте лишь при использовании сильного агониста, обычно значение 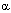 Е для большинства веществ лежит в интервале 0< Е для большинства веществ лежит в интервале 0< 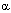 Е <1. Для полного агониста Е <1. Для полного агониста 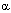 Е = 1, Е = 1, 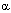 Е антагониста равна 0. Е антагониста равна 0.
Таким образом, максимально возможный биологический эффект может развиться при оккупации токсикантом части рецепторов. В этом случае необратимое связывание некоторого количества рецепторов должно приводить лишь к смещению кривой "доза-эффект" вправо, без снижения величины максимального эффекта. Только при переходе определенной границы связывания рецепторов с антагонистом начинает снижаться и величина максимального эффекта.
Обычно в ходе исследований зависимости "доза-эффект" с позиций оккупационных теорий для характеристики токсикантов определяют следующие параметры:
1. КА - константу ассоциации комплекса "агонист-рецептор" (рКА = -lgКА). Так как значение этой величины часто оценивают непрямым методом (т.е не по количеству образовавшегося комплекса "токсикант-рецептор", а по величине развившегося эффекта при добавлении в среду определенного количества токсиканта) на основании концепции "стимулов", лучше говорить о "кажущейся" константе ассоциации.
2. ЕС50 или ЕД50 - такие концентрации или дозы токсиканта, при действии которых формируется ответная реакция биологического объекта равная по интенсивности 50% от максимально возможной (рД2 = -lgЕД50).
3. КВ - константу диссоциации комплекса "рецептор-антагонист". Сила действия конкурентного антагониста может быть выражена лишь с помощью одного параметра - сродства к рецептору. Этот параметр оценивается при обязательном внесении в инкубационную среду агониста.
2.4.2. Теория "скорости взаимодействия"
Для объяснения данных, выявляемых в процессе изучения зависимости "доза-эффект", которые не могут быть поняты с позиций оккупационной теории, Пэтоном (1961) была предложена теория "скорости взаимодействия".
Пэтон предположил, что выраженность ответной реакции биологической системы на действие вещества определяется не только числом оккупированных им рецепторов, но и скоростью, с которой вещество вступает во взаимодействие с рецептором, а затем отсоединяется от него. Автором было использовано такое сравнение: рецептор, это не клавиша органа, на которую чем дольше нажимаешь, тем дольше извлекаешь звук, но это клавиша фортепиано - здесь звук извлекается в момент удара, а затем, даже если долго держишь клавишу нажатой, звук все равно затухает.
В соответствии с теорией Пэтона, сильные агонисты - это вещества, быстро оккупирующие и быстро покидающие рецептор; антагонисты - это вещества, на долго связывающие рецептор.
2.4.3. Теории конформационных изменений рецептора
Для многих веществ кривая "доза-эффект" существенно отклоняется от гиперболической функциональной зависимости. Коэффициент Хила для этих кривых не равен 1 (см. выше). Как уже указывалось, эти особенности, а также S-образный характер кривых "доза-эффект" иногда может быть объяснен явлением кооперативного взаимодействия рецепторных белков. Показано также, что многочисленные химические модификаторы рецепторов (например дитиотреитол - восстановитель сульфгидрильных групп), необратимые блокаторы холинорецепторов (например 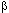 -галогеналкиламины), другие антихолинергические препараты (атропин), конкурентные миорелаксанты, местные анестетики и многие другие вещества, изменяют вид кривой "доза-эффект" для агонистов, превращая её из S-образной в гиперболическую. -галогеналкиламины), другие антихолинергические препараты (атропин), конкурентные миорелаксанты, местные анестетики и многие другие вещества, изменяют вид кривой "доза-эффект" для агонистов, превращая её из S-образной в гиперболическую.
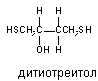
Для объяснения этих и других феноменов, трудно интерпретируемых с позиций оккупационных теорий (сенсибилизация и десенсибилизация рецепторов при действии агонистов), Катцем и Теслефом еще в 1957 году, на примере изучения действия миорелаксантов, была выдвинута циклическая (конформационная) модель взаимодействия токсиканта с рецептором.
В основе модели лежит представление, согласно которому как рецептор [R], так и комплекс "токсикант-рецептор" [RP] могут находиться в активном (RA, RPA) и неактивном состоянии (RI, RPI). Схематически это представлено на рисунке 3.
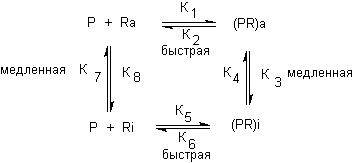
Рисунок 3. Схема взаимодействия токсиканта с рецептором в соответствии с моделью Катца - Теслефа.
Эта модель позволяет объяснить действие на рецептор агонистов и конкурентных антагонистов.
Агонист, например ацетилхолин, взаимодействует с RA, поскольку имеет более высокое сродство к RA, чем к RI , при этом образуется комплекс RPA. Равновесие между RPA и RPI сдвинуто в сторону RPA, так как RI имеет низкое сродство к агонисту, а комплекс RPI диссоциирует с образованием свободного RI. Развитие эффекта формируется на этапе конформационного превращения RPA в RPI. Интенсивность стимула, возникающего в биологической системе, зависит от количества таких превращений в единицу времени. Конкурентные антагонисты, например d-тубокурарин, имеют большее сродство к RA и снижают эффект агониста, выключая часть рецепторов из процесса взаимодействия с последним.
Основываясь на этой модели, практически не возможно экспериментально определить значение соответствующих констант превращений или внутреннюю активность агонистов. Поэтому до настоящего времени в эксперименте по-прежнему широко используют оккупационные модели.
3. Зависимость "доза-эффект" на уровне организма
3.1. Предварительные замечания
Биологическими системами, в отношении которых в токсикологии изучается зависимость "доза-эффект" являются ткани, органы, целостный организм. Чувствительность различных органов и систем организма к токсиканту не одинакова. Вот почему этот этап исследований необходим для развернутой характеристики токсичности исследуемого вещества.
Изучение изолированных органов в искусственных условиях, моделирующих естественную среду, имеют большое значение для выяснения механизмов взаимодействия токсиканта и организма. Описанные выше теории рецепторного действия токсикантов сформулированы, в основном, на основе данных, полученных в опытах именно на изолированных органах. Не удивительно, что и в настоящее время исследования на этих объектах занимают важное место в токсикологии.
3.2. Кривая "доза-эффект"
В общем виде можно предположить, что кривая "доза-эффект" агониста в полулогарифмических координатах (логарифм дозы - выраженность эффекта) принимает S-образную форму не зависимо от целого ряда качественных и количественных особенностей оцениваемой функции. Метод, с помощью которого изучается зависимость, то ли постепенное добавление токсиканта в инкубат, то ли однократное действие вещества на биообъект в возрастающих концентрациях, не оказывают существенного влияния на результат, если эффект не оценивается в абсолютных значениях, а выражается в процентах от максимально возможного (100%). Применение относительных величин целесообразно хотя бы потому, что любой биологический препарат, при самом тщательном приготовлении, уникален во всех своих свойствах, в том числе и по чувствительности к химическим веществам. Кроме того, в ходе эксперимента реакционная способность препарата падает. Эти обстоятельства и предполагают обязательную стандартизацию объекта перед исследованием. Графическое представление кривой "доза-эффект" токсиканта Р в сравнении с кривой для некоего стандартного вещества дает всю необходимую информацию о действии Р, включая его токсикометрические характеристики.
Поскольку непосредственное сравнение кривых, получаемых в ходе эксперимента, осуществлять технически сложно, чаще сравнивают важнейшие параметры кривых.
3.2.1. Среднеэффективная доза (ЕД50)
Основным параметром зависимости "доза-эффект" для определенного токсиканта и биологического объекта является величина среднеэффективной дозы (ЕД50), т.е. такая доза вещества, при действии которой на объект развивается эффект, равный 50% от максимально возможного. При работе на изолированных органах обычно используют величину ЕС50 (среднеэффективная концентрация вещества в пробе). Эффективные дозы обычно измеряют в единицах массы токсиканта на единицу массы биологического объекта (например, мг/кг); эффективные концентрации - в единицах массы токсиканта на единицу объема используемой среды (например, г/литр; М/литр). Вместо величины ЕД50 иногда используют её отрицательный логарифм: -log ED50 = pD2 (таблица 3).
Таблица 3. Величины рД2 для некоторых токсикантов, полученных в эксперименте на изолированном органе (оцениваемый эффект - сокращение мышечных волокон препарата) (J.M. Van Rossumm, 1966)
| Вещество
| Изолированный орган
| рД2
| | ацетилхолин ареколин пилокарпин
| кишка крысы - ,, - - ,, -
| 6,5 6,3 4,8
|
3.2.2. Относительная активность
Другим параметром зависимости "доза-эффект" является относительная активность токсиканта, величина, определяемая как отношение эффекта, вызываемого токсикантом в данной дозе, к максимально возможному эффекту, развивающемуся при действии на биосистему. Это характеристика определяется, как указывалось выше, величиной внутренней активности вещества (  Е). Е).
В узком смысле слова это понятие описывает феномен различия свойств агонистов, с учетом четко очерченных представлений о механизме их токсического действия. Однако в настоящее время его не редко трактуют в расширенном смысле, как показатель сравнения активности веществ, обладающих определенными свойствами, без учета механизмов, посредством которых они инициируют наблюдаемый эффект. На рисунке 4 представлены кривые "доза-эффект" серии веществ, различающихся значением величин  Е и, соответственно, ЕД50, действующих на парасимпатический отдел вегетативной нервной системы. Е и, соответственно, ЕД50, действующих на парасимпатический отдел вегетативной нервной системы.
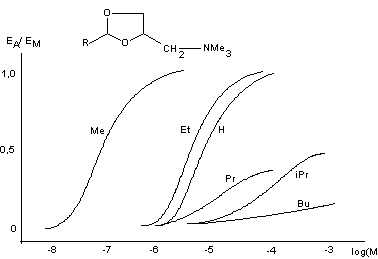
Рисунок 4. Кривые "доза-эффект" серии парасимпатомиметиков (0 <  Е < 1,0), полученные на препарате изолированной тонкой кишки крысы. (J.M. Van Rossumm, 1966) Е < 1,0), полученные на препарате изолированной тонкой кишки крысы. (J.M. Van Rossumm, 1966)
3.3. Биологическая изменчивость
Уже указывалось, что на одном и том же биологическом объекте можно поставить ограниченное количество токсикологических экспериментов (в простейших случаях - ввести животному дозу вещества; добавить в инкубационную среду, содержащую изолированный орган, вещество в возрастающей концентрации и т.д.). Поиск зависимости "доза-эффект" для одного, и тем более, нескольких токсикантов требует постановки множества экспериментов, что предполагает использование большого количества биологических объектов. В этой связи исследователь сталкивается с явлением биологической изменчивости. Даже при тщательном отборе встречаются объекты, как чрезвычайно чувствительные, так и малочувствительные к действию химических веществ, что приводит к известной вариабельности получаемых результатов. Необходимо иметь в виду, что способ учета этого феномена в ходе анализа экспериментальных данных часто оказывает влияние на итоговые значения изучаемых характеристик токсикантов.
В основе учета феномена биологической изменчивости лежит метод усреднения полученных данных. При установлении величины ЕД50, оказывается безразличным проведено ли усреднение доз, вызывающих одинаковый эффект на нескольких биообъектах, либо значений эффектов, полученных при действии определенных доз токсиканта (рисунок 5). Если же поставлена задача получить результирующую кривую "доза-эффект", то усреднению подлежат только дозы, вызывающие со стороны биообъекта эффекты определенной выраженности. При ином подходе (усреднение эффектов) наблюдается существенное снижение крутизны итоговой кривой "доза-эффект" в сравнении исходными данными.
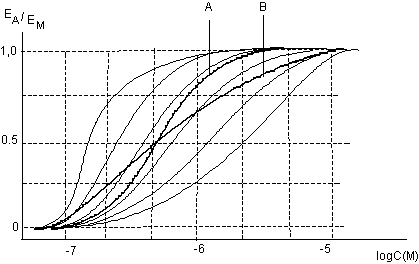
Рисунок 5. Построение усредненной кривой доза-эффект с использованием данных, полученных на нескольких биопрепаратах с различной чувствительностью к исследуемому токсиканту. Использование метода усреднения доз, вызывающих одинаковые эффекты (А) дает правильный результат. Метод усреднения эффектов (В) приводит к "уплощенной" результирующей кривой.
3.4. Совместное действие нескольких токсикантов на биообъект
При совместном действии на биообъект агонистов и антагонистов возможны различные модификации зависимости "доза-эффект" (не связанные с различного рода химическими и физико-химическими взаимодействиями ксенобиотиков). Наиболее часто регистрируются такие изменения как:
- параллельный сдвиг кривой "доза-эффект";
- снижение максимальных значений кривой "доза-эффект";
- параллельный сдвиг с одновременным снижением максимальных значений.
В настоящее время для объяснения наблюдаемых эффектов наиболее часто применяют представления оккупационной теории взаимодействия "токсикант-рецептор".
3.4.1. Параллельный сдвиг кривой "доза-эффект"
Главное и наиболее часто используемое объяснение параллельного сдвига кривой "доза-эффект" для вещества (А) при одновременном действии на биопрепарат (внесение в инкубационную среду) вещества (В) с внутренней активностью  Е = 0, базируется на допущении, что (В) является конкурентным антагонистом (А). Е = 0, базируется на допущении, что (В) является конкурентным антагонистом (А).
При сравнении на основе оккупационной теории равноэффективных концентраций агониста в отсутствии ([А]) и при добавлении антагониста ([А*]) в определенной концентрации [В], имеем
[А*]/[А] = 1 + [В]/КВ (16)
Поскольку координаты, в которых регистрируются эффекты, и наблюдается параллельный сдвиг, полулогарифмические, при логарифмировании обеих частей уравнения (16) имеем
log[A*] - log[A] = log(1 + [B]/KB) = S (17)
или
-logKB = log([A*]/[A] - 1) - log[B] (18)
Из уравнения (17) видно, что величина сдвига кривой (S) зависит только от концентрации [В] и величины константы диссоциации комплекса антагонист-рецептор КВ (рисунок 6). Соотношение между величиной стимула, вызываемого агонистом, и эффектом со стороны биосистемы не играет никакой роли. Часто для характеристики сродства антагониста к рецептору используют величину рА2 = -logКВ.
Из уравнений (16) и (17) следует, что рА2 численно равна отрицательному десятичному логарифму концентрации конкурентного антагониста, при которой необходимо удвоить содержание в среде агониста чтобы получить эффект, регистрируемый в отсутствии антагониста.
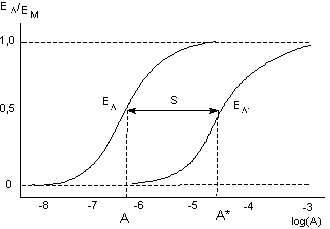
Рисунок 6. Теоретические кривые доза-эффект для агониста при отсутствии (А) и наличии (А*) в инкубационной среде антагониста в определенной концентрации [В]. В приведенном примере сдвиг S равен 1,3 и определяется как S = log[A*] - log[A]. Исходя из того, что S = log(1 + [B]/KD), КВ может быть определено экспериментально.
3.4.2. Снижение максимальных значений кривой "доза-эффект"
В ряде случаев при изучении зависимости "доза-эффект" для агониста (А*) в присутствии антагониста выявляется, что максимальный наблюдаемый эффект существенно слабее, чем наблюдавшийся от действия того же вещества в отсутствии антагониста (А). Это снижение максимального эффекта, которое может быть оценено в процентах, с позиции оккупационной теории трактуется следующим образом.
Неконкурентный антагонист (В*) реагирует с рецептором (R*) биосистемы, не являющимся рецептором R для агониста (А), при этом образование комплекса [R*B*] приводит к понижению эффективности комплекса [RA] понижается. Это приводит к некоему кажущемуся снижению внутренней активности 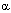 Е агониста, зависящему от [В*]. Е агониста, зависящему от [В*].
Снижение максимальных значений кривой "доза-эффект" может быть объяснено и необратимым ингибированием рецептора для агониста конкурентным антагонистом (В).
Для количественной характеристики активности неконкурентного антагониста используют величину отрицательного логарифма константы диссоциации комплекса антагонист-рецептор
-logKB* = pD*2
Для расчета этой величины необходимо экспериментально определить максимально возможное снижение эффекта агониста в присутствии насыщающей концентрации антагониста (ЕАВ*М). Тогда
pD*2 = -log[B*] - log[(ЕАВ*М - ЕА)/(ЕАВ* - ЕА) - 1] (21)
С учетом (21) рD2 можно рассматривать как отрицательный логарифм концентрации неконкурентного антагониста, при которой эффект агониста снижается на половину максимально достижимого уровня. В этом случае (ЕАВ*М - ЕА)/(ЕАВ* - ЕА) = 2. Обычно для упрощения расчетов вместо эффекта ЕА используют максимальные эффекты, развивающиеся при действии А в разных условиях: ЕАМ, ЕАМВ, ЕАМВМ.
Если с помощью неконкурентного антагониста возможно полностью заблокировать эффект агониста, то величину рD*2 можно рассчитать по более простой формуле
pD*2 = -log[B*] + log(EA/EAB* -1) (22)
3.4.3. Параллельный сдвиг с одновременным снижением максимальных значений
На практике чрезвычайно редко приходится сталкиваться с веществами (антагонистами), вызывающими либо только параллельный сдвиг, либо только снижение максимальных значений кривой "доза-эффект" для агониста. Как правило, выявляются оба эффекта. В этой связи становиться понятным, что деление многих ксенобиотиков на группы конкурентных и неконкурентных антагонистов ряда рецепторов носит во многом механистический характер. Тем не менее и в данном случае имеется необходимость количественной характеристики действия вещества.
рD2 рассчитывается в соответствии с уравнением (22), в которое вместо значений эффектов ЕА и ЕАВ подставляют значения ЕАМ и ЕАМВ (рисунок 7).
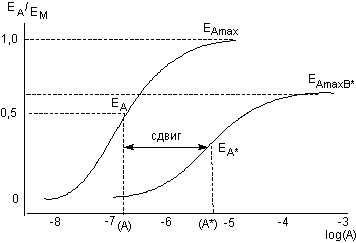
Рисунок 7. Теоретические кривые зависимости относительной эффективности агониста [А] от его концентрации в присутствии в инкубационной среде антагониста [В]. Для расчета величины рД2 следует использовать отношение условно равноэффективных доз [А] и [А*], после определения соответствующих ЕАМ и ЕАМВ*. Расчет осуществляется в соответствии с уравнением (23), после подтверждения факта, что неконкурентный антагонист является полным.
3.5. Определение кажущихся констант диссоциации комплекса "агонист-рецептор"
В то время, как прямая связь между значениями величин рА2 и рD*2 антагонистов с одной стороны и констант диссоциации комплекса антагонист-рецептор с другой признается хотя бы теоретически, связь между рD2 и КА агониста таковой, в строгом смысле не является, поскольку между этапом образования комплекса "агонист-рецептор" и этапом формирования эффекта лежит цепь промежуточных звеньев биохимических и физиологических реакций, как правило далеко не изученных (см. выше). Из этого следует, что непосредственно определить сродство токсиканта к рецептору (т.е. величину константы диссоциации комплекса "токсикант-рецептор") исходя из зависимости "доза-эффект", выстраиваемой в процессе эксперимента, не возможно. Для преодоления этой сложности предлагается определять величину кажущейся константы диссоциации. Классическим является метод с использованием необратимого конкурентного антагониста.
В 1956 году Nickerson установил, что алкилирующие соединения типа 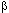 -галогеналкиламинов, например дибенамин и феноксибензамин, могут вступать в необратимое взаимодействие с рецепторами различных типов. Связываются рецепторы к ацетилхолину, гистамину, серотонину, -галогеналкиламинов, например дибенамин и феноксибензамин, могут вступать в необратимое взаимодействие с рецепторами различных типов. Связываются рецепторы к ацетилхолину, гистамину, серотонину, 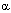 -адренорецепторам. Изучая совместное взаимодействие ингибиторов и агонистов с биопрепаратами, удалось: -адренорецепторам. Изучая совместное взаимодействие ингибиторов и агонистов с биопрепаратами, удалось:
- установить специфический характер действия галогеналкиламинов на агонист-связывающую область рецепторов;
- уточнить классификацию рецепторов в соответствии с их сродством к эндогенным агонистам.
Furchgott предложил метод, основанный на сравнении эквиэффективных доз агониста, действующего на интактный биопрепарат и препарат, обработанный предварительно ингибитором рецепторов (уменьшение [R]T на величину q[R]T).
Эффект, связанный с действием агониста до блокады рецепторов описывается уравнением (13), после блокады - уравнением (14). Одинаковый по выраженности эффект в этих условиях развивается при одинаковой величине стимула S. Если S = S*, то ЕА/ЕМ = ЕА*/ЕМ*, и тогда, комбинируя уравнения 13 и 14, получаем
1/[A] = 1/q 1/[A] + (1-q)/qKA (23)
Выстраивая зависимость в координатах 1/[А] и 1/[А*] получаем прямую с углом наклона 1/q и отрезок на оси 1/[А], равный (1-q)/qKA. Для практического определения КА можно использовать выражение
KA = (наклон - 1)/отрезок
Процесс подготовки данных представлен на рисунке 8:
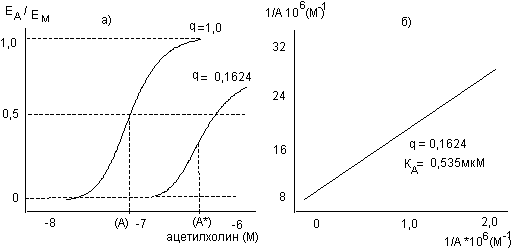
Рисунок 8. Определение величины кажущейся константы диссоциации агонистов на мускариночувствительный рецептор продольной мышцы тонкой кишки морской свинки.
а). Кривая зависимости доза-эффект ацетилхолина для интактного препарата (q = 1), и препарата, обработанного в течение 20 минут фенокисбензамином (5мкМ) (q = 0,1624).
б). Построение графика соотношения равноэффективных доз для интактного и обработанного препарата в координатах 1/[А] и 1/[А*] приводит к прямой, на основе которой (а также уравнения 23) можно вычислить значения константы диссоциации.
4. Зависимость "доза-эффект" в группе
4.1. Зависимость "доза-эффект" для одного токсиканта
При изучении зависимости "доза-эффект" в группе, состоящей из большого количества особей, можно исходить из представлений, развитых при изучении зависимости на уровне отдельного организма. Дополнительным фактором, влияющим на получаемый результат, является индивидуальная изменчивость.
Однако хотя реакция отдельных людей или животных в группе на токсикант не одинакова, по мере увеличения действующей дозы тем не менее будет увеличиваться и выраженность эффекта и количество индивидов (особей), у которых развивается оцениваемый эффект. Например, если на кожу испытуемых апплицировать вещество, вызывающее раздражение (ирритант), то по мере увеличения количества наносимого токсиканта будут отмечаться: - увеличение числа испытуемых, у которых разовьется реакция раздражения; - увеличится выраженность явления раздражения у испытуемых. Из этого следует, что получаемые в ходе работы величины должны определяться с учетом статистических закономерностей.
При изучении действия токсиканта на организм следует различать эффекты, выраженность которых градуально зависит от действующей дозы (например, понижение артериального давления) и эффекты типа "все или ничего" (пал/выжил). При этом следует учитывать, что эффекты первого типа можно практически всегда преобразовать в форму, пригодную для оценки эффектов второго типа. Для определения зависимости "доза-эффект" в группе обычно прибегают к двум типам построения эксперимента:
- с образованием подгрупп исследуемых животных;
- без образования подгрупп.
4.1.1. Анализ зависимости "доза-эффект" методом формирования подгрупп
|



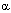 -меланотропин -
-меланотропин - 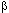 -эндорфин
- тиреотропин - глицил-глутамин
-эндорфин
- тиреотропин - глицил-глутамин

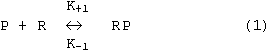
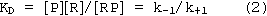

 (S) =
(S) =  ), величина которой обратно пропорциональна концентрации рецепторов в системе
), величина которой обратно пропорциональна концентрации рецепторов в системе