Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
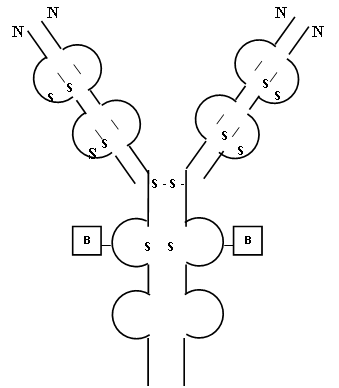
Молекулярна структура антитіл та їх активні центриІмуноглобуліни утворені як найменш чотирма поліпептидними ланцюгами, що з’єднуються між собою дисульфідними містками. У молекулі імуноглобулінів є дві пари ланцюгів. Кожна пара у свою чергу складається з легкого – L-ланцюга (Light chain) та важкого – Н-ланцюга (Heavy chain). За допомогою імунохімічних дослідів було встановлено, що існує 5 класів Н-ланцюгів, які позначаються відповідно γ, μ, α, δ, ε. Н-ланцюги визначають належність імуноглобулінів до певного класу: IgG, IgM, IgA, IgD, IgE. Кожний з перелічених класів має характерні фізико-хімічні властивості та біологічну активність. Розглянемо будову імуноглобуліну на прикладі IgG. IgG містить два Н-ланцюгу та два L-ланцюгу (50-70 кД та 22-25 кД відповідно), які поєднані у чотириланцюгову молекулу за рахунок ковалентних дисульфідних зв’язків. Кожен ланцюг містить варіабельну V (VH та VL) та константну С (консервативну) ділянки. V-ділянка починається на N-кінці поліпептидного ланцюга та тягнеться приблизно до 110-го амінокислотного залишку як в легких, так і у важких ланцюгах. Константна ділянка приєднується до варіабельної і тягнеться до карбоксильного кінця поліпептиду. L-ланцюг складається з 211-221 амінокислотних залишків, тому V- та С-ділянки мають приблизно однакову довжину. Важкі ланцюги містять 3 (у IgG, IgA) або 4 (у IgM та IgЕ) константних домени: СН1, СН2, СН3, СН4, які на 30% мають ідентичну послідовність амінокислот. Різниця між ланцюгами імуноглобулінів різних класів визначається складом амінокислот константних ділянок Н-ланцюгів.
Рис. 1. Структура імуноглобуліну G
Рис. 2. Схема доменної укладки імуноглобуліна Примітка: у кожному домені частина поліпептидного ланцюга, довжиною у 60 амінокислот, стягується у петлю дисульфідними (-S-S-) зв’язками. 
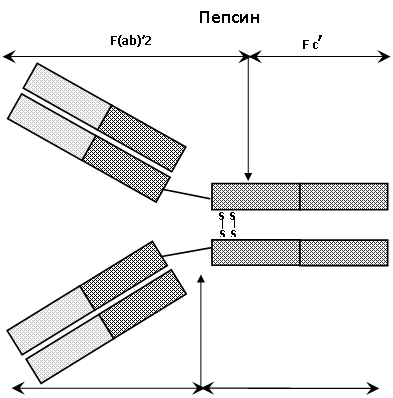
С-ділянки (кожна приблизно зі 110 амінокислотних залишків) називаються ділянками гомології чи доменами. Приблизно половина (близько 60) амінокислотних залишків в такому домені являють собою петлю, яка стягнута внутрішньоланцюговим дисульфідним зв’язком, а по 20-25 амінокислотних залишків з кожного боку слугують для зв‘язку з іншим доменом. У різних класах імуноглобулінів положення цих дисульфідних зв’язків виявляється відносно стабільним і не залежить від класу, тоді як положення інших внутрішньо- та міжланцюгових дисульфідних зв’язків досить непостійне. Домени утворюються не тільки в С-ділянках, але й у V-ділянках. У важкому ланцюгу – чотири домени (перший – у V-ділянці, інші три – у С-ділянці), а в деяких антитілах – 5 доменів (у IgМ та IgE). А в легких ланцюгах 2 домени (один – у V-ділянці, один – в С-ділянці). Цікаво те, що два домени легких ланцюгів розташовані чітко напроти двох доменів важких ланцюгів. Відповідно до припущення Дж. Еделмана петлі компактно згорнуті та формують глобулярні домени з характерною β-складчастою структурою. За конфігурацією мономерна молекула антитіла нагадує літеру “Y”. У місці розгалуження молекули імуноглобуліну – талії – знаходиться шарнірна ділянка з 15-60 амінокислотних залишків (hinge region), що відрізняється високим вмістом проліну та поліцистіну, достатньою рухливістю, довжиною та доступністю для протеолітичних ферментів. Папаїн розщеплює молекулу антитіла на два однакових Fab-фрагменти (Fragment antigen binding), кожний з яких має один антигензв’язуючий центр, та Fc-фрагмент (Fragment crystallizable), що нездатний зв’язувати антиген. Пепсин розщеплює молекулу в іншому місці, відокремлюючи Fc´-фрагмент від більшого F(ab)´2-фрагмента, який являє собою вкорочене антитіло; він, як і вихідне антитіло, бівалентний щодо зв’язування антигену. Локалізація антигензв’язуючих центрів та бівалентність імуноглобулінів встановлена за допомогою оригінального експерименту. Антитіла обробляли синтетичною речовиною, молекули якої містили дві динітрофенільні групи, що мали підвищену спорідненість до антигензв‘язуючих центрів.
Рис. 3. Розщеплення молекули імуноглобуліна під впливом протеолітичних ферментів
У результаті проведеного електронного мікроскопіювання із застосуванням негативного контрастування було виявлено декілька правильних геометричних фігур: тримери, тетрамери та пентамери. Це дало змогу встановити, що в антитілах центри зв’язку з антигенами активні центри (паратопи) знаходяться у сфері варіабельних ділянок L- та Н-ланцюгів, зокрема в щілині між ними. У цих ділянках має місце найбільша варіабельність амінокислотної послідовності. У кожному ланцюгу в межах варіабельного домена формуються 3-4 петлі, внутришні згини яких представлені гіперваріабельними ділянками CDR (complementary determining regions) або HV (hypervariable). Якраз вони й утримують в щілині активного центру антигенну детермінанту (епітоп) за рахунок електростатичних та інших зв’язків. HV-ділянки містять високу кількість залишків гліцину, що забезпечує активним центрам антитіл достатню гнучкість. Між гіперваріабельними ділянками розташовані каркасні ділянки – FR (framework regions).
Рис. 4. Будова активного центру антитіла (паратопа) та його взаємодія з епітопом антигену Пояснення: HV – гіперваріабельні ділянки активного центру; FR – каркасні ділянки; епітоп антигену входить у щілину активного центру та специфічно взаємодіє з ним за рахунок нековалентних зв’язків.
Вивчалася здатність окремих L- та H-ланцюгів зв’язуватися з антигеном. У більшості випадків залишкова антигензв’язуюча активність зберігалася у важкого ланцюга і меншою мірою – у легкого. Очевидно, специфічність до антигену забезпечується Н-ланцюгом, а “тонку настройку” здійснює L-ланцюг. Раніше взаємодія антигенів і антитіл вважалася подібною до взаємодії “фермент-субстрат” і визначалася за моделлю “ключ до замка”. За сучасними уявленнями ця взаємодія більш мобільна і відповідає механізму “наведеної відповідності”. Так, кожний антигензв’язуючий центр за участю різних гіперваріабельних ділянок здатний утворювати комплекси з різними антигенними детермінантами, але з різною афінністю. Комплементарність антигену і антитіла забезпечується великою кількістю нековалентних зв’язків, які виникають між епітопом антигену та пептидними ланцюгами паратопа антитіла. В результаті утворюється комплекс “антиген-антитіло”, який дуже мало здатний до дисоціації. Рівновага в системі “антиген-антитіло” сильно зсунута праворуч:
Різноманітність активних центрів імуноглобулінів збільшується не тільки за рахунок гіперваріабельних ділянок, але й завдяки наявності 2 ізотипів легких ланцюгів (λ та χ), які можуть поєднуватися з різними варіантами Н-ланцюгів. Згідно з функціональною активністю розрізняють повноцінні антитіла, які мають звичайну структуру і два активних паратопи, а також неповноцінні антитіла, або неповні. Неповні антитіла називають ще моновалентними, чи блокуючими. У них є один активний паратоп, а другий може бути малоактивним, замаскованим чи просто відсутнім. Вони з’єднуються з антигеном, лише блокуючи його, але не можуть агрегувати антигенні частки у великі конгломерати. Для виявлення неповних антитіл використовується блокуюча проба Кумбса, (наприклад, при виявленні антитіл проти Rh-ізоантигенів еритроцитів). Постановка цієї проби включає два етапи: 1) приєднання неповного антитіла до резус-антигену, в результаті чого моновалентні антитіла лише покривають поверхню еритроцитів, не викликаючи їх злипання; 2) до отриманої системи додають кролячу сироватку проти даних неповних антитіл, внаслідок чого повноцінні кролячі антитіла зв'язують комплекс антигена з неповним антитілом і відбувається гемаглютинація. У ролі блокуючих факторів можуть виступати Fab-фрагменти антитіл, окремі H- і L-ланцюги і білки Бенс-Джонса, які являють собою димери легких ланцюгів. Поява антитіл в сироватці крові відбувається частіше за все як відповідь на введення антигену в організм, але в деяких випадках вони зיявляються в крові без попередньої антигенної стимуляції. До таких антитіл належать «нормальні» антитіла, які присутні в природних умовах у сироватці в невеликій кількості незалежно від антигенної стимуляції. До них відносять антитіла на ізоантигени груп крові, а також імуноглобуліни проти антигенних детермінант нормальної мікрофлори, деякі представники якої мають споріднені антигени з патогенними мікроорганізмами.
Рис. 5. Технологія одержання моноклональних антитіл за допомогою гібридомної технології
У 1974 – 1975 р.р. Г. Келлер і У. Мільштейн розробили метод отримання гібридом шляхом злиття нормального В-лімфоцита і мієломної пухлинної клітини. Такі гібриди успадковують від мієломної клітини здатність до необмеженого ділення, а від лімфоцита – здатність до синтезу антитіл. Усі клітини клонованої гібридоми виробляють однакові антитіла і за специфічністю активного центра і за ізотипом важкого ланцюга. Такі імуноглобуліни називають моноклональними антитілами, оскільки вони є продуктом одного клона клітин. Моноклональні антитіла (МКА) широко використовують у різних галузях науки і практики: у діагностиці інфекційних і спадкових хвороб; для лікування раку (наприклад, для доставки цитотоксичних ліків у місце локалізації пухлини); в наукових дослідженнях МКА застосовують як ліганди при афінній хроматографії тощо. На рис. 4.5 наведено схему отримання моноклональних антитіл за гібридомною технологією. Тварин (мишей або щурів) імунізують антигеном (у даному випадку з двома епітопами “а” і “б”). Коли продукція антитіл (анти-а і анти-б) досягне максимального рівня, з селезінки або лімфовузла імунізованої тварини відбирають клітини і зливають їх з мієломними В-клітинами у присутності поліетиленгліколю. Поліетиленгліколь сприяє злиттю клітинних мембран. Отримані гібридомні клітини ідентифікують за їх здатністю рости на середовищах з ГАТ (гіпоксантином, аміноптерином і тимідином), на що не здатні клітини мієломи. У даному випадку утворюється два клони гібридних клітин, кожний з яких синтезує МАК (моноклональні антитіла) проти відповідного антигену.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 308. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |