
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Материальный и энергетический балансы отделения (цеха) на часовую производительностьМатериальный баланс представляет собой вещественное выражение закона сохранения массы применительно к ХТП: масса веществ, поступивших на технологическую операцию (приход), равна массе веществ, полученных в этой операции (расход): ∑Мприход = ∑Мрасход (1) Рассчитываем первую реакцию 2CH3OH+3O2=2CO2+4H2O 2CH3OH - 64кг/моль 3O2 - 96кг/моль 2CO2 - 88кг/моль 4H2O - 72кг/моль Найдём количество метанола вступившего в реакцию. Общее количество метанола-126,3 кг/ч 0,95-степень окисления метанола 126,3•0,95=119,985 кг/ч (2) количество метанола, не вступившего в реакцию 126,3-119,885=6,315 кг/ч (3) Кислород, необходимый для реакции. O2 = (119,985/64) •96=179,977 кг/ч (4) Количество веществ, образующихся в ходе реакции CO2= (119,985/64) •88= 164,979 кг/ч (5) H2O = (119,985/64) •72= 134,983 кг/ч (6) 50.52 КГ/Ч Приход второй реакции (CH2)6N4+9O2=6CO2+6H2O+2N2 (CH2)6N4 - 140КГ/КМОЛЬ 9O2 - 288КГ/КМОЛЬ 6CO2 - 264КГ/КМОЛЬ 6H2O - 108КГ/КМОЛЬ 2N2 - 56КГ/КМОЛЬ Уротропин вступает в реакцию полностью. Кислород необходимый для реакции: О2=(50,52•288)/140=103,926кг/ч (7) СО2=50,52х264/140=95,266кг/ч (8) Н2О=(50,52х108)/140=38,972кг/ч (9) N2=(50.52•56)/140=20.208кг/ч (10) 49,509КГ/Ч СН2О+О2=СО2+Н2О СН2О - 30КГ/КМОЛЬ О2 - 32КГ/КМОЛЬ  СО2 - 44КГ/КМОЛЬ Н2О - 18КГ/КМОЛЬ Общее количество формальдегида вступившего в реакцию 0,98-степень окисления формальдегида 50,52•0,98=49,509 кг/ч (11) количество формальдегида, не вступившего в реакцию 50,52-49,509=1,011 кг/ч (12) Кислород необходимый для реакции О2=(49,509•32)/30=52,809 кг/ч (13) Количество веществ, образующихся в ходе реакции СО2=(49,509•44)/30=72,613 кг/ч (14) Н2О=(49,509•18)/30=29,705 кг/ч (15) Общее количество О2. пошедшее на весь процесс 179,977+103,926+52,809=336,712 кг/ч (16) 336,712/32•22,4=235,698 м3 (17) Количество азота содержащегося в воздухе при найденном количестве кислорода: О2-21% в воздухе 235,698-21% N2-79% в воздухе ХN2-79% N2=235,698•79/21=886,674 м3/ч (18) 886,674/22,4•28=1108,342 кг/ч (19) Общая масса воздуха: 1108,342+336,712=1445,054 кг/ч (20) Составим таблицу 8 материального баланса. Таблица 8 Материальный баланс
Чтобы перейти к расходным коэффициентам по сырью, нужно решить пропорцию на 1 тонну продукта (синтез газ). Расходные коэффициенты по сырью: На 3,971054 т продукта нужно 0,1263 метанола, 0,05052 формальдегида и уротропина, 2,298608 воды и 1,445054 воздуха, а на 1 т дымового газа Х, X1 , Х2 и Х3 тонны соответственно, т.е: Х=0,032 тонны метанола, х1 , 0,013 тонн формальдегида и уротропина, Х2=0,578 тонн воды, Х3=0,3638 тонн воздуха. Рассчитаем тепловой баланс УТОПС. Тепловой баланс составляют по аппаратам или стадиям производства для определения расхода охлаждающей воды, греющего пара или температуры системы в конце процесса. Если в результате протекания химических реакций образуется тепло или избыточное давление, следует предусмотреть использование этих вторичных энергоресурсов. В таблице 9 приведены термодинамические свойства веществ. Таблица 9 – Термодинамические свойства веществ
2CН3ОН+3О2=2СО2+4Н2О ∆Н0 298=∑∆Н.ПРОД.-∑∆Н.ИСХ=(2•(-393,51)+4•(-285,83))-2•(-238,57)=-1453,2кДж/моль (21) QХРI=119.985/64•1453.2=2724.4 кДж (22) Q-это ∆Н с обратным знаком, т.е Q=-∆Н. (CН2)6N4+9O2=6CO2+6H2O+2N2 ∆H0 298=(6•(-393.51)+6•(-285.83))-31.09=4044.95 кДж/моль (23) QХРII=50,52/140•(-4044,95)=-1459,6кДж (24) CН2О+О2=СО2+Н2О ∆Н0 298=((-393,51)+(-285,83))-(-115,90)=-563,44кДж/моль (25) QХРIII=49.509/30•563,44=929,8кДж (26) Учёт фазовых переходов воды, содержащейся в стоках: ∆Н (Н2ОГ)-∆Н (Н2ОЖ)=-241,81+285,83=44,02кДж/моль (27) Количество тепла, необходимого для испарения: Q=-∆Н или ∆Н =-Q QXP=2293,608/18•(-44,02)=-5609,1кДж (28) Количество теплоты, вносимое с промстоками: Q=T•(GCH3OH•CCH3OH+GCH2O•CCH2O+GУР•СУР+GH2O•CH2O) (29) Т=40*С=313К (30) С=СР/Мr=Дж/кгК (31) В таблице 10 указанны показатели теплового баланса. Таблица 10 Тепловой баланс
QПРОМСТ.=313*(126,3*2,55+2293,608*4,18+50,52*1,36+50,52++*1,17)=10037,161кДж (32) Количество теплоты вносимое с воздухом: Т=200*С=473 К (33) Q=T*(GO2*CO2+GN2*CN2)=473*(336,712*0,91+1108,342*1,040)=39832,571кДж (34) Количество тепла, уносимое дымовыми газами: Q=T*(GCO2*CCO2+GH2O*CH2O+GN2*CN2+GCH3OH*CCH3OH+GCH2O*CCH2O) T=900*C=1173K QДЫМ=1173*(332,858*0,84+2497,268*1,86+1128,55*1,04+6,315*2,55+1,011*1,17)=7173476,655 кДж Составим уравнение теплового баланса: QПРИХ=QРАСХ QПРОМСТ+QВОЗД+Q1+QIII=QДЫМ+QII+QIV+QПОТЕРЬ QПОТЕРЬ принимаем 5% от прихода. QПРИХ=10037,161+39832,571+2724,4+929,8=412020,932 кДж QПОТЕРЬ=412020,932*5/100=20601,466 кДж QРАСХ=7173476,655+(-1459,6)+44,02+20601,466=7201146,821 кДж Найдём дефицит теплоты: ∆QПОДВОДА=QРАСХ-QПРИХ=7201146,821-412020,932=6789125,889 кДж Подвод теплоты в зону реакции осуществляют путём сжигания природного газа, по уравнению реакции: СН4+2О2=СО2+2Н2О+890950 кДж/кмоль Найдём необходимое количество газа для сжигания: 6789125,889/890950=7,62 кмоль Найдём объём газа: 7,62*22,4=170,69 м3 Сведём данные теплового баланса в таблицу 9. Чтобы перейти к расходным коэффициентам по энергии, нужно решить пропорцию на 1 тонну продукта (промстоки). Расходные коэффициенты по энергии: На 3,971054 тонны продукта нужно 7201146,821 КДж тепла, а на 1 тонну дымовых газов Х тонн, т.е: Х=7201146,821/3,971054=1813409,4 КДж тепла В таблице 11 приведены полученные данные. Таблица 11 - Сводный тепловой баланс
2.2 Расчет основного аппарата. Выявление резервов увеличения производительности аппарата и интенсификации процесса. Рассчитаем циклонную печь поз.7/1-3. Циклонная печь предназначена для обезвреживания огневым методом промышленных сточных вод, содержащих органические и минеральные примеси. В качестве топлива используется природный газ. Производительность по сточным водам-2800 кг/ч. Расход природного газа-830 нм3/ч Давление природного газа-1500 нм3/ч Расход воздуха-8970 нм3/ч Давление воздуха перед горелкой-0,007МПа Расход промышленной очищенной воды на охлаждение 55 м3/ч Температура дымовых газов 1000*С Количество дымовых газов 13150 нм3/ч Масса -26980 кг Циклонная печь поз.7/1-3 представляет собой вертикальный цилиндрический аппарат Д=2400мм, Н=7015мм, футерованный внутри огнеупорным кирпичом, с четырьмя горелками и восемью форсунками для распыления промстоков. При температуре (800–1000)0С и коэффициенте избытка воздуха a=1,1 происходит полное выгорание органики, содержащейся в промстоках, до углекислого газа и воды, а вода, находящаяся в стоках, испаряется и перегревается до температуры 10000С. Циклонная печь состоит из керамической головки, футерованной огнеупорным и теплоизоляционным кирпичом, вертикальной охлаждаемой цилиндрической камерой. В головке печи устанавливаются тангенциально газовые горелки предварительного смешения ГПС 1 конструкции ОКБ «ЭТХИМ» и сопла вторичного дутья. В верхней части охлаждаемой цилиндрической камеры расположены механические форсунки для распыливания сточных вод. Внутренняя цилиндрическая часть охлаждаемой камеры футеруется по шипам обмазкой ПХМ-6. Цилиндрическая часть печи охлаждается промышленной очищенной водой. Температура воды на выходе из рубашки 40-70*С. Процесс обезвреживания сточных вод происходит в высокотемпературной зоне Т=950*С. Минеральные примеси улавливаются в цилиндрической камере и в виде жидкого сплава выводятся через пережим в газоход-копильник. В настоящее время химические процессы очень часто протекают при высоких температурах и давлениях, поэтому для предупреждения аварий и взрывов наряду с технологическим расчётом аппаратов обязательно производится расчёт их на прочность. Расчет процесса горения. Определим низшую теплоту сгорания топлива Qрн. Если топливо представляет собой индивидуальный углеводород, то теплота сгорания его Qрнравна стандартной теплоте сгорания за вычетом теплоты испарения воды, находящейся в продуктах сгорания. Для топлива, состоящего из смеси углеводородов, теплота сгорания определяется по формуле:
Qpiн - теплота сгорания i-гo компонента топлива; Qрнсм = 35,84*0,987 + 63,80*0,0033+ 91,32*0,0012+ 118,73*0,0004 + 146,10 = 35,75 Молярную масса топлива: Mm = ΣMi*yi, где (25) Mi - молярная масса i-гo компонента топлива Mm= 16,042 х 0,987 + 30,07 х 0,0033+58,120*0,0004+44,010х0,001 +28,01 х 0,007 = 16,25 кг/моль.
тогда Qрнсм, выраженная в МДж/кг, равна:
Результаты расчета сводим в таблицу 12. Таблица 12 - Состав топлива
Определим элементарный состав топлива, % (масс.): Содержание углерода
Содержание водорода
Содержание кислорода
Содержание азота
niC, niH, niN , niO - число атомов углерода, водорода, азота и кислорода в молекулах отдельных компонентов, входящих в состав топлива;
xi- содержание каждого компонента топлива, мол. %; Mi- молярная масса отдельных компонентов топлива; Мm - молярная масса топлива.
Проверка состава: C + H + O + N = 74,0 + 24,6 + 0,2 + 1,2 = 100 % (масс.). Определим теоретическое количество воздуха, необходимое для сжигания 1 кг топлива, оно определяется из стехиометрического уравнения реакции горения и содержания кислорода в атмосферном воздухе. Если известен элементарный состав топлива, теоретическое количество воздуха L0, кг/кг, вычисляется по формуле:
На практике для обеспечения полноты сгорания топлива в топку вводят избыточное количество воздуха, найдем действительный расход воздуха при α = 1,25: L = αL0, , где (32) L - действительный расход воздуха; α - коэффициент избытка воздуха, L = 1,25*17,0 = 21,25 кг/кг. Удельный объем воздуха (н. у.) для горения 1 кг топлива:
ρв = 1,293 –плотность воздуха при нормальных условиях,
Найдем количество продуктов сгорания, образующихся при сжигании 1 кг топлива: Если известен элементарный состав топлива, то массовый состав дымовых газов в расчете на 1 кг топлива при полном его сгорании может быть определен на основании следующих уравнений:
mCO2, mH2O, mN2, mO2 - масса соответствующих газов, кг.
Суммарное количество продуктов горения: mп. с = 2,71 + 2,21 + 16,33 + 1,00 = 22,25 кг/кг. Проверяем полученную величину:
Wф - удельный расход форсуночного пара при сжигании жидкого топлива, кг/кг (для газового топлива Wф = 0),
Найдем объем продуктов сгорания при нормальных условиях, образовавшихся при сгорании 1 кг топлива:
mi—масса соответствующего газа, образующегося при сгорании 1 кг топлива; ρi - плотность данного газа при нормальных условиях, кг/м3; Мi- молярная масса данного газа, кг/кмоль; 22,4 - молярный объем, м3/кмоль,
Найдем теплоемкость и энтальпию продуктов сгорания 1 кг топлива в интервале температур от 100 °С (373 К) до 1500 °С (1773 К), используя данные таблице 13. Таблица 13 - Средние удельные теплоемкости газов
Энтальпия дымовых газов, образующихся при сгорании 1 кг топлива:
сCO2, сH2O, сN2, сО2 - средние удельные теплоемкости при постоянном давлении соответствующих газон при температуре t, кДж/(кг ·К); сt - средняя теплоемкость дымовых газов, образующихся при сгорании 1 кг топлива при температуре t, кДж/(кг К);
При 200°С: Так считаем на все значения температур. Результаты расчетов сводим в таблицу 14. Таблица 14 - Энтальпия продуктов сгорания
Расчет полезного коэффициента. При определении величины КПД синтезированной системы (ηту) используется традиционный подход. Расчет КПД установки осуществляется по формуле:
Полученные показатели эффективности работы циклонной печи соответствуют ее размерам Д=2400мм, Н=7015мм. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-11; просмотров: 225. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 где (24)
где (24) (26)
(26)
 МДж/кг.
МДж/кг. (27)
(27)
 (28)
(28)
 (29)
(29)
 , где (30)
, где (30) - содержание каждого компонента топлива, масс. %;
- содержание каждого компонента топлива, масс. %;
 (31)
(31) где (33)
где (33) м3/кг.
м3/кг.
 кг/кг;
кг/кг; , где (34)
, где (34) кг/кг,
кг/кг, где (35)
где (35) кг/кг.
кг/кг.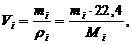 где (36)
где (36) м3/кг;
м3/кг;  м3/кг;
м3/кг; м3/кг;
м3/кг;  м3/кг.
м3/кг. где (37)
где (37) кДж/кг;
кДж/кг;

