Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Критерии компенсации сахарного диабетаСтр 1 из 4Следующая ⇒ МЕТОДИЧКА ДЛЯ СТУДЕНТОВ Тема: Сахарный диабет. Методы определения содержания глюкозы. Ранняя диагностика сахарного диабета: определение антител к β-клеткам поджелудочной железы, проинсулина, С-пептида. Компенсация сахарного диабета. Эффективный контроль гипергликемии: определение гликозилированного гемоглобина, фруктозамина. Оценка степени сосудистого риска: HbA1C, глюкоза плазмы венозной крови натощак, глюкоза капиллярной крови перед едой, постпрандиальная гипергликемия, показатели липидного спектра. Гипогликемическая кома. Цель занятия:изучить основные методы определения содержания глюкозы, маркеры ранней диагностики сахарного диабета, уметь выявлять маркеры сосудистого риска. Знать: - методы определения содержания глюкозы; - основные маркеры ранней диагностики сахарного диабета ; - гликозилированный гемоглобин и фруктозамин – как эффективный котроль гипергликемии; - оценку сосудистого риска при сахарном диабете; - понятие о гипогликемической коме. Уметь: - интерпретировать полученные результаты содержания гликозилированного гемоглобина; - оценивать показатели липидного спектра. Сахарный диабет (СД) - хронический метаболический синдром, характеризующийся гипергликемией, глюкозурией и связанными с ними нарушениями обмена веществ. Развивается вследствие абсолютной или относительной (нарушение взаимодействия с клетками-мишенями) недостаточности гормона инсулина и приводит к нарушению углеводного, жирового и белкового обмена. Методы определения содержания глюкозы. Определение концентрации глюкозы в крови – одно из наиболее часто выполняемых биохимических исследований в клинико-диагностической лаборатории. Причина исключительной популярности теста связана с высокой заболеваемостью сахарным диабетом. Данный тест выполняется как в условиях стационара, так и в поликлиниках. Больные сахарным диабетом вынуждены исследовать уровень глюкозы в крови в домашних условиях, поскольку без этой информации им трудно скорректировать свою диету, физические нагрузки, применение инсулина и других сахароснижающих препаратов. Исключительная важность теста и большие объемы выполняемых исследований стимулировали разработчиков к созданию различных типов приборов и методов определения концентрации глюкозы в крови.  В настоящее время существует достаточно много методов определения глюкозы. Их можно классифицировать следующим образом: 1. Редуктометрические. Почти не используются 2. Колориметрические. Почти не используются 3. Ферментативные: а) глюкозооксидазный - фотометрический по конечной точке - фотометрический кинетический - отражательная фотометрия – сухая химия - электрохимический б) гексокиназный. Первые два метода крайне неудобны, токсичны и обладают низкой точностью, поэтому мы на них не будем останавливаться.
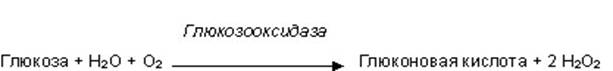
Глюкозооксидазный метод Сегодня наибольшее распространение получили методы, основанные на использовании фермента – глюкозооксидазы. В основе метода лежит следующая реакция:
Глюкозооксидаза катализирует перенос двух водородных атомов с первого углеродного атома глюкозы на кислород, растворенный в жидком реагенте. При этом в ходе реакции образуется в эквимолярных количествах перекись водорода. Т.е. концентрация образовавшейся перекиси водорода точно равна определяемой концентрации глюкозы. Следовательно, использование глюкозооксидазной реакции, трансформировало задачу определения концентрации глюкозы в задачу определения концентрации перекиси водорода, которая, как будет показано ниже, значительно проще первой. И здесь есть несколько способов, широко используемых сегодня в лабораторной практике (см. схему). Среди вышеперечисленных способов регистрации наибольшее распространение получил фотометрический биохимический метод, в котором молекулы перекиси водорода под действием фермента пероксидазы расщепляются с образованием активной формы кислорода – супероксид анион-радикала – О2-, который в свою очередь окисляет хромоген, что приводит к значительному изменению спектра поглощения хромогена.
Большая популярность данного метода определения глюкозы объясняется его высокой специфичностью и простотой выполнения. Метод можно реализовать как с применением обычного фотометра, так и с помощью автоматических биохимических автоанализаторов. Глюкозооксидазный метод признан сегодня одним из самых точных количественных методов определения глюкозы. В качестве биологического материала используется как сыворотка крови, так и цельная кровь. При работе с последней следует учитывать тот факт, что при взятии капиллярной крови доля сыворотки (плазмы) зависит от величины гематокрита, что может негативно отразиться на точности результата. Поэтому при определении глюкозы вышеописанным методом предпочтительно использовать сыворотку крови пациента. Наряду с методом фотометрирования по конечной точке, несколько лет назад появились наборы, в которых реализован кинетический метод фотометрирования. Суть метода состоит в том, что при определенном соотношении активностей глюкозооксидазы и пероксидазы, скорость образования окрашенного соединения некоторое время после внесения пробы в рабочий раствор будет пропорциональна концентрации глюкозы в пробе. Преимущество такого метода состоит в том, что результат не зависит от наличия в пробе других соединений, поскольку поглощение последних стабильно во времени. Этот метод требует применения кинетического фотометра, полуавтоматических анализаторов или автоматических биохимических анализаторов. Измерение концентрации глюкозы из цельной крови удобно выполнять с помощью приборов, работа которых основана на амперометрическом принципе измерения, при помощи специальных ферментных датчиков. Перекись водорода является крайне нестабильным химическим соединением, и она может служить источником заряженных частиц. Именно это и используется в ферментных датчиках мембранного типа или электрохимических элементах портативных глюкометров. В заключении следует упомянуть и о недостатках глюкозооксидазного метода. Образующаяся перекись водорода и супероксид анион-радикал могут окислять не только хромоген, но и другие вещества, присутствующие в биологической жидкости: аскорбиновую кислоту, мочевую кислоту, билирубин. При этом, соответственно, доля перекиси, принимающая участие в окислении хромогена, снижается, что приводит к занижению результата по глюкозе. Этот метод линеен, как правило, до 20-30 ммоль/л глюкозы.
Гексокиназный метод Гексокиназный метод состоит из двух последовательных реакций, но совершенно других:
Регистрация осуществляется при длине волны 340 нм по светопоглощению НАДН. Этот метод является высокоспецифичным и не дает реакции с другими компонентами сыворотки крови. Гексокиназный метод считается референтным для определения глюкозы. Как правило, он линеен до 50 ммоль/л, что позволило его широко рекомендовать для клиник с эндокринологическими отделениями.
Ранняя диагностика сахарного диабета: определение антител к β-клеткам поджелудочной железы, проинсулина, С-пептида Антитела к бета-клеткам поджелудочной железы (антитела к клеткам островков Лангерганса, ICA)- маркер аутоиммунного поражения бета-клеток поджелудочной железы, продуцирующих инсулин. Основные показания к применению: диагностика сахарного диабета первого типа, оценка риска развития сахарного диабета первого типа у лиц с отягощенной наследственностью по сахарному диабету. Данный вид аутоантител (антител, образующихся в организме к собственным антигенам, белкам и другим веществам организма) вырабатывается к антигенам островковых клеток поджелудочной железы, секретирующих инсулин. Тест, фактически, указывает на процесс поражения (разрушения) островковых клеток. Характерной особенностью данной группы антител является их раннее появление в сыворотке крови, за несколько лет, до развития клинической формы сахарного диабета. Эти антитела появляются у больных до клинического развития сахарного диабета после перенесенных инфекционных заболеваний, вызванных вирусом Коксаки В4, эпидемическим паротитом и другими вирусами. Определение содержания данных аутоантител можно использовать для выявления степени риска развития инсулинозависимого сахарного диабета. Маркером аутоиммунной деструкции бета-клеток поджелудочной железы представляют аутоантитела к островковым клеткам - ICA. Они представляют собой антитела к антигенам, которые находятся в цитоплазме клеток островков Лангерганса. Они могут определяться в сыворотке крови здоровых лиц (0,5%), у лиц без диабета, но являющихся родственниками больных сахарным диабетом первого типа (2-6%) и обнаруживаются у пациентов с сахарным диабетом в 70-80% случаев. Обнаружена закономерность: чем моложе пациент с выявленными антителами ICA и выше их титр, тем выше вероятность развития сахарного диабета первого типа. Антитела обнаруживаются не только у пациентов с диабетом, но и у родственников больных, чаще у тех, кто имеет идентичные гены системы HLA. Следует учитывать, что антитела к антигенам островков поджелудочной железы не являются специфичными только к антигенам бета-клеток, хотя и имеется небольшая перекрестная реакция между ними. Особенностью антител к антигенам островков является уменьшение их содержания по мере увеличения срока от начала развития диабета первого типа. В первые месяцы от манифестации заболевания они обнаруживаются у 70-90% лиц, через 1-2 года только у 20%. Через 15-20 лет цитоплазматические антитела (ICA) можно обнаружить лишь у 5% больных. С-пептид- показатель синтеза инсулина и обмена углеводов. Основные показания к применению: диагностика диабета I и II типов, инсулинома, оценка секреции инсулина при заболеваниях печени, оценка инсулинотерапии. С-пептид представляет собой белковую часть молекулы проинсулина, образующегося в процессе синтеза инсулина. В ответ на увеличение содержания глюкозы проинсулин расщепляется на инсулин и С-пептид, секретируясь в кровь в эквимолярных количествах. Образование С-пептида происходит следующим образом. Проинсулин представлен одной большой полипептидной цепью, содержащей 84 аминокислотных остатка, он лишен биологической (гормональной) активности. Местом синтеза проинсулина считается фракция микросом бета-клеток панкреатических островков, превращение неактивного проинсулина в активный инсулин происходит при перемещении проинсулина от рибосом к секреторным гранулам путем частичного протеолиза (отщепление с С-конца полипептидной цепи пептида, содержащего 33 аминокислотных остатка и получившего наименование соединяющего, или С-пептида). Длина и первичная структура С-пептида подвержена большим изменениям у разных видов животных, чем последовательность цепей А и В инсулина. Хотя С- пептид не обладает биологической активностью, но он отражает скорость образования инсулина. Однако периоды полужизни инсулина и С-пептида в крови различны, тем не менее, наблюдается выраженная корреляция между их наличием в крови при не совпадении концентраций в сыворотке. Соотношение С-пептид к инсулину обычно составляет 5 : 1. Определение содержания С-пептида позволяет определять содержание собственного инсулина при инсулинотерапии, поскольку препараты инсулина, применяющиеся при лечении, не содержат С-пептид. Проинсулин– предшественник инсулина, синтезирующийся бета-клетками островков Лангерганса поджелудочной железы. Основные показания к применению: клинические признаки инсулиномы, выяснение причин гиперинсулинизма. 3-10% проинсулина поступает в кровоток, остальная часть превращается в инсулин путем отщепления С-пептида. Инсулин и С-пептид поступают в кровь в эквимолярных количествах. Проинсулин практически не обладает метаболической активностью инсулина (сахароснижающей активностью). Его активность более чем в 10 раз меньше активности инсулина, но значительное повышение его концентрации может привести к гипогликемии. Проинсулин является основным маркером для диагностики опухолей бета-клеток поджелудочной железы (инсулином). Его определение может иметь важное значение в дифференциальной диагностики состояний, связанных с гиперинсулинемией. Критерии компенсации сахарного диабета
Критериями компенсации сахарного диабета в настоящее время считаются: хорошее состояние, стабильное течение болезни (суточная нормогликемия и аглюкозурия) и нормальное содержание гликированного гемоглобина. Хорошей компенсацией ИЗСД (инсулинзависимого сахарного диабета) считается: аглюкозурия, уровень гликемии натощак 4,4-6,7 ммоль/л, после еды - не более 8,9 ммоль/л, в 3 ч ночи - более 3,1 ммоль/л, глиекогемоглобин - менее 8,5%, отсутствие как явных, так и скрытых гипогликемии. Уровень гликемии натощак более 7,8 ммоль/л, после еды - более 10 ммоль/л, стойкая глюкозурия более 0,5%, повышенное содержание гликированного гемоглобина должно расцениваться как неудовлетворительная компенсация углеводного обмена. У больных с подобными показателями быстрее развиваются осложнения сахарного диабета, которые находятся в прямой зависимости от степени его компенсации. В результате десятилетнего наблюдения за развитием осложнений у больных ИЗСД, проведенного в США, установлено, что, если в течение длительного времени с помощью интенсифицированной инсулинотерапии поддерживать нормогликемию или близкое к ней состояние, то риск поражений сосудов глаз снижается на 76%, почек - на 35-36%, нервов - на 60%.
Критерии компенсации углеводного обмена при сахарном диабете 2 типа:
Объективным долгосрочным показателем степени компенсации сахарного диабета является гликозилированный (гликированный) гемоглобин (или гликогемоглобин, или НвА1с-тест, где Нв - гемоглобин, Alc - присоединенная глюкоза). Гемоглобин и другие белки соединяются с глюкозой в ходе медленной неферментативной реакции, зависящей от концентрации глюкозы. Чем больше глюкозы содержится в крови, тем больше гликозилированного гемоглобина накапливается в эритроцитах. Тест определения гликозилированного гемоглобина отражает средний уровень содержания глюкозы в крови за период жизни эритроцитов за последние 2-3 мес, в течение которых происходит взаимодействие гемоглобина и глюкозы. |
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 241. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |