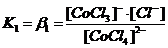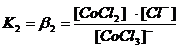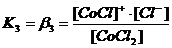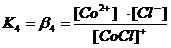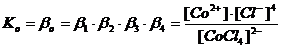Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Диссоциация комплексных соединений. В растворах комплексные соединения с внешнесферными ионами практически нацело (как сильные электролиты) диссоциированы по схеме, например: K2[CoCl4] → 2K++[CoCl4]2- [Cu (NH3)4] SO4→[Cu (NH3)4]2++SO42-. Диссоциация с распадом комплексных соединений на внутреннюю и внешнюю сферу называется первичной диссоциацией. Комплексные ионы, а также нейтральные комплексы тоже могут диссоциировать в растворе. Например: [CoCl4]2- ↔ Co2++4Cl- [Cu (NH3)4]2+ ↔ Cu2+ + 4NH3 [Pt(NH3)2Cl2]0 ↔ Pt2+ + 2NH3 + 2Cl- Диссоциация комплексных частиц незначительна (слабые электролиты). Распад в растворе внутренней сферы комплексного соединения на ион-комплексообразователь и лиганды называется вторичной диссоциацией. Такая диссоциация протекает ступенчато: лиганды удаляются из внутренней сферы постепенно, один за другим (точнее, происходит реакция замещения лиганда на молекулы растворителя - воды). [CoCl4]2- ↔ [CoCl3]-+ Cl- [CoCl3]- ↔ [CoCl2]0 + Cl- [CoCl2]0 ↔ [CoCl]+ + Cl- [CoCl]+ ↔ Co2+ + Cl- Как и для всякого обратимого процесса равновесие каждой ступени диссоциации комплексов (или обмена лигандов на молекулы растворителя) характеризуется ступенчатой константой нестойкости комплекса.
Общие (суммарные) константы нестойкости комплексов характеризуют их полную диссоциацию на комплексообразователь и лиганды и равны произведению ступенчатых констант: [CoCl4]2- ↔ Co2+ + 4Cl-
Ступенчатую диссоциацию можно проиллюстрировать примером распада комплексного иона [HgCl4]2 на Hg2+ (как комплексообразователя) и ионы Cl- (как лиганда): [HgCl4]2- ↔ [HgCl3]- + Cl-; K1(нест.) = 0,10 [HgCl3]- ↔ [HgCl2] + Cl-; K2(нест.) = 0,07 [HgCl2] ↔ [HgCl]+ + Cl-; K3(нест.) = 0,31 . 10-7 [HgCl]+ ↔ Hg2+ + Cl-; K4(нест.) = 0,54 . 10-5  [HgCl4]2- ↔ Hg2+ + 4Cl-; Kо(нест.) = K1(нест.) ∙ K2(нест.) ∙ K3(нест.) ∙ K4(нест.) = 1,17 ∙ 10-15 |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 236. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |