Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Вопрос 3. Строение коллоидных частиц.
Согласно общепринятой мицеллярной теории строения коллоидных растворов, золь состоит из двух частей мицелл и интермицеллярной жидкости. Мицелла — это структурная коллоидная единица. Интермицеллярнойжидкостью называют дисперсную среду, разделяющую мицеллы.
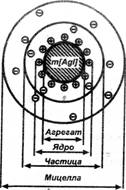
Рис. 3. Строение мицеллы золя иодида серебра.
В центре мицеллы (рис. 3) находится кристаллическое тело, названное Песковымагрегатом.На нем, согласно правилу Панетта—Фаянса, адсорбируются ионы, способные достраивать его кристаллическую решетку. Эти ионы сообщают агрегату электрический заряд и называются потенциалоопределяющими.В результате образуется ядромицеллы, несущее электрический заряд. Ядро создает вокруг себя электрическое поле, под действием которого к нему из раствора притягиваются противоионы,образующие вокруг ядра диффузный слойи частично входящие в состав адсорбционного слоя.Ядро совместно с адсорбционным слоем противоионов называется коллоидной частицей. Строение мицеллы удобно представлять в виде формулы. Для золя АgI формула мицеллы пишется так, если стабилизатором будет AgNO3:
{ m [ АgI ] n Аg+ ( n - x) NO3- } x NO3- ↓ ↓ ↓ ↓ агрегат ядро частица мицелла
m — число молекул n — число потенциалопределяющих ионов, Ag+ — часть из них входит в адсорбционный, часть в диффузный слой,
Если стабилизатором будет КI, то формула мицеллы запишется так:
{m[AgI]nI(n-х)K+}хК+
Для гидрозоля Fе(ОН)3, где стабилизатором является FеСI3 формула мицеллы имеет вид:
{ [ mFе(ОН)3 ] nFe33+( n - х ) СI- } 3 х СI- 
Примером золя, у которого, стабилизатор образуется при взаимодействии вещества дисперсной фазы с дисперсной средой, может быть гидрозоль SiO2. На поверхности золя возможна реакция с образованием метакремниевой кислоты:
SiO2 + Н2O = Н2SiO3?
которая служит стабилизатором золя,
{ m[ SiO2 ] n НSiO3- (n - х ) Н+} х Н+
Вопрос 4. Свойства золей. Электрокинетические явления.
В 1809 году профессор Московского университета Ф. Ф. Рейс описал неизвестные ранее явления, положившие начало изучению электрических свойств дисперсных систем. Если в слой сырой глины погрузить на близком расстоянии две стеклянные трубки с водой, в которые насыпан песок, исполняющий роль пористого тела, погрузить инертные электроды и создать разность потенциалов, то уровень жидкости в трубке с положительным электродомпонизится, а жидкость помутнеет, В трубке с отрицательным электродом жидкость не мутнеет и уровень ее повысится. Таким образом, при наличии разности потенциалов дисперсная фаза и дисперсионная среда двигаются в противоположных направлениях. Электрофорез— перемещение частиц дисперсной фазы в электрическом поле. Электроосмос— перемещение дисперсионной среды в электрическом поле,
Электрофорез используют при обезвоживании нефти, при очистке газообразных отходов производства (электрофильтры), при изготовлении гуммированных покрытий и резиновых изделий из латекса, в медицине для введения в организм лекарств в коллоидном состоянии.Электроосмос используется при опреснении воды, при очистке лекарств, дублении кожи.
Оптические свойства коллоидных систем.
По своим оптическим свойствам коллоидные растворы отличаются от истинных и грубодисперсных систем. В грубодисперсных системах размер частиц больше длины волны видимого света. Поэтому световые лучи, проходящие через грубодисперсную систему, не могут обойти частицы суспензии или эмульсии, они отражают и преломляются на границе частиц со средой, обусловливая их мутность, видимую невооруженным глазом, В истинных растворах светорассеяние ничтожно, так как размер частиц дисперсной фазы очень мал и нет препятствий для прохождения лучей. Наиболее характерным оптическим свойством коллоидных растворов является опалесценция (светорассеяние). Частицы коллоидной дисперсности меньше длины полуволны света, и поэтому рассеяние света обусловлено неотражением света от поверхности частиц, а его дифракцией. Рассеяние света было исследовано Тиндалем, который обнаружил, что при освещении коллоидного раствора световым пучком его путь при наблюдении сбоку виден в виде светящегося конуса — конуса Тиндаля. Подобное явление наблюдается при прохождении луча в темном задымленном помещении (например, во время показа кино), при свете автомобильных фар в туманную погоду и в других случаях. Для интенсивности рассеянного света Релеем в 1871 году была выведена зависимость: Iр= 24π3 I0 (n12 - n22)2 ΰ V2 / (n12+ 2n22) λ4 где Iр — интенсивность рассеянного света, I0 — интенсивность падающего света, n1 и n2 — показатели преломления дисперсной фазы и дисперсной среды, ΰ — концентрация, V — объем одной частицы, λ — длина световой волны.
Из этого уравнения видно, что интенсивность рассеянного света обратно пропорциональна 4-й степени длины волны. Если падающий свет полихроматичен, то рассеянный свет должен быть богаче короткими волнами, т. е. при боковом освещении коллоиды имеют синеватую окраску, а в проходящем красную. На интенсивности рассеяния лучей коротковолновой части спектра основано применение ламп синего цвета для светомаскировки и красного для сигналов опасности. Красный свет виден на большое расстояние из-за малого светорассеяния. По той же причине противотуманные фары имеют оранжевую окраску. На явлении светорассеяния основан метод определения концентрации и степени дисперсности коллоидныхсистем — нефелометрия. Если взять два золя, в которых будут разными только концентрации, а все остальные величины будут одинаковы, то при освещении золя пучком света одинаковой интенсивности получим:
I1 / I2 = C1 /С2 где I1 и I2 — интенсивности рассеяния светарастворами 1 и 2, С1и С2 — концентрации этих растворов, Отсюда, зная концентрацию одного из золей, можно, определить концентрацию второго. Аналогично можно определить степень дисперсности, если для одного' золя, являющегося эталоном, радиус частиц определен.Метод химического анализа, основанный на измерении интенсивности рассеянного света, называется нефелометрией.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 295. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |