Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Вопрос 2. Очистка и концентрирование дисперсных систем.Стр 1 из 6Следующая ⇒ Лекция №12 Тема: «Коллоидная химия. Дисперсные системы». Цель: Рассмотреть понятие о дисперсных системах, классификацию дисперсных систем по агрегатному состоянию. Продолжительность: 2 часа План:
1. Общая характеристика дисперсных систем. 2. Классификация дисперсных систем.
Вопрос 1. Общая характеристика дисперсных систем.
Дисперсные системы — системы, состоящие из множества малых частиц, распределенных в жидкой, твердой или газообразной среде. К дисперсным системам относят также капиллярно-пористые материалы (почвы, горные породы, спрессованные порошки, поглотители, катализаторы и т. д.). Понятие «дисперсный» происходит от латинского — раздробленный, рассеянный. Дисперсная фаза—измельченное вещество. Дисперсионная среда—вещество, в котором распределена дисперсная фаза. Степень раздробленности вещества дисперсной фазы называют степенью дисперсности. Степень дисперсности математически определяют как величину, обратную размеру частицы: D= 1/а где D — степень дисперсности, а — размер частицы (диаметр или длина ребра). То есть, чем меньше размер частиц, тем больше дисперсность.
Для всех дисперсных систем характерны два основных признака: 1.Высокая дисперсность. 2.Гетерогенность. Эти признаки полностью определяют свойства и поведение дисперсных систем. Вопрос 2. Классификация дисперсных систем. I. Классификация по размеру частиц: По степени дисперсности системы распределяют на типы. 1. Грубодисперсные с радиусом частиц 10-4-10-7м. 2. Коллоидно-дисперсные (золи) с размером частиц 10-7-10-9 м.  3. Молекулярные или ионные растворы с размером частиц менее 10-9 м.
1. Грубодисперсные системы. Если дисперсная фаза состоит из твердых частиц, то система называется взвесью, или суспензией. Например, взмученная глина в воде. Если дисперсная фаза представлена капельками жидкости, то её называют эмульсией, например, капли масла в воде, молоко. Эти системы неустойчивы. 2. Коллоидные системы. Частицы коллоидных систем значительно больше молекул (ионов), из которых состоит дисперсная среда, что приводит к наличию поверхности раздела между частицами и средой. Коллоидные частицы не видны в обычный микроскоп, но наблюдаются в ультрамикроскопе и в электронном микроскопе. Коллоиды относительно устойчивы, но со временем они разрушаются. При получении коллоидных систем затрачивается внешняя энергия. 3. Молекулярные или ионные растворы (истинные растворы), В истинных растворах частицы достигают пре-дисперсности. Эти растворы устойчивы, не разрушаются и получаются самопроизвольно.
II. Классификация по агрегатному состоянию фаз: Каждая из фаз может быть в трех агрегатных состояниях: газообразном, жидком, твердом. Поэтому возможно существование 8 типов дисперсных систем. Система «газ в газе» не входит в это число, так как является гомогенной (см. табл.). Таблица
Системы с газовой дисперсионной средой независимо от природы газа называют аэрозолями. Системы с жидкой дисперсионной средой — лиозоли. В зависимости от природы жидкости лиозоли делят на гидрозоли (д/свода) и органозоли (д/с — органическая жидкость), которые подразделяют на алкозоли, бензоли, этерозоли и т. д. Дисперсной средой в них являются соответственно спирт, эфир и т. д.
III. Классификация по межфазному взаимодействию
В зависимости от силы межмолекулярного взаимодействия между веществами дисперсной фазы и дисперсной среды дисперсные системы могут быть лиофобными и лиофильными. Лиофильный (греч.) — любящий растворение, лиофобный (греч.) —- боящийся растворения. Для лиофобных систем характерно слабое взаимодействие вещества дисперсной фазы со средой. Такие системы термодинамически неустойчивы и требуют специальных методов стабилизации. К ним относится большинство дисперсных систем — лиозоли, аэрозоли, пены, Лиофильные золи отличаются сильным взаимодействием веществ фазы и среды с образованием сольватных (гидратных) оболочек молекул дисперсной среды. Эти системы термодинамически устойчивы. Мыла, некоторые глины самопроизвольно образуют коллоидные растворы в воде.
Вопросыдля самопроверки:
1. Что называется дисперсной системой, дисперсной фазой, дисперсионной средой? 2. Какие процессы характерны для дисперсных систем? 3. Как связать дисперсность с размером частиц? 4. Что такое удельная поверхность, и как она меняется с увеличением дисперсности? 5. Чем объясняется термодинамическая неустойчивость дисперсных систем? 6. Какие дисперсные системы относятся к коллоидным? 7. Может ли существовать золь этилового спирта в водной среде? 8. Чем отличается лиофобные системы от лиофильных?
Лекция №13 Тема: «Коллоидные растворы (золи) ».
Цель:Изучить методы получения коллоидных систем, свойства коллоидных растворов (золей) на основе строения их частиц (мицелл). Рассмотреть практическое применение коллоидно-химических свойств и явлений в современных методах и технологиях. Продолжительность: 2 часа План: 1. Методы получения коллоидных систем. 2. Очистка и концентрирование дисперсных систем. 3. Строение коллоидных частиц. 4. Свойства золей: 4.1. Электрокинетические явления. 4.2. Оптические свойства коллоидных систем. 4.3. Агрегативная и седиментационная устойчивость золей.
Вопрос 1.Методы получения коллоидных систем. Коллоидные растворы по степени дисперсности занимают промежуточное положение между истинными растворами и грубодисперсными системами. Поэтому все методы получения коллоидных систем можно разбить на двеосновные группы: 1) Диспергирование — дробление крупных частиц доколлоидной дисперсности; 2) Конденсация — соединение атомов, ионов или молекул в более крупные частицы (агрегаты) коллоидных размеров. К общим условиям получения коллоидных систем независимо от применяемых методов относятся следующие: 1) Нерастворимость вещества дисперсной фазы в дисперсной среде; 2) Достижение коллоидной дисперсности частиц дисперсной фазы; 3) Наличие третьего компонента — стабилизатора. При соблюдении всех условий синтеза коллоидных систем любое вещество можно получить в коллоидном состоянии. Например, хлорид натрия в бензоле можно получить в коллоидном состоянии, так как он не растворяется в бензоле, а серу — в воде. Методы диспергирования Воснове этих методов лежит раздробление твердых тел до частиц коллоидного размера. Процесс раздробления можно осуществить: механическим дроблением, электрическим дроблением и действием ультразвука. Для получения коллоидов механическим дроблением производится растирание и дробление твердых тел в специальных машинах — коллоидных мельницах(рис.1). Частицы вещества, подлежащего диспергированию, в предварительно измельченном виде смешиваются с соответствующей жидкостью, содержащей стабилизирующие добавки, и в виде взвеси в этой жидкости подаются через загрузочное отверстие 1 (см. рис. 1). Действием быстро вращающегося вала с насаженными на нем лопастями 2 жидкость с распределенным в ней диспергируемым веществом приводится в быстрое вращение, в результате чего частицы вещества разбиваются о них на еще более мелкие частицы. Насаженные на вал выступы 3 при вращении проходят очень близко от последних, не задевая их. Готовый высоко дисперсный продукт удаляется через выход 4. Диспергирование твердых тел в жидкой среде всегда более эффективно, чем «сухое» дробление, так как жидкости, смачивающие твердое тело, способствуют снижению его прочности.
Рис. 1. Схема коллоидной мельницы Первая коллоидная мельница была сконструирована русским инженером К. Плауссоном (1920). Метод электрического диспергирования основан на образовании вольтовой дуги между электродами из распыляемого металла, помещенными в охлаждаемую воду. При температуре вольтовой дуги металлы испаряются, а пары конденсируются в холодной жидкости. Этот метод применяют для получения коллоидных растворов золота, серебра, платины и других металлов. Колебания воздуха с большой частотой (105...106 Гц) называется ультразвуковыми волнами, которые образуется благодаря применению пьезоэлектрических осцилляторов. При этом взвесь грубодисперсного вещества дробятся. Этим методом можно получить растворы смол,графита, металлов, крахмала и других веществ, Также условно к методам диспергирования относят пептизации. Он заключается в том, что к рыхлому свежеприготовленному осадку диспергируемого вещества прибавляют раствор электролита (стабилизатора), под действием которого частицы осадка отделяются друг от друга и переходят во взвешенное состояние, образуя золь. В принципе процесс дробления в этом методе не осуществляется, так как частицы осадка уже должны иметь коллоидную дисперсность, а прибавленный электролит — стабилизатор — только придает системе агрегатную устойчивость. Таким методом, например, можно получить красно-коричневый гидрозоль гидроксида железа. Методы конденсации Методы конденсации основаны на создании условий, при которых будущая дисперсная среда пересыщается веществом будущей дисперсной фазы. В зависимости от способов создания этих условий конденсационные методы подразделяют на физические и химические. К физическим методам относятся: - конденсация пара в газовой фазе, в результате чего образуются аэрозоли — дым, туман. Например, образование атмосферного тумана за счет конденсации влаги воздуха в результате его охлаждения, получение маскировочного дыма при охлаждении паров Р2О5; - конденсация паров при пропускании их через холодную жидкость, в результате чего образуютсялиозоли - золь ртути в воде, золи благородных металлов; - замена растворителя, в результате чего растворенное вещество, оказавшись в иной среде, конденсируется, образуя частицы дисперсной фазы лиозоля,например, помутнение одеколона и духов при действии на них воды, Химические методы основаны на использовании реакций, в результате которых образуются малорастворимые или нерастворимые соединения. Например, образование гидрозоля иодида серебра AgNО3 + КI = KNО3 + AgI или гидрозоля серы ЗNа2S2О3 + Н2SО4 = Nа2SО4 + Н2O +4S
В результате протекания подобных реакций в условиях малой концентрации реагирующих веществ вместо ожидаемого осадка образуется дисперсная фаза. Такие явления часто вызывают затруднения в аналитической практике.
Вопрос 2. Очистка и концентрирование дисперсных систем.
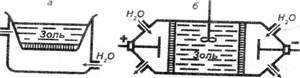
Для очистки дисперсных систем от растворенных в них веществ Т. Грэм (англ.) предложил воспользоваться способностью мелкопористых пленок (мембран) задерживать частички дисперсной фазы и свободно пропускать ионы и молекулы. Этот способ был назван диализом. Диализ — процесс очистки коллоидных растворов, основанный на свойстве полупроницаемой мембраны пропускать примеси ионов и молекул малых размеров и задерживать коллоидные частицы.
Рис. 2. Схема диализатора (а) и электродиализатора (б)
Прибор для очистки коллоидов называется диализатором (рис. 2). Очищаемую дисперсную систему помещают в сосуд, изготовленный из мелкопористого материала или обладающий мелкопористым дном; сосуд омывается проточной дистиллированной водой. Согласно законам диффузии, ионы и молекулы растворенного вещества, составляющего примесь, проникают через мелкопористый .материал в дистиллированную воду, а частицы дисперсной фазы остаются в дисперсной системе. Скорость диализа мала, но ее можно значительно увеличить, воспользовавшись действием электрического поля на ионы растворенной примеси. Такой метод очистки называют электродиализом. Электродиализатор — это сосуд, разделенный мембранами на три отсека, из которых средний содержит очищаемую систему, а в крайних размещены электроды и циркулирует жидкость, однородная с веществом дисперсной среды очищаемой системы. В этих условиях при большой разности потенциалов дисперсная система быстро очищается от электролита. В настоящее время диализ используют во многих производствах, например, при обработке многих продуктов питания и при вымачивании соленого мяса, рыбы. Электролиз применяется для очистки пищевого желатина, клея, красителей, целлюлозы и других веществ. Особенно эффективен он в медицине. Например, на принципе электродиализа основано действие аппарата «искусственная почка», позволяющая очищать кровь больного от вредных продуктов жизнедеятельности. Этим методом удаляют соли из молочной сыворотки, при этом повышается содержание в ней лактозы и белков. Такая сыворотка используется в диетическом питании. Используя мелкопористые материалы, дисперсные системы можно концентрировать, «продавливая» дисперсную среду вместе с растворенными в ней веществами через ультрафильтры (полимерные пленки с размером пор 10 -6 -10 -5 см). Этот метод называется ультрафильтрация. Ультрафильтрация — процесс отделения дисперсной фазы от дисперсионной среды путем фильтрования коллоидных растворов через полупроницаемые мембраны. Ультрафильтрация в пищевой промышленности широко применяется для концентрирования белковых, крахмальных растворов. В производстве таких продуктов, как молоко, молочная сыворотка. Ультрафильтрационные мембраны отличаются от мелкопористых материалов тем, что каждая пора открывается в сторону низкого давления и любая малая частица проходит через мембрану, тогда как крупные остаются на ее поверхности. Для отделения дисперсной фазы в золях широко используют центрифуги. Методом центрифугирования производится сепарация молока, отделение мелкокристаллических осадков.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 685. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||