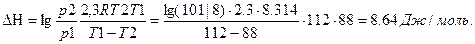Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Расчет константы равновесия и состава равновесной смеси с использованием термодинамических функций. ⇐ ПредыдущаяСтр 2 из 2 Расчёт состоит из следующих этапов: 1) расчёт константы равновесия в стандартных условиях; 2) пересчёт значений константы равновесия к заданным условиям; 3) определение равновесных концентраций веществ. 1. На первом этапе в методе расчёта, основанном на использовании стандартных термодинамических величин, применяют два исходных уравнения:
и Расчёт
Аналогично рассчитываем По величине и знаку 2. На втором этапе переходит от значения
После подстановки степенного ряда зависимости
где М0, М1, М2 – функции Темкина-Шварцмана, приведённые в соответствующих таблицах справочника физико-химических величин. Константу равновесия можно рассчитать для стандартных условий, используя уравнение
и пересчитать для температуры, используя уравнение изобары или изохоры химических реакций. Определение константы равновесия с помощью температурных функций Тёмкина-Шварцмана называется методом Тёмкина-Шварцмана по имени составителей таблиц. В результате второй стадии рассчитано 3. На третьей стадии определяем состав равновесной смеси в моль или молярных долях. Пример: Определить состав равновесной смеси при взаимодействии этилена и хлорводорода. Пример 1. Будет ли самопроизвольно идти образование паров воды из водорода и кислорода при температуре 110 С? 
стандартный тепловой эффект реакции равен ΔН0298=400 Дж/моль Допустим, реакция идет при постоянном давлении , температура процесса постоянна по условию. Тогда критерием самопроизволности процесса является условие Используем уравнение Гиббса –Гельмгольца где ΔН – тепловой эффект процесса, TΔ S теплота, которая не может превратиться в работу, а ΔG – max полезная работа, взятая с обратным знаком. тогда для стандартных условий имеем: ΔН0298 =2 ΔН0298fН2Опар-(2 ΔН0298 f Н2+ ΔН0298 f О2)=400 Дж/моль знак + показывает, что теплота поглощается. изменение энтропии определяется на основании того , что энтропия является параметром состояния и в справочных данных даны не изменения энтропии, а абсолютные значения энтропий участников реакции: ΔS0298 =ΣS0298 кон – ΣS0298 нач =2S0298Н2Опар-(2S0298 Н2+ S0298 О2)=2*0,19 – (2*0,13 +0,2)= - 0,1 Дж/мольK так как температурный интервал реакции от25 до 110 < 100 C, изменением теплоемкости пренебрегаем и тогда ΔНТ =ΔН0298 и -ΔST= ΔS0298 поэтому можем записать:
процесс самопроизвольно протекать не будет. При V –const T=const можно воспользоваться уравнением
тогда Вывод: так как в системе не совершается полезная работа, то при V=const T=const и Р =const T=const самопроизвольно процесс протекать не будет. Пример2. При какой температуре возможно самопроизвольное образование пара из Н 2 и О2? Так как процесс идет при Р =const T=const, и не совершается полезная работа, то :
процесс пойдет самопроизвольно при температуре, >чем вычислена по уравнению т.е. при Т> 383К. Пример 3 . Наступило ли равновесие для реакции СО + Н 2О (пар) = СО 2 +Н 2 при 500 С , если Кр = 6,2 а парциальные давления каждого компонента равно 1? (давление измеряется в атмосферах).
в системе равновесие не наступило, а реакция идет слева направо при указанных условиях. Пример 3 . Наступило ли равновесие для реакции СО + Н 2О (пар) = СО 2 +Н 2 при 500 С , если Кр = 6,2 а парциальные давления каждого компонента равно 1? (давление измеряется в атмосферах).
в системе равновесие не наступило, а реакция идет слева направо при указанных условиях. Пример 1. Вычислить теплоту испарения диэтилового эфира, если при нормальной температуре кипения (Т=307,9К), dP|dT=3,53*103 Па/К Решение ΔН= Пример 2 Вычислите теплоту испарения лекарственного вещества в интервале температур 88-112К,если давления при этих температурах8*10 3 Па и 101*10 3 Па. Решение.
|
||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 541. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
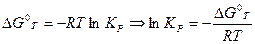
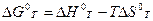 .
.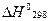 и
и  проводят по известным соотношениям следствий из закона Гесса:
проводят по известным соотношениям следствий из закона Гесса: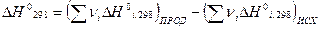 .
.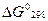 судят о возможности полученных продуктов реакции из исходных веществ в стандартных условиях.
судят о возможности полученных продуктов реакции из исходных веществ в стандартных условиях.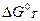 , используя уравнение Кирхгофа:
, используя уравнение Кирхгофа: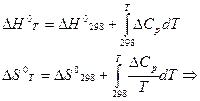
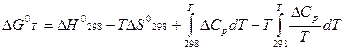 .
.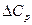 = f(T), интегрирования и преобразований, получаем уравнение вида:
= f(T), интегрирования и преобразований, получаем уравнение вида: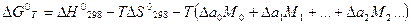 ,
,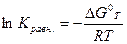
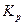 , известно общее давление.
, известно общее давление.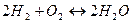 2Н2 + О2 =2 Н2О
2Н2 + О2 =2 Н2О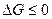
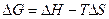
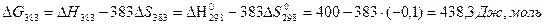 >0!!
>0!!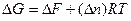
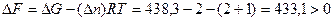
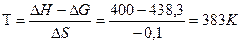
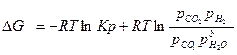 = -8,314 773 ln6,2 + 8,314773ln 1=<0
= -8,314 773 ln6,2 + 8,314773ln 1=<0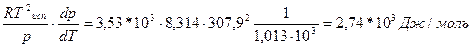
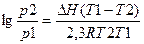 ,
,