Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Расчет изменения энергии Гиббса при протекании химической реакции с применением таблиц стандартных термодинамических величин.Стр 1 из 2Следующая ⇒ Расчет теплового эффекта химической реакции при любой температуре по табличным термодинамическим данным. (см задачи) Закон Гесса При этом применяют следствия из закона Гесса: 1. тепловой эффект реакции при стандартных условиях равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ, умноженных на соответствующие стехиометрические коэффициенты: 2. тепловой эффект реакции при стандартных условиях равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции, умноженных на соответствующие стехиометрические коэффициенты:
Пример1. Определите теплоту образования HI (г) по реакции: ½ Н2 + 1/2 I2= HI (г) Решение. Тепловой эффект здесь равен тепловому эффекту образования HI, так как ΔΗ (Н2 ) и ΔΗ (I2 ) равны 0. По таблицам находим теплоту образования HI, она равна 26,04 кДж/моль. Пример 2. Рассчитайте тепловой эффект реакции СН4 (г) + СО 2 (г)=2СО (г) + 2Н 2 по стандартным теплотам образования. Решение Из таблиц находят ΔΗ 0 f для участников реакции: ΔΗ0 f 298 СН4 (г) = -74,85, ΔΗ0 f298 СО 2 (г) = -393,51, ΔΗ0 f298 СО = -110,5, ΔΗ 0fН 2=0 Согласно следствию закона Гесса имеем: ΔΗ r = 2 ΔΗ0 f298 СО + ΔΗ 0fН 2 - ΔΗ0 f 298 СН4 (г) - ΔΗ0 f298 СО 2 (г) = 2(-110,5,) + 0 – (-74,85 -393,51) = + 247.39 кДж|моль реакция эндотермическая по теплотам сгорания: ΔΗ r = ΔΗ0 f 298 СН4 (г) + ΔΗ0 f298 СО 2 (г) -(2 ΔΗ0 f298 СО + ΔΗ 0fН 2 ) = ΔΗ0 с 298 СН4 (г)= -802.32 кДж/моль, ΔΗ0 с298 СО 2 (г) = 0, ΔΗ0 с298 СО= -283,0. ΔΗ 0сН2= -241.84. ΔΗ r = -802.32 +0 - (2 -283,0 –2 -241.84) =+247,36 кДж/моль Закон Гесса имеет исключительно практическое значение. С его помощью можно узнать тепловой эффект любой реакции, не производя для этого непосредственных измерений. Это особенно ценно в тех случаях, когда проведение реакций неосуществимо или искажается побочными эффектами.  Например , (пример3) теплоту образования глюкозы экспериментально найти нельзя, так как реакция , идущая по уравнению : 6С гр +6Н2 (г) +3О2 (г) =С6 Н12 О6 (тв) неосуществима. Но пользуясь законом Гесса можно скомбинировать термохимические уравнения, из которых можно посчитать этот эффект. Например так: 1. 6С гр +6О2 (г) =6СО2 (г) ΔΗ1= 6 (-94,0) = - 564 ккал|моль 2. 6Н2 (г) +3О2 (г) = 6Н2 О (ж) ΔΗ2 =6 (-68,3) = - 410 ккал/моль 3. С6 Н12 О6 (тв) +6О2 (г) = 6СО2 (г) + 6Н2 О (ж) ΔΗ3= -670 ккал/моль Аналогичная комбинация энтальпий дает энтальпию образования глюкозы: ΔΗ1 + ΔΗ2 - ΔΗ3 = ΔΗf C6H12O6 ΔΗf C6H12O6 = - 304 ккал|моль Здесь теплота образования рассчитана по теплотам сгорания. Пример 4 Определить теплоту (энтальпию) фазового перехода: Na (к) = Na (г) 0 108,3 ΔΗ 0возг =108,3 –0 = 108,3 кДж/моль SO3(ж) = SO3 (г) -439,0 -396.1 ΔΗ 0исп = -396,1 – (-439) = 42,9 кДж/моль Пример 5 Определить энергию диссоциации двухатомной молекулы на атомы (энергия химической связи): Cl2 (г) = 2Сl(г) 0 2(121,3) ΔΗ0дисс = 2(121,3) -0 =242,6 кДж/моль Пример6 Определить энергию превращения атома в ион (энергию ионизации): Н(г) = Н+ (г) + e 217,98 1536,2 ΔΗ0иониз. =1536,2 – 217,98 = 1318, 22кДж/моль С помощью термохимических расчетов можно определить энергию химических связей, энергию кристаллической решетки, энергию межмолекулярного взаимодействия, энтальпию растворения (гидратации), эффекты фазовых превращений Для пояснения закона Гесса рассмотрим пример получения водного раствора NH 4Cl из NH3(г) и HCl (г) и воды . Процесс можно провести двумя путями: 1) NH3 (г) + HCl(г) = NH 4Cl(г) (выделяется 41,85 ккал/моль) 2). NH 4Cl(г) + aq = NH 4Cl aq (поглощается 3,92 ккал/моль) (-3,92) Результат: выделяется 37,93 ккал/моль 2-ой путь: 1). NH3 (г) +aq = NH3 aq выделяется 8,35 ккал/моль (+8,35 ) 2). HCl(г) +aq = HCl aq выделяется 17,32 ккал/моль (+17,32) 3). HCl aq + NH3 aq = NH 4Cl aq выделяется 12, 27 ккал/моль Результат: выделяется 37,94 ккал/моль Пример1. Определите теплоту образования HI (г) по реакции: ½ Н2 + 1/2 I2= HI (г) Решение. Тепловой эффект здесь равен тепловому эффекту образования HI, так как ΔΗ (Н2 ) и ΔΗ (I2 ) равны 0. По таблицам находим теплоту образования HI, она равна 26,04 кДж/моль. Пример 2. Рассчитайте тепловой эффект реакции СН4 (г) + СО 2 (г)=2СО (г) + 2Н 2 по стандартным теплотам образования. Решение Из таблиц находят ΔΗ 0 f для участников реакции: ΔΗ0 f 298 СН4 (г) = -74,85, ΔΗ0 f298 СО 2 (г) = -393,51, ΔΗ0 f298 СО = -110,5, ΔΗ 0fН 2=0 Согласно следствию закона Гесса имеем: ΔΗ r = 2 ΔΗ0 f298 СО + ΔΗ 0fН 2 - ΔΗ0 f 298 СН4 (г) - ΔΗ0 f298 СО 2 (г) = 2(-110,5,) + 0 – (-74,85 -393,51) = + 247.39 кДж|моль реакция эндотермическая по теплотам сгорания: ΔΗ r = ΔΗ0 f 298 СН4 (г) + ΔΗ0 f298 СО 2 (г) -(2 ΔΗ0 f298 СО + ΔΗ 0fН 2 ) = ΔΗ0 с 298 СН4 (г)= -802.32 кДж/моль, ΔΗ0 с298 СО 2 (г) = 0, ΔΗ0 с298 СО= -283,0. ΔΗ 0сН2= -241.84. ΔΗ r = -802.32 +0 - (2 -283,0 –2 -241.84) =+247,36 кДж/моль Закон Гесса имеет исключительно практическое значение. С его помощью можно узнать тепловой эффект любой реакции, не производя для этого непосредственных измерений. Это особенно ценно в тех случаях, когда проведение реакций неосуществимо или искажается побочными эффектами. Например , (пример3) теплоту образования глюкозы экспериментально найти нельзя, так как реакция , идущая по уравнению : 6С гр +6Н2 (г) +3О2 (г) =С6 Н12 О6 (тв) неосуществима. Но пользуясь законом Гесса можно скомбинировать термохимические уравнения, из которых можно посчитать этот эффект. Например так: 1. 6С гр +6О2 (г) =6СО2 (г) ΔΗ1= 6 (-94,0) = - 564 ккал|моль 2. 6Н2 (г) +3О2 (г) = 6Н2 О (ж) ΔΗ2 =6 (-68,3) = - 410 ккал/моль 3. С6 Н12 О6 (тв) +6О2 (г) = 6СО2 (г) + 6Н2 О (ж) ΔΗ3= -670 ккал/моль Аналогичная комбинация энтальпий дает энтальпию образования глюкозы: ΔΗ1 + ΔΗ2 - ΔΗ3 = ΔΗf C6H12O6 ΔΗf C6H12O6 = - 304 ккал|моль Здесь теплота образования рассчитана по теплотам сгорания. Пример 4 Определить теплоту (энтальпию) фазового перехода: Na (к) = Na (г) 0 108,3 ΔΗ 0возг =108,3 –0 = 108,3 кДж/моль SO3(ж) = SO3 (г) -439,0 -396.1 ΔΗ 0исп = -396,1 – (-439) = 42,9 кДж/моль Пример 5 Определить энергию диссоциации двухатомной молекулы на атомы (энергия химической связи): Cl2 (г) = 2Сl(г) 0 2(121,3) ΔΗ0дисс = 2(121,3) -0 =242,6 кДж/моль Пример 6 Определить энергию превращения атома в ион (энергию ионизации): Н(г) = Н+ (г) + e 217,98 1536,2 ΔΗ0иониз. =1536,2 – 217,98 = 1318, 22кДж/моль С помощью термохимических расчетов можно определить энергию химических связей, энергию кристаллической решетки, энергию межмолекулярного взаимодействия, энтальпию растворения (гидратации), эффекты фазовых превращений. Пример 6: Определить изменение энтропии при превращении 2г льда, взятого при температуре 253К и давлении 1,013*105 н/м2 в пар при температуре 423К, если теплота плавления льда при 273К равна 0,335 кДж/г, удельная теплоемкость льда равна 2,02 Дж/г*К воды – 4,2 Дж/г.К, скрытая теплота парообразования воды равна 2,255 кДж/г, мольная теплоемкость пара при постоянном давлении: Ср = 30,13+11,3*10-3Т, Дж/моль.К Решение: Данный процесс состоит из пяти стадий: 1) нагревание льда от 253 до 273 К – ∆S1; 2) плавление льда при 273 К – ∆S2; 3) нагревание жидкой воды от 273 до 373 К – ∆S3; 4) переход жидкой воды в пар при 373К – ∆S4; 5) нагревание водяного пара от 373 до 473 К – ∆S5 .
Пример 7 В одном из сосудов вместимостью 0,1 м3 находится кислород, в другом, вместимостью 0,4 м3 – азот. В обоих сосудах температура 290 К и давление 1,013 · 105 Н/м2 . Найти изменение энтропии при смешении газов, считая их идеальными. Решение Находим числа моль газов по уравнению Менделеева – Клапейрона:
Пример 8 Вычислить стандартное изменение энтропии Решение
Расчет изменения энергии Гиббса при протекании химической реакции с применением таблиц стандартных термодинамических величин.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 383. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
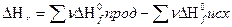






 для реакции:Cd+2AgCl = 2Ag+CdCl2 , если
для реакции:Cd+2AgCl = 2Ag+CdCl2 , если