Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ПОЛУЧЕНИЕ АМИНОКИСЛОТ ИЗ БЕЛКОВЫХ ГИДРОЛИЗАТОВ И АВТОЛИЗАТОВДля получения аминокислот могут быть использованы отходы мясоперерабатывающей промышленности (кератиновое сырье, кровь и т.д.), яичный белок, казеин молока, различные отходы переработки растений, содержащие белки (клейковина пшеницы, соевый шрот и т. д.), белки микроорганизмов (кормовые и пищевые дрожжи). При переработке этого сырья все аминокислоты переходят в гидролизат, и для выделения отдельных аминокислот требуется сложная многостадийная очистка. Кроме того, сырье весьма дефицитно и дорого, поэтому из-за высокой себестоимости получаемых этим способом аминокислот его применение ограничено. Для гидролиза сырья используют кислоты, щелочи и ферменты. При кислотном гидролизе белков большая часть триптофана разрушается, цистеин окисляется до цистина, серин и треонин распадаются. При щелочном гидролизе триптофан сохраняется несколько лучше, но практически полностью разрушаются серин, аргинин и цистеин. При ферментативном гидролизе белков аминокислоты не разрушаются, но требуется сложная подготовка сырья: белок должен находиться в растворимой или другой легкодоступной форме. Гидролиз редко идет до конца, поскольку большинство протеолитических ферментов не проявляют сродства к разрыву всех пептидных связей в субстрате, поэтому в гидролизате накапливается сложная смесь аминокислот и пептидов различной молекулярной массы, кроме того, в гидролизатах остается сам фермент или продукты его частичного разрушения, что также осложняет процесс выделения из этой смеси аминокислот. Несмотря на трудности получения отдельных аминокислот из гидролизатов, это все же весьма важный источник получения их в смеси.  В нашей стране подобным способом вырабатывают небольшие партии высокочистых аминокислот в основном для научных целей, а также автолизаты и ферментолизаты дрожжевых биомасс для пищевой промышленности. В основе технологического автолиза дрожжей лежат процессы подавления роста клеток и активации цитоплазматических деполимераз. При блокировке роста автолиз клеточных стенок происходит слабо и значительная часть нерастворенного материала может быть отделена в конце процесса в виде крупных структурных фрагментов. Активация цитоплазматических деполимераз приводит к накоплению продуктов гидролиза белков и нуклеиновых кислот. За счет этого в заключительной фазе автолиза происходит снижение рН реакционной среды, стабилизация рН свидетельствует об окончании процесса. Широко применяемым методом контроля является также определение содержания свободного аминного азота, нарастающего в процессе протеолиза. Технологический автолиз пекарских дрожжей проводят при температуре 45...50 'С в присутствии плазмолизирующих агентов: толуола, хлороформа, этанола, поваренной соли и др. В суспензии биомассы создают рН 5,5—6,5. В ходе автолиза чаще всего рН не регулируют: при естественном изменении рН чередуются оптимальные условия для действия различных деполимеризующих ферментов, что повышает эффективность процесса в целом. Содержание сухих веществ в суспензии может быть от 1 до 20%, снижение концентрации биомассы в этих пределах приводит к интенсификации автолиза. Продолжительность автолиза составляет 15—30 ч, а после предварительной механической дезинтеграции биомассы — 5—6 ч. Отечественными учеными разработан способ комплексной переработки биомассы пекарских дрожжей на основе автолиза 20%-й суспензии дрожжей в присутствии 13% толуола. Продолжительность процесса при 45...50*С 15—20 ч. Последующее фракционирование автолизата включает отделение клеточных стенок дрожжей центрифугированием, обесцвечивание жидкой фазы автолизата, удаление нуклеиновых соединений н пептидов сорбцией на ионите ИА-1р в ОН- форме, сорбцию аминокислот из очищенного раствора предыдущей стадии на катионите КУ-2х8 и их последующую элюцию раствором аммиака. Получаемая смесь аминокислот содержит все незаменимые и заменимые аминокислоты в соотношениях, характерных для высокопитательных белковых продуктов. Содержание свободных аминокислот составляет около 70% белка автолизированной биомассы, около25% белка гидролизовано до низших пептидов (500—700Да). По данной схеме из 50 кг дрожжей с влажностью 75 % получают 2—3 кг смеси аминокислот, 0,3—0,5 кг нуклеиновых компонентов и около 6 кг клеточных стенок, из которых можно выделить 35—45 г эргостерина. При получении дрожжевых автолизатов и выделении из них продуктов пищевого и медицинского назначения вместо токсичного толуола в качестве мембранотропных агентов используют этанол, а также смеси карбоновой кислоты (например, пропионовой (0,4 %)} и этилацетата (1,5 %), обеспечивающие стерильность процесса и высокий выход целевых продуктов (L-аминокислог и пептидов). Из нетоксичных агентов лучшим активатором протеолитических ферментов является этилацетат при температуре 50..55*С, а из нуклеазных — этанол при 60...65*С. Дрожжевой автолизат, содержащий смесь метаболитов, обладает способностью индуцировать автолиз интактной дрожжевой биомассы, что позволяет использовать его в качестве затравки при непрерывном процессе автолиза. Проведение автолиза в присутствии ионов Са1+ и Мg2+ дает возможность получать автолизаты с пониженным содержанием меланоидных компонентов, которые применяются без предварительной очистки. Скорость и эффективность автолиза зависят, с одной стороны, от физико-химических условий ведения процесса, селективно оптимальных для стадии как индукции автолиза, так и ферментативного гидролиза клеточных биополимеров. С другой стороны, эффективность саморастворения клеток зависит от количества и активности клеточных гидролаз. Как правило, интенсивная деструкция клеток микроорганизмов заканчивается через 4—6 ч в результате ингибирования деполимераз конечными продуктами реакций.
Поэтому наиболее важными для повышения эффективности автолиза являются проблемы стабилизации ферментов автолитического комплекса. Решение их позволило бы пролонгировать время интенсивного гидролиза клетки и расширить диапазоны физикохимических параметров каталитической активности гидролаз. Поданным исследований специалистов Института микробиологии РАН, интенсификацию процессов автолиза дрожжей Sacharomyces cerevisiae и Schizosaccharomyces pombe можно вызвать внесением в подкисленные клеточные суспензии (рН 3-3,5) химического аналога аутоиндуктора автолиза — спиртового раствора олеиновой кислоты (С18:1) в концентрациях 0,25—4 мкмоль/см3, оптимально - 1,12 мкмаль/см3 (объемная доля спирта в суспензии 2 об. %)- Подкислением суспензии воспроизводили естественные условия в развивающейся дрожжевой культуре и обеспечивали лучшую инкорпорацию молекул С18:1;| в клеточные мембраны, что вызывало их дестабилизацию и индуцировало автолиз меток. Суспензию дрожжевых клеток термостатировали при температуре 40...45*C в течение 30 мин (стадия индукции). Затем рН суспензии доводили до 6,8—7,2 раствором NaОН, клетки термостатировали при температуре 50... 53*С в течение 6—8 ч с подтитровкой суспензии до заданных значений рН 6,8—7,2 (стадия автолитического разрушения клеток). Достигаемая глубина гидролиза для дрожжевых суспензий обоих видов составила 42,2 —43,5% по результатам уменьшения массы сухих клеток (МСК), как указано в таблице 23.2.
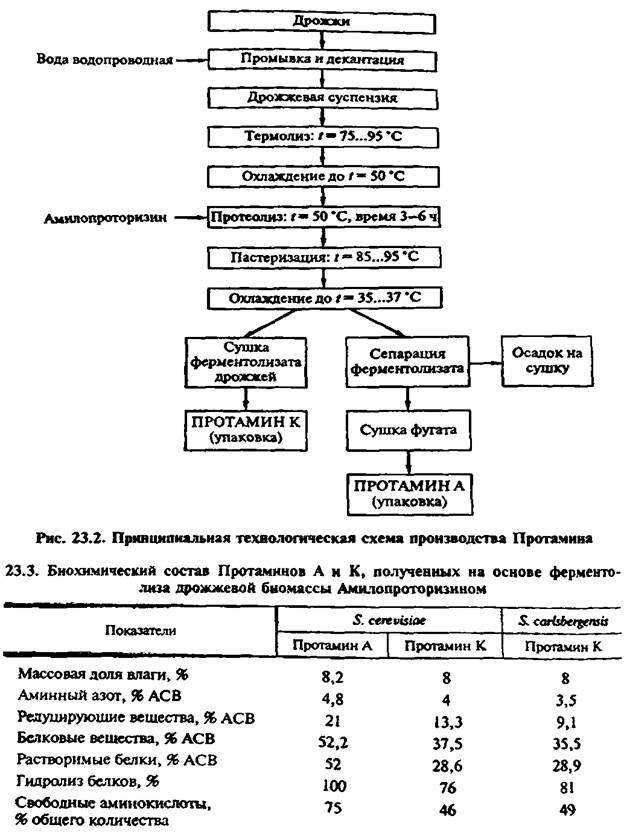
Перспективным источником белка являются избыточные пивные дрожжи, выход которых составляет 0,1—0,2% массы пива, они могут быть также автолизированы по описанной схеме. Лизис дрожжей с использованием ферментных препаратов и различных мультиэнзимных композиций предоставляет более широкие возможности для получения продуктов различного состава, чем автолиз. Применение ферментных препаратов специфического действия позволяет быстро удалить клеточную стенку и выделить из освободившихся протопластов продукты различной степени гидролиза в зависимости от целевого назначения. Для получения недеградированных цитоплазматических компонентов следует использовать биомассу с низкой автолитической активностью. Способы получения препаратов глубокого расщепления основываются на сочетании автолиза дрожжей и их лизиса препаратами литического или протеолитического действия. Для активации протеолиза дрожжей используют растительные, животные и микробные протеазы, которые могут быть неспецифическими по отношению к дрожжевому белку, но в сочетании с автолитическими протеазами дрожжей дают хороший эффект. Например, Проназа Е, папаин, пепсин» Протосубтилин нейтральный в соотношении с изолированным белком пекарских дрожжей 1:1000 гидролизуют его не более чем на 4 %, а добавление этих препаратов в том же соотношении к белку автолизирующихся дрожжей через 5 ч после начала этого процесса позволяет спустя еще 1 ч получить глубину гидролиза белка 95%. В контроле этот уровень достигается лишь после 20 ч автолиза. Амилопроторизин, содержащий комплекс протеаз: а-амилазу, экзо-в-глюканазу, ксиланазу. эффективно воздействует на дрожжевую клетку, переводя макромолекулярные структуры клетки в мономеры. При этом ферменты препарата осуществляют не только растворение белков протоплазмы, но и глубокую деполимеризацию в результате синергического действия трудногидролизуемых полисахаридов клеточных стенок. Оптимальная дозировка препарата для 6-часового гидролиза 15 ед. ПС/г дрожжей, при этом в растворимое состояние переводится 80% белка, высвобождается 48—52 % аминокислот, образуется около 50 мг/г аминного азота и 11 % редуцирующих углеводов. Во ВНИИПБТ исследовали степень гидролиза микробного белка различного происхождения и установили, что наиболее легко гидролизуемыми являются кормовые и остаточные пивные дрожжи. В результате воздействия Амилопроторизина на дрожжевой белок этих микроорганизмов образуется 60—61% свободных аминокислот, а при гидролизе пекарских дрожжей — 41 %. Технологическая схема гидролиза дрожжевой биомассы Амилопроторизином с получением биологически активной аминокислотной добавки: Протамин А — сухой фугат и Протамин К — сухой ферментолизат, представлена на рисунке 23.2. Биохимический состав опытных партий Пропгаминов А и К, полученных на основе ферментолиза биомассы пекарских и пивных дрожжей, представлен в таблице 23.3. Энзиматическому гидролизу была подвергнута большая часть белков клетки (76—81%), при этом высвободилось 46—49% аминокислот.
Содержание нуклеиновых кислот во всех препаратах Протамина в результате гидролиза дрожжевых клеток ферментативным комплексом препарата Амилопроторизин было снижено более чем в десять раз (с 5 % до 0.43—0.41 %). Препарат Протамин пищевой наряду с легкоусвояемыми продуктами гидролиза высокомолекулярных полимеров дрожжевой клетки (аминокислоты, редуцирующие углеводы) содержит богатый комплекс витаминов (табл. 23.4) и рекомендуется для введения в рецептуры новых продуктов питания с повышенной биологической ценностью.
С использованием препарата Лнзосубтилин возможно получение белково-витаминного обогатителя пиши из гидролизных дрожжей рода Candida и дрожжей спиртового производства. Кормовые дрожжи с влажностью 75—90 % нагревают до температуры 46...50*С. Вносят Лизосубтилин в количестве 0,2—0*5% сухого вещества дрожжей, проводят гидрат из в течение 20—30 ч при постоянной температуре и перемешивании. Затем непрогидролизованные остатки клеток отделяют сепарацией, а жидкую фазу высушивают. Сухой продукт представляет собой порошок соломенно-желтого цвета с приятным запахом. Содержание аминного азота составляет 4,3 %, около патовины аминогрупп принадлежит свободным аминокислотам, среди которых преобладают аланин, лизин, лейцин (соответственно 16.0, 15,7 и 12,4%). Дрожжи спиртового производства обладают заметной автолитической активностью, причем оптимальные условия автолиза и лизиса Лизосубтилином совпадают, что позволяет вести процесс при постоянных значениях рН и температуры (рН 6,3—6,8, температура 50...55*С). При дозе препарата 0,1 % АСБ дрожжей выход растворимых форм азота и углеводов возрастает в 2—2,5 раза (по сравнению с автолизом), через 6 ч в жидкую фазу ферментолизата переходит около половины азотистых соединений и треть углеводов. Выход аминного азота составляет около 3 % АСБ дрожжей. Применение ферментных препаратов не снижает пищевой ценности и усвояемости высвобождаемого белка, аминокислот и редуцирующих веществ. У нас в стране на основе автолиза прессованных хлебопекарных дрожжей Saccharomyces cerevisiae были разработаны аминокислотные препараты «Александрина» и «Элита» в виде растворов, паст и порошков. В состав препаратов входят аминокислоты, углеводы, витамины, макро- и микроэлементы биогенного происхождения, необходимые для жизнедеятельности человека. Добавки не обладают мутагенным действием, не содержат холестерина и усваиваются человеком на 90 %. Препараты добавляют в хлебобулочные и кондитерские изделия, безалкогольные напитки и овощные обеденные консервы, напитки, желе, продукты детского питания. Специалистами российской фирмы "БИТРА" разработаны натуральные БАД серии «Нагипол», созданные на основе автолизатов пивных дрожжей. Пищевая ценность и биологическая активность БАД «Нагипол» определяется содержанием сбалансированного комплекса 18 аминокислот (включая все восемь незаменимых), пептидов, витаминов группы В, витаминов Е, F, К и наиболее важных эссенциальных макро- и микроэлементов: фосфора, калия, магния, железа, цинка, меди, хрома и др. При приеме БАД "Нагипол" суточная потребность организма во всех вышеперечисленных биогенных соединениях восполняется на 20—50 % и более. Оценка эффективности БАД "Нагипол", проведенная в рамках программы медико-экологической реабилитации населения, проживающего на экологически неблагополучных территориях, совместно с ГНИЦ профилактической медицины Минздравсоцразвития РФ, показала, что в результате проведения 3—6-месячной профилактики при ежедневном приеме препаратов в рекомендуемой дозе среди детей и взрослых в 1,5—2 раза снизилась распространенность показателей алиментарных дефицитов: хронических атрофических нарушений, признаков вторичных иммунодефицитов, снизился уровень психоэмоционального напряжения. Включение ферментолизатов в состав пищевых продуктов улучшает питательную ценность последних; задерживает их порчу; придает им желательную структуру, растворимость; способствует получению пенообразующих, свертывающих, эмульгирующих свойств; предупреждению нежелательных взаимодействий; удалению пороков вкуса, запаха, токсичных и ингибирующих веществ. Дрожжевые ферментолизаты и автолизаты обладают способностью придавать пищевым продуктам привкус мяса (или усиливать такой вкус), поэтому их широко используют в пищевой промышленности для приготовления супов, соусов, подлив и приправ, а также для придания вкуса таким продуктам, как чипсы. С помощью белковых гидролизатов можно составлять низкокалорийные белковые рационы, обеспечивающие контролируемое уменьшение массы тела, не приводящие к каким-либо патологическим последствиям. Однако белковые гидролизаты имеют сравнительно ограниченное применение в пищевой промышленности, прежде всего из-за горького вкуса пептидов, образующихся в процессе гидролиза. Российскими исследователями показана целесообразность применения иммобилизованных ферментов, например Протосубтилина, для гидролиза белкового сырья, а также пептидов неполных белковых гидролизатов с целью получения смеси L-аминокислот, не содержащей пептидов. Полученные гидролизаты белков не обладают горьким вкусом, что является одной из важнейших характеристик белковых ферментативных гидролизатов для применения в питании человека.
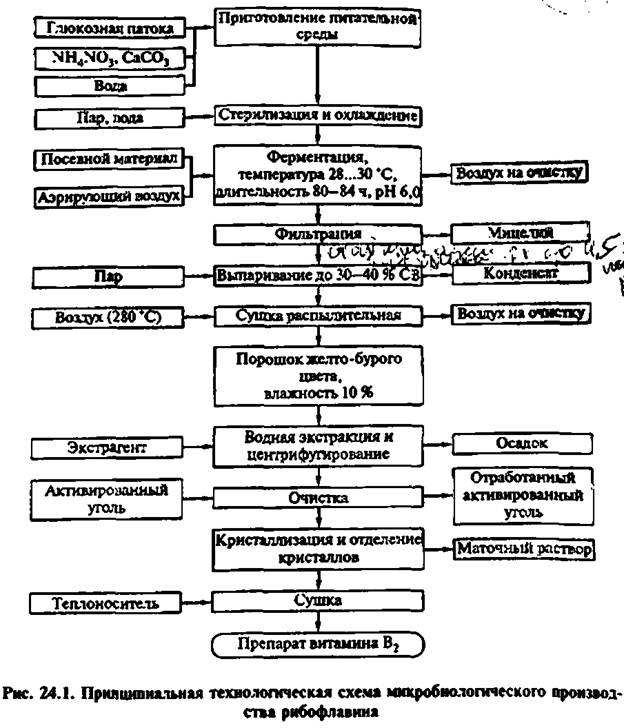
Глава 24 ВИТАМИНЫ Для укрепления здоровья населения и защитных функций организма, а также для профилактики витаминной недостаточности производят качественно новые продукты, обогащенные витаминами и минеральными веществами. Витамины вносят в продукты питания, если они полностью отсутствуют в сырье или существенно разрушаются в ходе технологического процесса, для обеспечения пищевых потребностей потребителей. Витаминные добавки к пище давно и хорошо известны и очень широко используются в повседневной медицинской практике. В настоящее время ассортименту и производству витаминсодержащих БАД в России уделяют особое внимание. Основанием для этого являются: • существующий дефицит витаминов в питании детей и взрослых, граничащий нередко с клиническими проявлениями гиповитаминозов; повысившийся в последнее время уровень образования населения в вопросах профилактики гиповитаминозов и значения витаминов в сохранении и поддержании здоровья, способствующий, а свою очередь, усилению спроса на эти виды БАД; реальные успехи витаминологии, а также витаминной, пищевой и фармацевтической отраслей промышленности, позволившие создать широкий спектр витаминных препаратов, витаминизированных напитков и продуктов. Витаминизированные продукты питания уже давно находят применение за рубежом. Из общего количества производимых в Германии напитков 10% обогащены витаминами, 12% всех молочных продуктов, включая йогурты, обогащены витаминами во Франции. Практически во всех странах мира детское питание содержит необходимые детскому организму микронутриенты. Такая популярность витаминизированных продуктов питания базируется на очень позитивном отношении к ним потребителей и желании включать такие продукты в свой ежедневный рацион, заботясь таким образом о своем здоровье. Так, 74 % немцев считают витамины весьма полезными, 60 % присоединяются к этому мнению в отношении микроэлементов. Выборочный опрос российских граждан показал: 85% респондентов считают, что регулярное потребление витаминов способствует укреплению здоровья, но при этом только 14% получают с пищей все необходимые витамины и минералы; 71% опрошенных считает, что с обычной пищей невозможно получить достаточное количество микронутриентов, что полностью соответствует позиции Института питания РАМН; 82% респондентов в течение последнего года все чаще включают в свой рацион витаминизированные продукты. На сегодняшний день к витаминам относят низкомолекулярные органические соединения химической природы, биорегуляторы процессов, протекающих в живом организме. По новейшей классификации к группе витаминов относят следующие соединения: В1 — тиамин; В2 — рибофлавин; В3, или В5, — пантотеновая кислота; В6 (адермин) — пиридоксин, пиридоксаль; В9 - фолиевая кислота; В12— кобаламин (группа витаминов В); РР — ниацин, никотиновая кислота; Н — биотин; С — аскорбиновая кислота; А — ретинол, а- и в-каротины (группа витаминов А); кальциферол, эргокальциферол (D2), холекалъциферол (D3) (группа витаминов D); Е - токоферолы; К— нафтохиноны, их коферментные формы и разные производные. Эти соединения в настоящее время в основном получают из природных источников и химическим синтезом. В связи с возрастающими потребностями в витаминах особенно большой интерес проявляется к микроорганизмам, способным к суперсинтезу этих веществ. Установлено, что способностью к синтезу большого количества рибофлавина обладают некоторые представители дрожжей, бактерий и грибов. Получены мутанты микроорганизмов, которые в больших количествах продуцируют b-каротин и витамин В12. По растворимости витамины делят на две группы: водорастворимые (В1, В2 ,В3, В6, В9, В12, РР, Н, С); жирорастворимые (А, D, Е, К). ВИТАМИН В2 (РИБОФЛАВИН) Витамин В2 получил свое название от сахара рибозы, входящего в состав витамина в виде многоатомного спирта D-рибнта. Эмпирическая формула рибофлавина молекулярная масса 376,4. Витамин В2 входит в структуру многих ферментов, в составе которых участвует в клеточном дыхании, синтезе белков и жиров, регулировании состояний нервной системы, функции печени, слизистых оболочек и.т.д. Рибофлавин широко распространен в природе. Он входит в состав животных и растительных клеток. Довольно большое количество рибофлавина содержат зерновые культуры. Среди тканей животного организма наиболее высокое содержание рибофлавина в печени и почках. Животный организм не способен к синтезу рибофлавина и должен получать его с пи- шей. Изучение обмена рибофлавина показало, что при его недостатке в организме резко замедляется рост, нарушается белковый обмен, возникают заболевания кожи, слизистой оболочки ротовой полости, кровеносной системы и желудочно-кишечного тракта. Микробиологический способ получения витамина В2 привлекает своей простотой. В качестве продуцента используют микроскопический гриб Eremothecium ashbyii, который культивируют на среде, состоящей из глюкозной патоки (2,5% по РВ), N4N03(0,5 %), СаСОэ (0,5 %), Основные технологические стадии процесса производства рибофлавина представлены на рисунке 24.1. Но данный процесс малоэффективен вследствие ряда причин: уровень накопления витамина В2 в культуральной жидкости ограничен (до 2,0—2,5 г/дм3), культивирование продуцента длительное (3—4 сут), кроме того, культура E. ashbyii генетически нестабильна и требует постоянной поддерживающей селекции, выход пищевого препарата после очистки незначителен. Более эффективен способ получения рибофлавина на основе культивирования генно-инженерного штамма бактерий Васillus subtilis 304/рМх45, лишенного основных недостатков, присущих грибному продуценту. Бациллы быстро растут, нетребовательны к составу питательной среды, обладают мощным пентозофосфатным циклом, что обеспечивает высокий уровень накопления промежуточных продуктов пути биосинтеза рибофлавина. Важен и тот факт, что В. subtilis относится к микроорганизмам, хорошо изученным в генетическом отношении. На данной культуре отработаны самые современные методы генной инженерии. Кроме того, поскольку рибофлавин у штаммов В. subtilis выделяется непосредственно в культуральную жидкость, разработаны методы выделения кристаллического препарата для пищевых и медицинских целей. Культура не теряет плазмиду и сохраняет неизменной биосинтетическую активность после лиофилизации в течение 5 лет и более. Это важное преимущество бациллярных продуцентов по сравнению с грибными. Штамм сохраняет стабильность в неселективных условиях в жидких ферментационных средах. В качестве источников углерода используют зеленую патоку или мелассу (10% по РВ). В состав
питательной среды вводят также кукурузный экстракт, (NН4)SО4, К2НРО4, КН2РО4, антибиотики. Исходный рН среды 7,2—7,4, температура культивирования 37*С, аэрация 1:1, доза посевного материала 5 %. В случае применения мелассы отпадает необходимость в рН-статировании, поскольку в процессе культивирования значение этого показателя поддерживается на уровне 7,2—7,5, вероятно, в результате потребления из мелассы органических кислот. В качестве источников азота возможно использование аммонийных солей, мочевины, аминокислот, БВК (2 %). Из минераль
ных солей выявлено влияние МgSО4, введение которого в концентрации ниже 0,05% снижает синтез рибофлавина. Процесс биосинтеза рибофлавина в лимите по источнику углеводов имеет следующие преимущества: накопление рибофлавина в культуральной жидкости увеличивается в 1,4 раза, возрастает коэффициент конверсии углеводов, значительно улучшается качество культуральной жидкости из-за снижения содержания остаточных РВ, что облегчает ее дальнейшую обработку (табл. 24.1). В культуральной жидкости рибофлавин содержится в виде кристаллов — 18—19 г/см3 и 1—2 г/дм3 в растворенном состоянии. Для получения кристаллического рибофлавина кристаллы переводят в растворимое состояние добавлением НСL. затем горячий раствор подвергают микрофильтрации и охлаждению. Выпавшие кристаллы растворяют и перекристаллизовывают. Выход пищевого препарата рибофлавина в этих условиях в 2 раза выше, чем при выращивании Е. ashbyii. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 596. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |