Ионы, образующие с ионами кристаллов малорастворимые соединения
При протекании реакции 2HS(газ) + 3O2(газ) = 2 SO2(газ) + 2H2O(ж) энтропия системы: уменьшается
Седиментационная устойчивость дисперсных систем обусловлена: размером частиц
Величина потенциала частиц положительного заряда золя CaSO4 при постепенном добавлении к нему раствора CaCl2 будет: уменьшаться
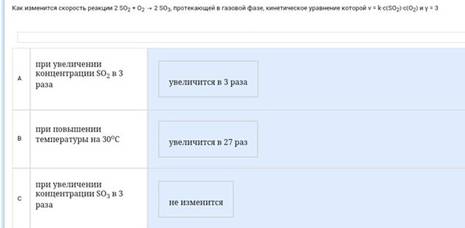
Как изменится скорость реакции 2SO2 + O2 = 2So3 протекающей в газовой фазе, кинетическое уравнение которой v= k*c(SO2) c(O2) и y=3:
Если в обратимом процессе прямая реакция экзотермическая, то величина Кс для нее при повышении температуры: уменьшается
Увеличение концентрации водорода сместит равновесие влево в системах: 
Количество вещества глюказы, которое содержится в 400 мл 0,05 М раствора C6H12O6, равно: 0,02 моль
рКа(HNO2)=3,14; рКа(C3H2COOH)=4,82; рКа(HCN)=9,2. Как изменится сила кислоты в ряду HNO2 - C3H2COOH – HCN: уменьшается
кинетическое уравнение простой реакции 2N2O(газ)=O2(газ) + 2N2(газ) имеет вид: v=k*c2
Кинетическое уравнение простой реакции CH3OCH3(газ) = CH4(газ) + CO(газ) + H2(газ) имеет вид: v=k*c
Выберите правильные утверждения:
1) Согласно протолитической теории в водном растворе ион гидроксила ОН-является основанием
2) Сила кислоты связана с ее способностью отдавать протон и характеризуется величиной Ка
Схема строения мицеллы золя, полученного по реакции NaBr + AgNO3(изб) = AgBr + NaNO3 имеет вид: 
Растворы – это: гомогенные системы
Гипертоническим по отношению к плазме крови (осмолярность плазмы крови 0,3 моль/л) является раствор: 0,2 MMgSO4
При повышении температуры константа равновесия СH3COH(газ) + H2(газ) = C2H5OH(газ) (DH<0): уменьшится
Выберите интервал рН буферного действия системы CH3COOH/CH3COO-, если для уксусной кислоты рКа = 4,76: 3,8 – 5,8
При растворении в воде способен повышать натяжение водной фазы:
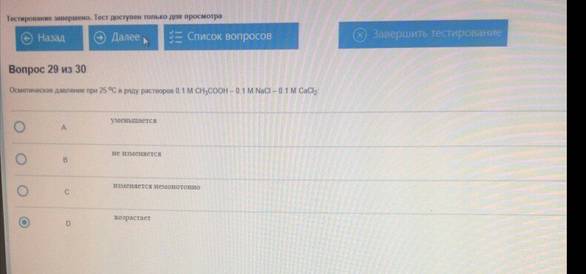
Осмотическое давление при 25С в ряду растворов 0.1М CH3COOH- 0.1М NaCl – 0.1М CaCl :
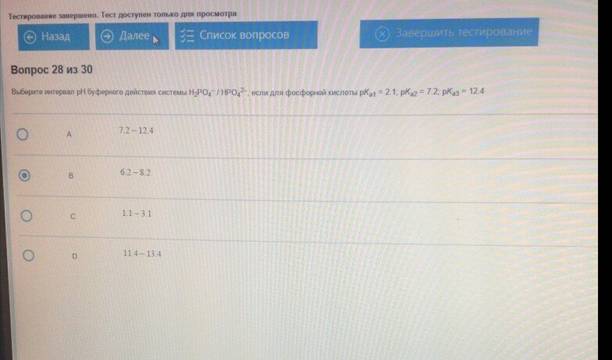
Выберите интервал рН буферного действия системы H2PO4/НРО4, если для фосфорной кислоты рКа1= 2,1; рКа2= 7,2; рКа3= 12,4 :
Оцените истинность суждений :
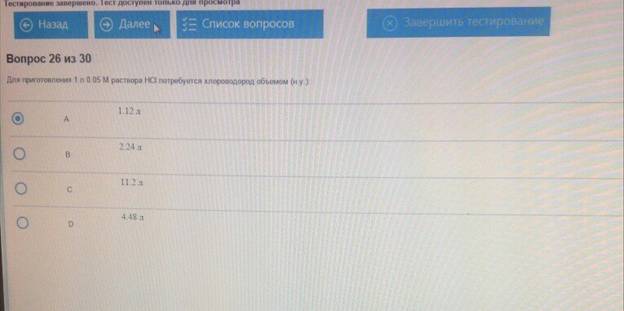
Для приготовления 1 л 0.05 М раствора НСl потребуется хлороводород объемом :
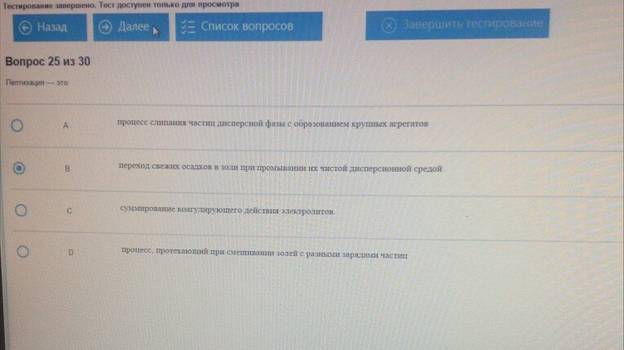
Пептизация – это :
Оцените истинность суждений :
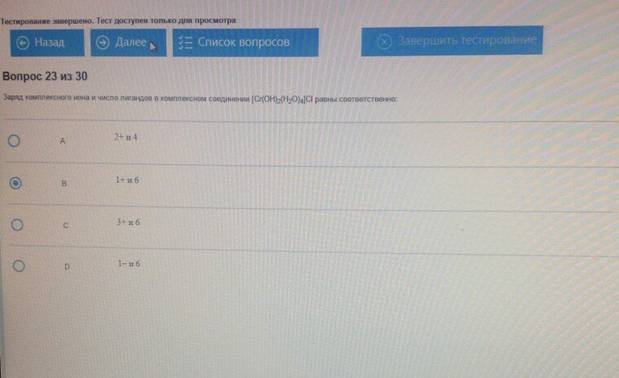
Заряд комплексного иона и число лигандов в комплексном соединении [Cr(OH)2(H2O)4]Clравны соответственно :
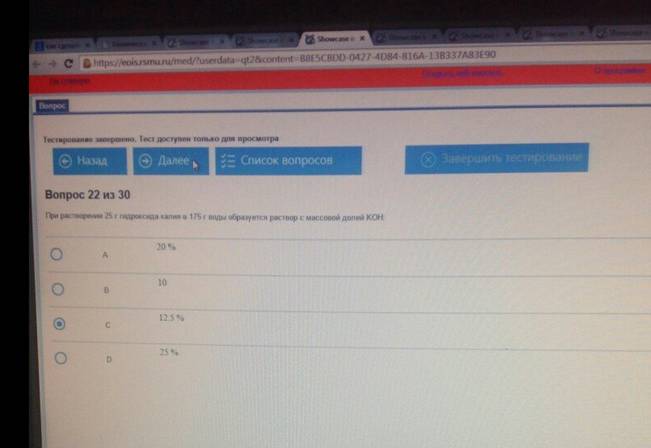
При растворении 25 г гидроксида калия в 175 г воды образуется раствор с массовой долей КОН :
Система MnO4 + 2H2O + 3e= MnO2 + 4 OH ( E= + 0.588 В ) в окислительно-восстановительных реакциях при стандартных условиях может выступать в качестве окислителя по отношению к системам : 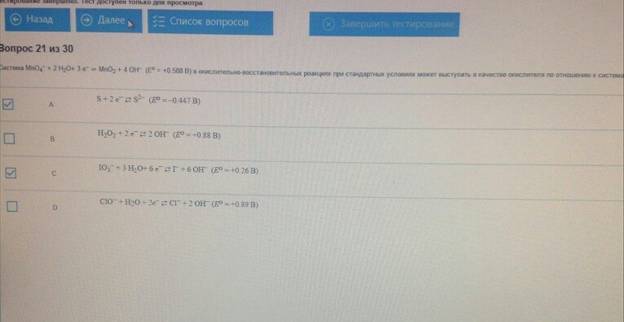
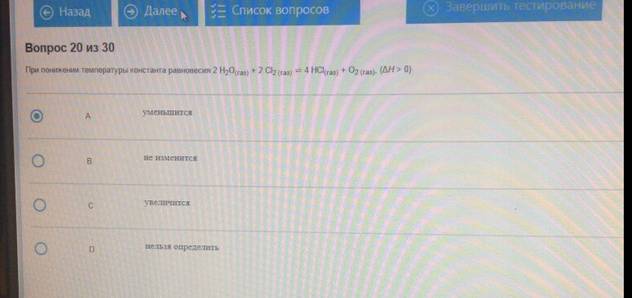
При понижении температуры константа равновесия 2Н2О(газ)+ 2Cl2= 4HCl+ O2 ( H>0) :
рКb[(CH3)2NH] = 3.23; рKb(C6h11NH2)= 3.36; pKb(C6H5NH2)=9.40. как изменится сила кислот в ряду (СH3)2NH2 –C6H11NH3 –C6H5NH3 ?
Гранула – это :
При одинаковой температуре изотоническими являются два раствора :
Экзотермическую однозначно характеризует выражение :
На поверхности ионных кристаллов избирательно адсорбируются :
Аммиачная буферная система может быть получена при смешивании растворов :
Величина стандартной молярной энтропии в ряду веществ C6H14 (газ)-C6H12 (газ)-C6H6 (газ)- C6H6(ж) :
Оцените истинность суждений :
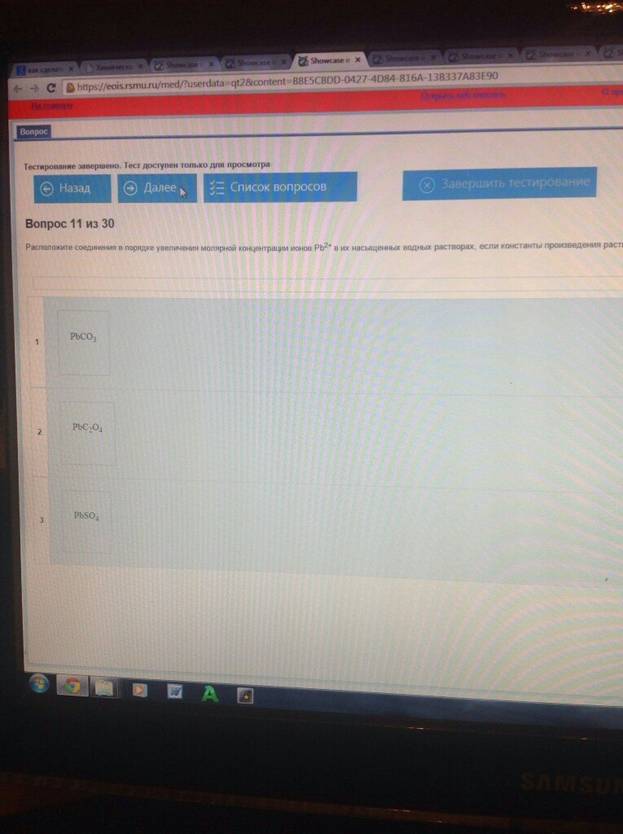
Расположите соединения в порядке увеличения молярной концентрации ионов Рb2+ в их насыщенных водных растворах, если константы произведения :
Установите соответствие между формулой частицы и кислотно-основными свойствами, которые она может проявлять в водном растворе :
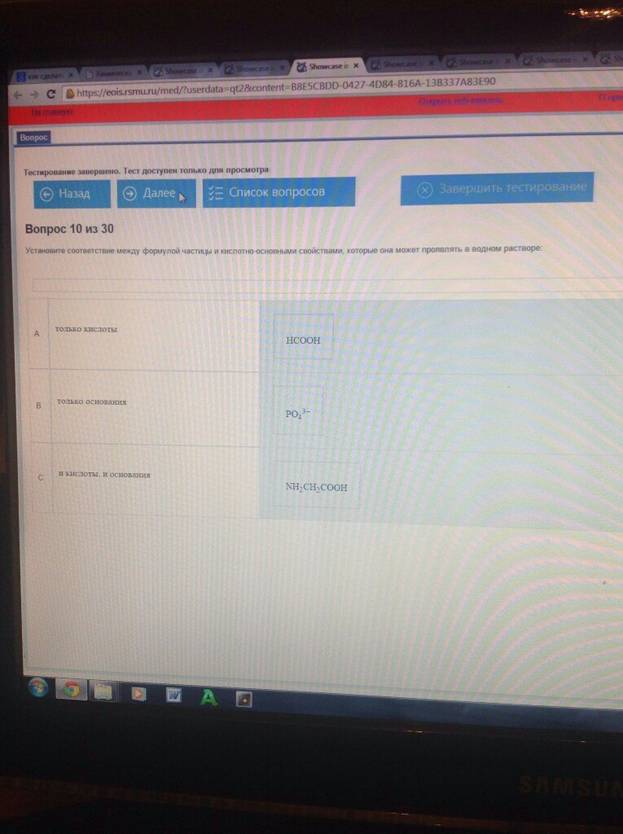
Схема строения мицеллы золя , полученного в результате реакции нитрата серебра с избытком сульфида натрия, имеет вид : 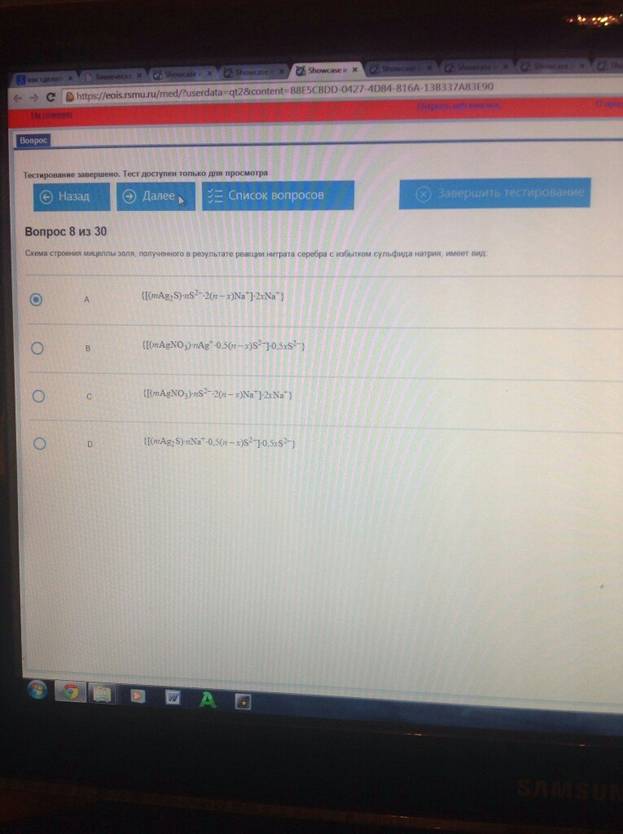
Восстановительный потенциал системы MnO4+ 2 H2O +3e= MnO2+ 4OH:
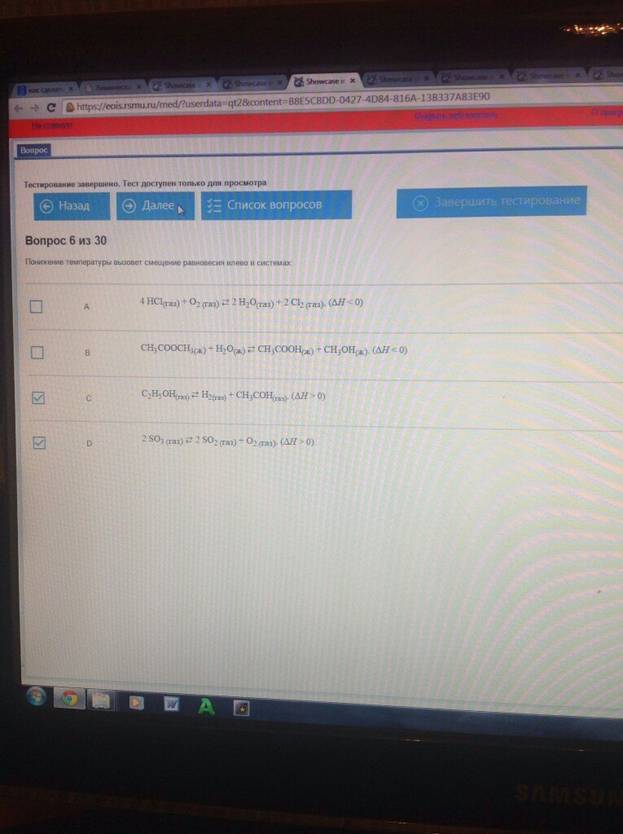
Понижение температуры вызовет смещение равновесия влево в системах :
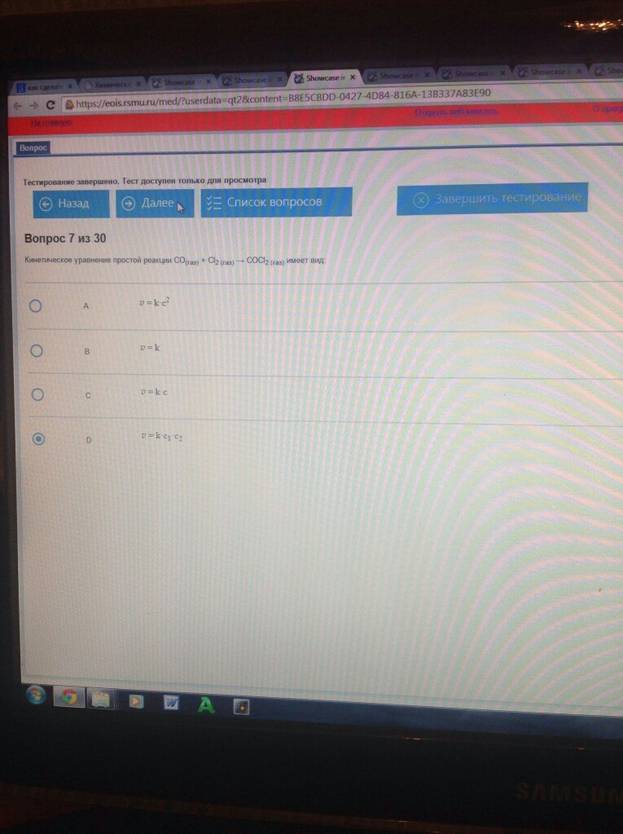
Кинетическое уравнение простой реакции CO+Cl2=COCl имеет вид :
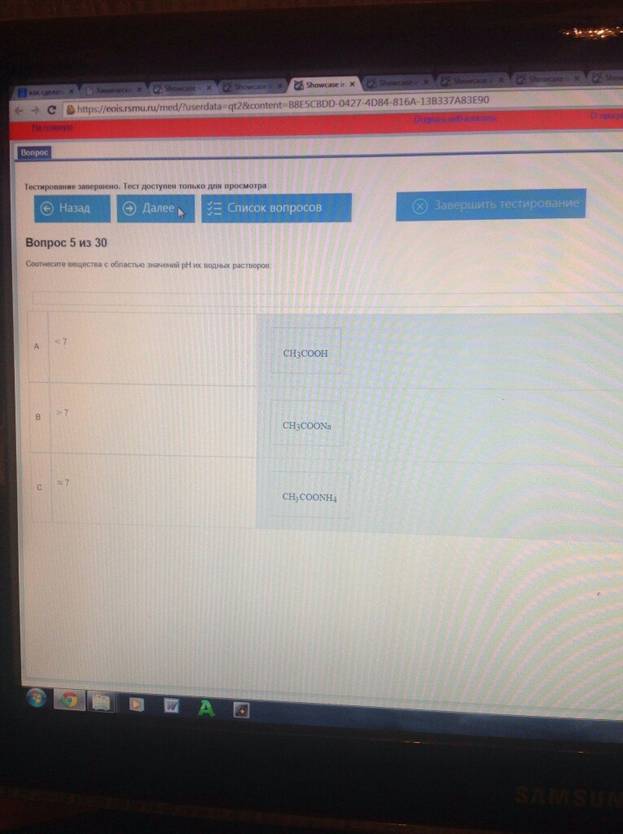
Соотнесите вещества с областью значения рН их водных растворов :
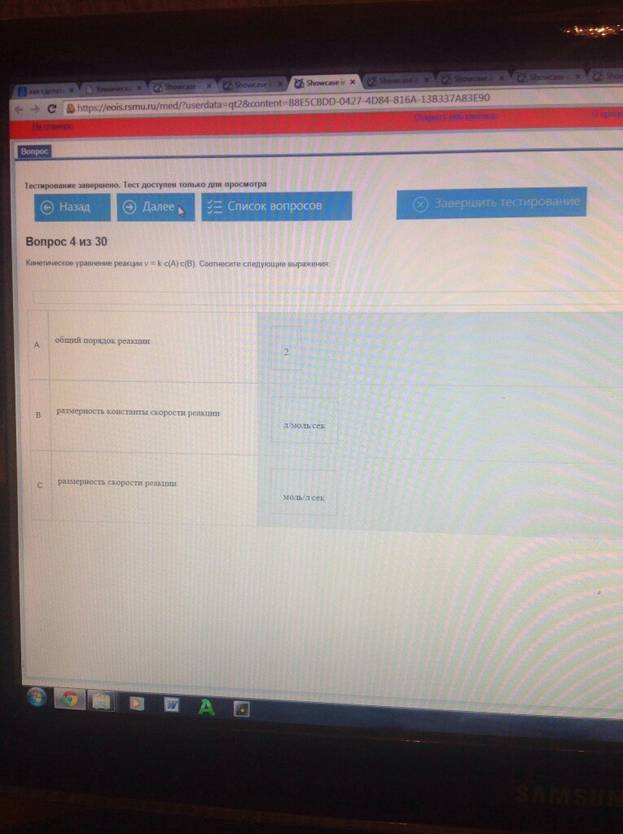
Кинетическое уравнение реакции v= k*c(A)*c(B). Соотнесите следующие выражения :
Выберите правильные утверждения :
Растворы – это :
Состояние химического равновесия в стандартных условиях характеризует условие :

Если для некоторой обратимой реакции при 298 К константа равновесия Ко=1, то: DНо= ТDSо
При смешивании растворов NaBr и AgNO3 был получен отрицательный золь AgBr. Противоионами в мицеллах этого золя являются ионы: Na+
Поверхностное натяжение на границе жидкость – воздух тем ниже, чем: ниже температура
На поверхности кристалла карбоната бария из водного раствора будут преимущественно адсорбироваться ионы: Ba2+
Кинетическое уравнение простой реакции СО(газ) + Сl2 (газ) → COCl2 (газ) имеет вид: v = k·c1·c2
Для процесса в закрытой системе ΔS > 0, этот процесс: возможен только при низких температурах, если ΔH > 0
Установите соответствие между формулой частицы и кислотно-основными свойствами, которые она может проявлять в водном растворе: верно все
A
только кислоты
HPO4
2–B
и кислоты, и основания +NH3CH2COOH
C
только основания
OH–
Укажите систему, которую лучше использовать для приготовления буферного раствора со значением рН, равным 11: NH4Br / NH3H2O; pKBH+ = 9.25
Мицелла –– это: кристаллический агрегат и слой потенциалопределяющих ионов
Соотнесите вещества с областью значений рН их водных растворов: < 7 - CH3COOH;
≈ 7 - CH3COONH4; > 7- CH3COONa
Увеличение концентрации водорода сместит равновесие влево в системах: C3H8 (газ) ⇄ H2 (газ) + C3H6 (газ); С2Н5ОН(газ) ⇄ H2 (газ) + СН3СОН(газ)
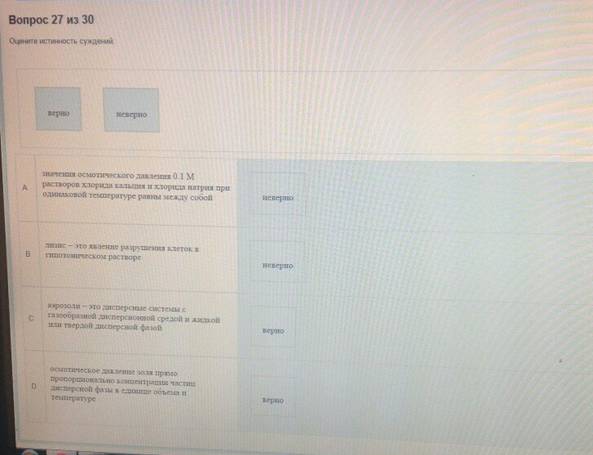
Оцените истинность суждений:
A. значения осмотического давления 1 %-ых растворов хлорида натрия и глюкозы при одинаковой температуре равны между собой - неверно
B. при одинаковой массовой доле осмолярность раствора мономера гораздо меньше осмолярности полимера - неверно
C. дисперсные системы, в которых частицы дисперсной фазы не связаны между собой, называются свободнодисперсными – верно
D. осмос – это преимущественно односторонняя диффузия молекул растворителя через мембрану из раствора с меньшей концентрации в раствор с большей концентрацией растворенных частиц -верно
Величина стандартной молярной энтропии в ряду веществ C(графит) – CH4 (газ) – C2H6 (газ) –
C3H8 (газ): увеличивается
Cистема, обладающая буферным действием может образоваться при смешивании растворов:
CH3COONa и NaOH; +NH3CH2COO– и KOH
Заряд комплексного иона и число лигандов в комплексном соединении Na[Cr(CN)4(H2O)2] равны соответственно: 3+ и 6
Расположите аминокислоты в порядке увеличения устойчивости комплексных соединений с ионами Zn2+, если константы устойчивости равны: Куст[Zn(Gly)2] = 9.1×109; Куст[Zn(Pro)2] = 1.6×1010;Куст[Zn(Asn)2] = 5×108: Asn – Gly- Pro
Оцените истинность суждений:
A. процессы, в результате которых упорядоченность системы возрастает, сопровождаются увеличением энтропии - неверно
B.при растворении кристаллических тел в жидкости энтропия системы, как правило, увеличивается - верно
C.стандартная энтальпия реакции нейтрализации положительна - неверно
D.эндотермические реакции не могут протекать самопроизвольно, если изменение энтропии реакции отрицательно - верно
Восстановительный потенциал системы 2 BrO3–+ 12 H+ + 10 е ⇄ Br2 + 6 H2O повышается при: уменьшении рН раствора; увеличении концентрации ионов ВrO3
Количество вещества нитрата натрия, которое содержится в 300 мл 0.12 М раствора NaNO3, равно: 0.036 моль
Растворимость газообразных веществ в воде (л/1 л Н2О) зависит от: температуры
При добавлении 90 г воды к 10 г 40 %-го раствора серной кислоты образуется раствор с массовой долей H2SO4: 4 %
В агрегативно устойчивых системах: силы отталкивания преобладают над силами притяжения
Соотнесите термины и определения:
A.число частиц, участвующих в элементарном акте реакции - молекулярность
B. самая медленная стадия реакции - лимитирующая стадия процесса
C.время, за которое прореагирует половина исходного вещества - период полупревращения
Осмотическое давление при 25 оС в ряду растворов 0.1 М K2SO4 – 0.1 М KBr – 0.1 М С6Н12О6: уменьшается
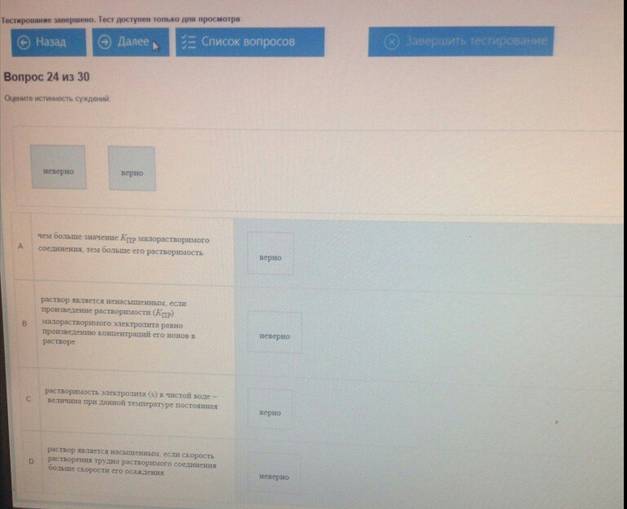
Оцените истинность суждений:
A.первым из раствора осаждается тот электролит, для достижения константы растворимости (КПР) которого требуются наименьшие концентрации ионов - неверно
B. понижение давления над раствором малорастворимого соединения способствует растворению осадка - неверно
C. осадок малорастворимого сильного электролита образуется, если Пс > КПР - верно
D. на растворимость веществ не влияет присутствие в растворе других солей - верно
Осмотическое давление при 25 оС в ряду растворов 0.2 М С12Н22О11 – 0.2 М MgSO4 – 0.2 М Na2SO4: уменьшается
Оцените истинность суждений:
А. Ацидоз – нарушение КОС организма, обусловленное повышением рН биологических жидкостей. – неверно
В. Буферная емкость – количество кислоты (HCl)или щелочи (KOH), которые нужно добавить к 1л буферного раствора, чтобы значение его рН практически не изменилось – неверно
С. Диполярный ион – частица, несущая два разноименных заряда – верно
Окислительные свойства системы MnO4– + 8 H+ + 5 е– ⇄ Mn2+ + 4 H2O усиливаются при: увеличении концентрации ионов MnO4–;уменьшении рН раствора
Величина стандартной молярной энтропии в ряду веществ C6H14 (газ) – C6H12 (газ) – C6H6 (газ) – C6H6 (ж):
изменяется немонотонно
При одинаковой температуре изотоническими являются два раствора:0.3 M C6H12O6 и 0.1 M CaCl2
Масса глюкозы, которая содержится в 200 мл 0.3 M раствора С6Н12О6 (М = 180 г/моль), равна: 10.8 г
Гидрофосфатная буферная система может быть получена при смешивании растворов:NaH2PO4 и Na2HPO4
Система Cr2O72– + 14 H+ + 6 е– ⇄ 2 Cr3+ + 7 H2O (Еo = +1.33 В) в окислительно-восстановительных реакциях при стандартных условиях может выступать в качестве восстановителя по отношению к системам:
2 BrO3– + 12 H+ + 10 е– ⇄ Br2 + 6 H2O (Еo = +1.52 В)
2 ClO3– + 12 H+ + 10 е– ⇄ Cl2 + 6 H2O (Еo = +1.47 В)
Состояние химического равновесия в стандартных условиях характеризует условие:ΔН0 = Т∙ΔS0
Осмотическое давление при 25 оС в ряду растворов 0.2 M CaCl2 – 0.2 M NaCl – 0.2 M C6H12O6:уменьшается
Выберите правильные утверждения:
кислота, отдавая протон, превращается в сопряженное ей основание
более сильному основанию соответствует большее значение рКВН+
Схема строения мицеллы золя, полученного при смешивании раствора сульфата алюминия и избытка раствора фосфата натрия, имеет вид{[(mAlPO4)∙nPO43–∙3(n – x)Na+]∙3xNa+}
Образование двойного электрического слоя на межфазной границе сопровождается:уменьшением энергии Гиббса системы
142. Оцените истинность суждений:
A. осмотическое давление золя при одинаковой массе дисперсной фазы тем меньше, чем крупнее частицы - верно
B. к дисперсным системам с жидкой дисперсной фазой и жидкой дисперсионной средой относятся туманы и облака - неверно
C. значения осмотического давления 0.05 моль сульфата натрия и хлорида кальция при одинаковой температуре равны между собой - верно
D. в гипертоническом растворе эритроциты сохраняют свою форму и размеры - неверно
Cистема, обладающая буферным действием может образоваться при смешивании растворов:Na3PO4 и Na2HPO4
144. Схема строения мицеллы положительного золя оксалата кальция, полученного при взаимодействии хлорида кальция с оксалатом натрия имеет вид:
A. {[(mCaC2O4)∙nC2O42–∙(2n – x)Na+]∙xNa+}
B. {[(mCaC2O4)∙nCa2+∙(2n – x)Cl–]∙xCl–}+
C. {[(mCaC2O4)∙nNa+∙(n – x)Cl−∙xCl−}
D. {[(mCaC2O4)∙nCa2+∙(n – x)C2O42–]∙xC2O42–}
145. Эндотермическую реакцию однозначно характеризует выражение:
A. ΔH < 0
B. ΔH > 0+
C. ΔS < 0
D. ΔG = 0
146. Осмотическое давление при 25 оС в ряду растворов 0.1 М CaCl2 – 0.1 М CH3COOH – 0.1 М KCl:
A. не изменяется
B. возрастает
C. уменьшается
D. изменяется немонотонно+
147. Если в обратимом процессе прямая реакция эндотермическая, то величина Kс для нее при понижении температуры:
A. уменьшится+
B. увеличится
C. не изменится
D. нельзя определить
148. Оцените истинность суждений:
A. диамины, аминоспирты, α-аминокислоты являются бидентатными лигандами+
B. центральный атом (комплексообразователь) – это атом или ион, который является донором электронных пар для образования ионной связи
C. комплексные соединения содержат в своем составе комплексную частицу, состоящую из центрального атома или иона-комплексообразователя и лигандов +
D. металлоферменты, выполняющие в организме роль катализаторов биохимических процессов, по своей природе не являются координационными соединениями
149. Оцените истинность суждений:
A. золи – это дисперсные системы с жидкой дисперсионной средой и твердой дисперсной+ фазой
B. осмотическое давление золя обратно пропорционально размеру частиц дисперсной фазы+
C. плазмолиз – это явление сморщивания (обезвоживания) эритроцитов в гипертоническом растворе
D. осмотическое давление раствора, в котором происходит гидролиз белка, уменьшается с течением времени
150. Величина стандартной молярной энтропии в ряду веществ CH4 (газ) – CH3Cl (газ) – CH2Cl2 (газ) – CHCl3 (газ):
A. увеличивается
B. уменьшается+?
C. изменяется незначительно
D. изменяется немонотонно
151. Установите соответствие между формулой частицы и кислотно-основными свойствами, которые она может проявлять в водном растворе: (PO4 3- , HCOOH , NH2CH2COOH )
A. только основания PO4 3-
B. только кислоты HCOOH
C. и кислоты, и основания NH2CH2COOH
152. На поверхности кристалла карбоната бария из водного раствора будут преимущественно адсорбироваться ионы:
A. Na+
B. Ba2+ +
C. Cl–
D. Zn2+
153. Период полупревращения реакции первого порядка составляет 20 минут. За какое время прореагирует 75% вещества?
C. 60 минут
154. Растворимость газообразных веществ в воде (л/1 л Н2О) зависит от:
A. объема газа;
B. массы газа
C. массы воды
D. температуры +
155. Количество вещества нитрата натрия, которое содержится в 300 мл 0.12 М раствора NaNO3, равно:
A. 0.036 моль +?
B. 3.6 моль
C. 0.36 моль
D. 0.4 моль
156. Расположите соединения в порядке увеличения молярной растворимости в воде, если константы произведения растворимости равны: КПР(PbCO3) = 7.4×10–14; КПР(MgCO3) = 7×10–6; КПР(FeCO3) = 5×10–11 (PbCO3 , MgCO3 , FeCO3 )
1. PbCO3
2. FeCO3
3. MgCO3
157. Оцените истинность суждений:
A. изменение энтальпии химической реакции нельзя определять экспериментально
B. энтропия есть мера вероятности пребывания системы в данном состоянии или мера неупорядоченности системы +
158. Седиментационная устойчивость дисперсных систем обусловлена:
D. размером частиц; +
159. Поверхностное натяжение на границе жидкость – воздух не зависит от:
A. площади поверхности раздела фаз +
B. температуры
C. природы веществ, растворенных в жидкости
D. природы жидкости
160. Система CH3C(O)COO– + 2 H++ 2 е– ⇄ CH3CH(OH)COO– (Еo = +0.228 В) в окислительно-восстановительных реакциях при стандартных условиях может выступать в качестве окислителя по отношению к системам:
A. I2 + 2е– ⇄ 2I– (Еo = +0.54 B)
B. C6H4O2 + 2 H+ + 2 е– ⇄ C6H6O2 (Еo = +0.699 В)
C. CO2 + 2 H+ + 2 е– ⇄ HCOOH (Еo = –0.006 В). +
D. HCOH + 2 H+ + 2е– ⇄ CH3OH (Еo = +0.197 B) +
------------------------------
161. Восстановительные свойства системы O2 +2 H+ + 2e– ⇄ H2O2 усиливаются при:
A. увеличении концентрации H2O2
B. увеличении рН раствора +
C. увеличении концентрации H2O2 +
D. уменьшении рН раствора
162. Если для некоторой обратимой реакции при 298 К константа равновесия Kс > 1, то:
A. ΔS0 > 0
B. ΔG0 = 0
C. ΔН0 = Т∙ΔS0
D. ΔН0< Т∙ΔS0 +
163. Оцените истинность суждений:
A. экзотермические реакции могут протекать самопроизвольно при любых температурах, если изменение энтропии реакции положительно (+)
B. самопроизвольному протеканию процесса в закрытой системе способствует увеличение энтальпии (-)
C. молярная энтропия жидкого вещества меньше, чем энтропия его в твердом состоянии (-)
D. стандартная энтальпия сгорания глюкозы отрицательна (+)
164. Количество вещества сульфата магния, которое содержится в 3 л 0.15 М раствора MgSO4, равно:
A. 0.45 моль +
B. 0.05 моль
C. 0.5 моль
D. 0.15 моль
165. Заряд комплексного иона и число лигандов в комплексном соединении [Cu(NH3)2(H2O)2] равны соответственно:
A. 0 и 2
B. 0 и 4 +
C. 2+ и 4
D. 1+ и 2
166. При повышении температуры константа равновесия СН3СОН(газ) + H2 (газ) ⇄ С2Н5ОН(газ), (ΔH < 0)
A. нельзя определить
B. увеличится
C. уменьшится +
D. не изменится
--------------------
167. Восстановительный потенциал системы SO42– + 4 H+ + 2 е– ⇄ H2SO3 + H2O понижается при:
A. увеличении рН раствора
B. уменьшении концентрации ионов SO42–
168. Система 2 IO3– + 12 H+ + 10 е– ⇄ I2 + 6 H2O (Еo = +1.195 В) в окислительно-восстановительных реакциях при стандартных условиях может выступать в качестве восстановителя по отношению к системам:
B. 2 BrO3– + 12 H+ + 10 е– ⇄ Br2 + 6 H2O (Еo = +1.52 В)
D. 2 ClO3– + 12 H+ + 10 е– ⇄ Cl2 + 6 H2O (Еo = +1.47 В)
169. Осмотическое давление при 25 оС в ряду растворов 0.1 M HCOOH – 0.1 M Na2SO4 – 0.1 M C6H12O6:
A. изменяется немонотонно
170. Расположите лиганды в порядке увеличения устойчивости комплексов с ионами Hg2+, если константы устойчивости комплексных ионов равны: Куст[Hg(CN)4]2– = 2.5×1041; Куст[HgCl4]2– = 1.2×1015; Куст[Hg(NH3)4]2+ = 1.9×1019 (NH3 , CN- , Cl- )
1. CN-
2. NH3
3. Cl-
171. Адсорбция аммиака на активированном угле из газовой смеси (∆Hадс < 0) понижается при
C. уменьшении концентрации аммиака в газовой смеси
D. повышении температуры
172. Величина φ-потенциала мицелл положительного золя AgCl при добавлении к нему небольшого количества KNO3:
A. не изменится
173. Наименьший порог коагуляции по отношению к положительному золю гидроксида железа имеет электролит:
D. CH3COONa(?)
174. Соотнесите термины и определения: (порядок реакции, скорость реакции, тримолекулярная реакция)
A. сумма порядков всех веществ в кинетическом уравнении – порядок реакции
B. реакция, элементарный акт которой включает взаимодействие трех частиц – тримолекулярная реакция
C. изменение количества вещества какого-либо участника реакции за единицу времени в единице объема – скорость реакции
175. рКа(HNO2) = 3.14; рКа(C3H7COOH) = 4.82; рКа(HCN) = 9.2. Как изменяется сила кислот в ряду HNO2 – C3H7COOH – HCN?
B. увеличивается(?)
176. Выберите интервал рН буферного действия системы +NH3CH2COOН / +NH3CH2COO–, если для глицина pKa1 = 2.3; pKa2 = 9.6
A. 1.3 – 3.3
177. Соотнесите вещества со значениями рН их водных растворов одинаковой молярной концентрации: (Ba(OH)2 , NH3, HF )
A. 10.6 : NH3
B. 2.6 : HF
C. 12.3 : Ba(OH)2
178. Кинетическое уравнение простой реакции 2 NО(газ) + Сl2 (газ) → 2 NOCl(газ) имеет вид:
D. v = k·c1^2 (в кв)·c2
179. Заряд комплексного иона и число лигандов в комплексном соединении Na[Fe(SCN)4(H2O)2] равнысоответственно:
B. 3+ и 6
180. Соотнесите основания из левой колонки с кислотами из правой колонки так, чтобы они образовывали сопряженную кислотно-основную пару: (HSO4- , SO4- , C2H5CH(NH3+)COO- )
A. HSO4– : SO4 2-
B. H2SO4 : HSO4-
C.C2H5CH(NH3+)COOH : C2H5CH(NH3+)COO-
181. рКBH+(C5H5N) = 5.17; рКBH+(CH3NH2) = 10.62; рКBH+[(CН3)2NH] = 10.77. Как изменяется сила оснований в ряду C5H5N – CH3NH2 – (CН3)2NH?
B. увеличивается
182. Схема строения мицеллы золя, полученного в результате реакции гидроксида натрия с избытком сульфата магния, имеет вид:
B.{[(mMg(OH)2)∙nMg2+∙(n – x) SO42–]∙xSO42–}
183. Молярная концентрация вещества Х в растворе, с(Х), соответствует:
D. количеству вещества Х (моль), которое содержится в 1 л раствора
184. Электротермодинамический потенциал создают:
C.потенциалопределяющие ионы
185. Восстановительный потенциал системы SO42– + 4 H+ + 2 е– ⇄ H2SO3 + H2O понижается при:
C. увеличении рН раствора
D. уменьшении концентрации ионов SO42-
--------------------------------------------
186. Соотнесите вещества со значениями рН их водных растворов одинаковой молярной концентрации: (C2H7COONa, HI , C3H7COOH )
A.3.4 - ch3cooh
B.8.9 - hi
C.2.0 - c3h7cooh
187. Оцените истинность суждений:
A. произведение растворимости малорастворимого электролита (КПР) не зависит от присутствия в растворе одноименных ионов - НЕВЕРНО
B. увеличение давления над раствором трудно растворимого соединения способствует образованию осадка - НЕВЕРНО
C. осадок малорастворимого сильного электролита растворяется, если в Пс < КПР - ВЕРНО
D. в результате химической реакции, за счет которой происходит связывание одного из образующих осадок ионов малорастворимого сильного электролита, его растворимость уменьшается - ВЕРНО
188. Гипотоническим по отношению к плазме крови (осмолярность плазмы крови 0.3 моль/л) является раствор:
B. 0.2 M Ba(NO3)2
189. При понижении температуры константа равновесия СН3СОН(газ) + H2 (газ) ⇄ С2Н5ОН(газ), (ΔH < 0)
D. увеличится
190. Cистема, обладающая буферным действием может образоваться при смешивании растворов:
D. NH3 и NH4NO3
191. Кинетическое уравнение простой реакции I2(газ) → 2 I(газ) имеет вид:
B. v = k·с(I2)
(?) 192. Укажите систему, которую лучше использовать для приготовления буферного раствора со значением рН, равным 12.5
В. NH4Cl / NH3×H2O; pKBH+ = 9.25
193. Масса сульфата меди, которую необходимо растворить в 190 г воды для приготовления 5%-го раствора CuSO4, равна:
C. 10 г
194. Расположите лиганды в порядке увеличения устойчивости комплексов с ионами Hg2+, если константы устойчивости комплексных ионов равны: Куст[HgBr4]2– = 1×1021; Куст[HgCl4]2– = 1.2×1015; Куст[HgI4]2– = 6.8×1029 ( I- , Cl- , Br- )
1. Br
2. I
3. Cl
195. Для приготовления 1 л 0.05 М раствора HCl потребуется хлороводород объемом (н.у.):
B. 1.12 л
196. Увеличение концентрации водорода сместит равновесие вправо в системах
B. СН2O(газ) + H2 (газ) ⇄ СН3OH(ж)
197. Выберите правильные утверждения:
A. кислота, отщепляя протон, превращается в сопряженное ей основание - ВЕРНО
B. гидролиз соли – это протолитический процесс взаимодействия ионов соли с молекулами воды, приводящий к образованию слабого электролита (кислоты или основания) - ВЕРНО
C. рКа(C6H5OH) > рКа(CH3COOH), следовательно, фенол является более сильной кислотой - НЕВЕРНО
198. С повышением температуры поверхностное натяжение чистых жидкостей на поверхности жидкость-воздух:
C. уменьшается
199. Агрегативная устойчивость –– это:
C. устойчивость частиц дисперсной фазы к объединению
200. Оцените истинность суждений:
A. изменение энтальпии обратной реакции равно по величине и противоположно по знаку изменению энтальпии прямой реакции - ВЕРНО
B. самопроизвольному протеканию процесса в изолированной системе способствует увеличение энтальпии - НЕВЕРНО
C. превращения одного вида энергии в другой происходят в не эквивалентных количествах - ВЕРНО
D. при растворении газов в жидкости энтропия системы, как правило, увеличивается - НЕВЕРНО
--------------------------
201. Верны ли следующие суждения о константе произведения растворимости КПР?
А. КПР постоянна при постоянной температуре и зависит только от природы малорастворимого электролита(+)
Б. КПР — константа гетерогенного равновесия между кристаллическим осадком малорастворимой соли и ионами в ее насыщенным растворе(+)
В. Если КПР < ПС, то осадок малорастворимого соединения не образуется(-)
С. Чем больше значение КПР малорастворимого соединения, тем меньше его растворимость(-)
202. Определите степень окисления и координационное число хрома в комплексном соединении [Cr(H2O)5OH]Cl2: D.+3; 6
203. Установите соответствие между структурой комплексного соединения и классом (типом) координационных соединений, к которому оно относится: [Cr(Nh3)6][CO(CN)6] , K2[Ni(CN)4] , [Zn(NH3)4(OH)2] , [CO(NH3)6]SO4Cl
A. Нейтральные-[Zn(NH3)4(OH)2]
B. смешанного типа- [Cr(Nh3)6][CO(CN)6]
C. катионные-[CO(NH3)6]SO4Cl
D. анионные-K2[Ni(CN)4]
204. В насыщенный раствор гидроксида алюминия добавили небольшое количество раствора Na2SO4. Растворимость Al(OH)3 при этом:
A.практически не изменится
205. Соотнесите значения констант нестойкости комплексных ионов с молярными концентрациями (моль/л) ионов металлов в растворах комплексных солей равных концентраций в порядке возростанияKнест([Zn(NH3)4]2+ = 3,47*10-10Kнест([Hg(CN)4]2-)=4,0*10-12Kнест([Cd(CN)4]2-=1,66*10-19
A.([Cd(CN)4]2
B.([Hg(CN)4]2-)
C.([Zn(NH3)4]2
206. Расположите лиганды в порядке увеличения устойчивости их комплексных соединений с Cu2+, если Кнест[Cu-Glu]+ = 3,98×10–15; Кнест[Cu-Ser]+ = 2,88×10–15; Кнест[Cu-Lys]+ = 2,00×10–14? (Лизин (Lys) , Серин (Ser) , Глутаминовая кислота (Glu)_
1.(Ser)
2.Glu
3.Lys
207. Определите степень окисления и координационное число железа в комплексном соединении Na3[Fe(CN)5Cl]:
D. +3; 6
208. Определите заряд комплексного иона и число лигандов в комплексном соединении [Al(H2O)6]2(SO4)3:
D. 3+; 6
210. Определите заряд комплексного иона и число лигандов в комплексном соединении Na[Pb(CH3COO)4]:
B.3+; 4
211. Выберите окислительно–восстановительную систему, потенциал которой не зависит от рН раствора
D. Br2(aq) +2ē → 2Br–
212. Как изменится величина восстановительного потенциала системыClO3– + 6H++ 6ē → Cl– + 3H2O при уменьшении концентрации ClO3– ?
D. Уменьшится
213. Как изменится величина восстановительного потенциала системыMnO2 (тв ) + 4 H+ + 2 e– → Mn2+ + 2 H2O при увеличении рН раствора?
A.уменьшится
214. Как изменится величина восстановительного потенциала системыNO3– + 4H+ +3 ē → NO + 2H2O при увеличении рН раствора?
C.уменьшится
215. Как изменится величина восстановительного потенциала системыMnO4– + 8 H+ + 5 ē → Mn2+ + 4 H2O при уменьшении концентрации Mn2+?
A. Увеличится
216. Из нижеприведенных частиц выберите те, которые проявляют только восстановительные свойства
C. Cl–
D. Ag0
217. Величина стандартной молярной энтропии в ряду веществ N2O5 (газ) – N2O3 (газ) – N2O(газ) – N2 (газ):
D. Уменьшается
218. Восстановительные свойства системы IO3– + 3 H2O + 6 е– ⇄ I– + 6 OH– усиливаются при:
A. увеличении концентрации ионов I–
D. увеличении рН раствора
219. Соотнесите вещества с областью значений рН их водных растворов: (NaNO3 , Na2C204 , HOOC-COOH )
A. < 7 HOOC-COOH
B. > 7 Na2C204
C. ≈ 7 NaNO3
220. Оцените истинность суждений:
A. координационные связи между центральным атомом и лигандами образуются по донорно-акцепторному механизму за счет неподеленных пар лигандов и вакантных электронных орбиталей центрального атома(+)
B. координирующие атомы – это атомы, непосредственно связанные с комплексным ионом.(-)
C. лиганды – это ионы или нейтральные молекулы, присоединенные к центральному атому за счет координационных связей(-)
D. молекулы Н2О и NH3 являются монодентатными лигандами(+
)221. Величина z-потенциала частиц отрицательного золя BaSO4 при постепенном добавлении к нему раствора NaNO3 будет:
B. не будет изменяться
222. Соотнесите основания из левой колонки с кислотами из правой колонки так, чтобы они образовывали сопряженную кислотно-основную пару: (H20 , HPO4 2- , OH - )
A. H2PO4– /HPO4 2-
B. H3O+ /H20
C. H2O /OH -
223. Заряд комплексного иона и число лигандов в комплексном соединении [Zn(NH3)4](NO3)2 равны соответственно:
D.2+ и 4
224. Масса глюкозы, которую необходимо растворить в 920 г воды для приготовления 8 %-го раствора, равна:
C.80 г
225. Повышение давления вызовет смещение равновесия вправо в системе:
C. СО(газ)+ 2 Н2 (газ) ⇄СН3ОН(ж)
226. Гипертоническим по отношению к плазме крови (осмолярность плазмы крови 0.3 моль/л) является раствор:
B. 0.4 M C6H12O6
227. Для приготовления 0.2 л 5 М раствора NH3 потребуется аммиак объемом (н.у.):
D.22.4 л
228. Расположите соединения в порядке увеличения молярной концентрации ионов Pb2+ в их насыщенных водных растворах, если константы произведения растворимости равны: КПР(PbC2O4) = 3.5×10–11; КПР(PbCO3) = 7.4×10–14; КПР(PbSO4) = 2.5×10–8 (PbCO3 , PbC204 , PbSO4 )
1. PbCO3
2. PbC2O4
3. PbSO4
229.Дляфизическойадсорбциихарактерны
A. невысокая специфичность
B. экзотермичность, теплота адсорбции невелика (~10 – 40 кДж/моль)
C. обратимость
230. Выберите интервал рН буферного действия системы СH3COOH / СH3COO–, если для уксусной кислоты pKa = 4.76
D.3.8 – 5.8
131. Окислительные свойства системы MnO4– + 8 H+ + 5 е– ⇄ Mn2+ + 4 H2O усиливаются при:
A. увеличении концентрации ионов MnO4– (+)
B. увеличении рН раствора
C. уменьшении рН раствора (+)?
D. увеличении концентрации ионов Mn2 +
132. Величина стандартной молярной энтропии в ряду веществ C6H14 (газ) – C6H12 (газ) – C6H6 (газ) – C6H6 (ж):
A. увеличивается
B. изменяется немонотонно +
C. уменьшается
D. изменяется незначительно
133. При одинаковой температуре изотоническими являются два раствора:
A. 2 % CaCl2 и 2 % MgCl2;
B. 0.3 M C6H12O6 и 0.3 M HCOOH;
C. 0.3 M C6H12O6 и 0.1 M CaCl2 +
D. 0.1 M CaCl2 и 0.1 M NaCl
134. Масса глюкозы, которая содержится в 200 мл 0.3 M раствора С6Н12О6 (М = 180 г/моль), равна:
A. 90 г
B. 10.8 г +
C. 9 г
D. 18 г
135. Гидрофосфатная буферная система может быть получена при смешивании растворов:
A. NaH2PO4 и NaCl
B. NaH2PO4 и Na2HPO4 +
C. Na2HPO4 и HCl
D. NaH2PO4 и NaOH
136. Система Cr2O72– + 14 H+ + 6 е– ⇄ 2 Cr3+ + 7 H2O (Еo = +1.33 В) в окислительно-восстановительных реакциях при стандартных условиях может выступать в качестве восстановителя по отношению к системам:
A. 2 BrO3– + 12 H+ + 10 е– ⇄ Br2 + 6 H2O (Еo = +1.52 В) +
B. 2 ClO3– + 12 H+ + 10 е– ⇄ Cl2 + 6 H2O (Еo = +1.47 В) +
C. Br2 + 2 е– ⇄ 2Br– (Еo = +1.08 В)
D. Fe3+ + е– ⇄ Fe2+ (Еo = +0.77 В)
137. Состояние химического равновесия в стандартных условиях характеризует условие:
A. ΔG > 0
B. Кс > 1
C. ΔН0 = Т∙ΔS0 +
D. ΔS > 0
138. Осмотическое давление при 25 оС в ряду растворов 0.2 M CaCl2 – 0.2 M NaCl – 0.2 M C6H12O6:
A. уменьшается +
B. не изменяется
C. изменяется немонотонно
D. возрастает
139. Выберите правильные утверждения:
A. кислота, отдавая протон, превращается в сопряженное ей основание +
B. более сильному основанию соответствует большее значение рКВН+ +
C. повышение температуры способствует равновесия реакции нейтрализации смещению в прямом направлении ( -)
140. Схема строения мицеллы золя, полученного при смешивании раствора сульфата алюминия и избытка раствора фосфата натрия, имеет вид
A.{[(mAlPO4)∙nPO43–∙3(n – x)Na+]∙3xNa+} +
B. {[(mAlPO4)∙nSO42–∙2(n – x)Na+]∙2xNa+}
C. {[(mAl2(SO4)3)∙nPO43–∙3(n – x)Na+]∙3xNa+}
D. {[(mAlPO4)∙3nNa+∙(n – x)PO43–]∙xPO43–}
-------------------------------------------
141. Образование двойного электрического слоя на межфазной границе сопровождается:
увеличением поверхностного натяжения
уменьшением энергии Гиббса системы +
C. выделением теплоты
D. концентрированием дисперсной системы
142. Оцените истинность суждений:
A. осмотическое давление золя при одинаковой массе дисперсной фазы тем меньше, чем крупнее частицы+
B. к дисперсным системам с жидкой дисперсной фазой и жидкой дисперсионной средой относятся туманы и облака
C. значения осмотического давления 0.05 моль сульфата натрия и хлорида кальция при одинаковой температуре равны между собой+?
D. в гипертоническом растворе эритроциты сохраняют свою форму и размеры
143. Cистема, обладающая буферным действием может образоваться при смешивании растворов:
A. KHCO3 и KCl
B. Na3PO4 и NaOH
C. Na3PO4 и Na2HPO4+
D. KHCO3 и NaOH
144. Схема строения мицеллы положительного золя оксалата кальция, полученного при взаимодействии хлорида кальция с оксалатом натрия имеет вид:
A. {[(mCaC2O4)∙nC2O42–∙(2n – x)Na+]∙xNa+}
B. {[(mCaC2O4)∙nCa2+∙(2n – x)Cl–]∙xCl–}+
C. {[(mCaC2O4)∙nNa+∙(n – x)Cl−∙xCl−}
D. {[(mCaC2O4)∙nCa2+∙(n – x)C2O42–]∙xC2O42–}
145. Эндотермическую реакцию однозначно характеризует выражение:
A. ΔH < 0
B. ΔH > 0+
C. ΔS < 0
D. ΔG = 0
146. Осмотическое давление при 25 оС в ряду растворов 0.1 М CaCl2 – 0.1 М CH3COOH – 0.1 М KCl:
A. не изменяется
B. возрастает
C. уменьшается
D. изменяется немонотонно+
147. Если в обратимом процессе прямая реакция эндотермическая, то величина Kс для нее при понижении температуры:
A. уменьшится+
B. увеличится
C. не изменится
D. нельзя определить
148. Оцените истинность суждений:
A. диамины, аминоспирты, α-аминокислоты являются бидентатными лигандами+
B. центральный атом (комплексообразователь) – это атом или ион, который является донором электронных пар для образования ионной связи
C. комплексные соединения содержат в своем составе комплексную частицу, состоящую из центрального атома или иона-комплексообразователя и лигандов +
D. металлоферменты, выполняющие в организме роль катализаторов биохимических процессов, по своей природе не являются координационными соединениями
149. Оцените истинность суждений:
A. золи – это дисперсные системы с жидкой дисперсионной средой и твердой дисперсной+ фазой
B. осмотическое давление золя обратно пропорционально размеру частиц дисперсной фазы+
C. плазмолиз – это явление сморщивания (обезвоживания) эритроцитов в гипертоническом растворе
D. осмотическое давление раствора, в котором происходит гидролиз белка, уменьшается с течением времени
150. Величина стандартной молярной энтропии в ряду веществ CH4 (газ) – CH3Cl (газ) – CH2Cl2 (газ) – CHCl3 (газ):
A. увеличивается
B. уменьшается+?
C. изменяется незначительно
D. изменяется немонотонно
151. Установите соответствие между формулой частицы и кислотно-основными свойствами, которые она может проявлять в водном растворе: (PO4 3- , HCOOH , NH2CH2COOH )
A. только основания PO4 3-
B. только кислоты HCOOH
C. и кислоты, и основания NH2CH2COOH
152. На поверхности кристалла карбоната бария из водного раствора будут преимущественно адсорбироваться ионы:
A. Na+
B. Ba2+ +
C. Cl–
D. Zn2+
153. Период полупревращения реакции первого порядка составляет 20 минут. За какое время прореагирует 75% вещества?
C. 60 минут
154. Растворимость газообразных веществ в воде (л/1 л Н2О) зависит от:
A. объема газа;
B. массы газа
C. массы воды
D. температуры +
155. Количество вещества нитрата натрия, которое содержится в 300 мл 0.12 М раствора NaNO3, равно:
A. 0.036 моль +?
B. 3.6 моль
C. 0.36 моль
D. 0.4 моль
156. Расположите соединения в порядке увеличения молярной растворимости в воде, если константы произведения растворимости равны: КПР(PbCO3) = 7.4×10–14; КПР(MgCO3) = 7×10–6; КПР(FeCO3) = 5×10–11 (PbCO3 , MgCO3 , FeCO3 )
1. PbCO3
2. FeCO3
3. MgCO3
157. Оцените истинность суждений:
A. изменение энтальпии химической реакции нельзя определять экспериментально
B. энтропия есть мера вероятности пребывания системы в данном состоянии или мера неупорядоченности системы +
158. Седиментационная устойчивость дисперсных систем обусловлена:
D. размером частиц; +
159. Поверхностное натяжение на границе жидкость – воздух не зависит от:
A. площади поверхности раздела фаз +
B. температуры
C. природы веществ, растворенных в жидкости
D. природы жидкости
160. Система CH3C(O)COO– + 2 H++ 2 е– ⇄ CH3CH(OH)COO– (Еo = +0.228 В) в окислительно-восстановительных реакциях при стандартных условиях может выступать в качестве окислителя по отношению к системам:
A. I2 + 2е– ⇄ 2I– (Еo = +0.54 B)
B. C6H4O2 + 2 H+ + 2 е– ⇄ C6H6O2 (Еo = +0.699 В)
C. CO2 + 2 H+ + 2 е– ⇄ HCOOH (Еo = –0.006 В). +
D. HCOH + 2 H+ + 2е– ⇄ CH3OH (Еo = +0.197 B) +
------------------------------
161. Восстановительные свойства системы O2 +2 H+ + 2e– ⇄ H2O2 усиливаются при:
A. увеличении концентрации H2O2
B. увеличении рН раствора +
C. увеличении концентрации H2O2 +
D. уменьшении рН раствора
162. Если для некоторой обратимой реакции при 298 К константа равновесия Kс > 1, то:
A. ΔS0 > 0
B. ΔG0 = 0
C. ΔН0 = Т∙ΔS0
D. ΔН0< Т∙ΔS0 +
163. Оцените истинность суждений:
A. экзотермические реакции могут протекать самопроизвольно при любых температурах, если изменение энтропии реакции положительно (+)
B. самопроизвольному протеканию процесса в закрытой системе способствует увеличение энтальпии (-)
C. молярная энтропия жидкого вещества меньше, чем энтропия его в твердом состоянии (-)
D. стандартная энтальпия сгорания глюкозы отрицательна (+)
164. Количество вещества сульфата магния, которое содержится в 3 л 0.15 М раствора MgSO4, равно:
A. 0.45 моль +
B. 0.05 моль
C. 0.5 моль
D. 0.15 моль
165. Заряд комплексного иона и число лигандов в комплексном соединении [Cu(NH3)2(H2O)2] равны соответственно:
A. 0 и 2
B. 0 и 4 +
C. 2+ и 4
D. 1+ и 2
166. При повышении температуры константа равновесия СН3СОН(газ) + H2 (газ) ⇄ С2Н5ОН(газ), (ΔH < 0)
A. нельзя определить
B. увеличится
C. уменьшится +
D. не изменится
--------------------
167. Восстановительный потенциал системы SO42– + 4 H+ + 2 е– ⇄ H2SO3 + H2O понижается при:
A. увеличении рН раствора
B. уменьшении концентрации ионов SO42–
168. Система 2 IO3– + 12 H+ + 10 е– ⇄ I2 + 6 H2O (Еo = +1.195 В) в окислительно-восстановительных реакциях при стандартных условиях может выступать в качестве восстановителя по отношению к системам:
B. 2 BrO3– + 12 H+ + 10 е– ⇄ Br2 + 6 H2O (Еo = +1.52 В)
D. 2 ClO3– + 12 H+ + 10 е– ⇄ Cl2 + 6 H2O (Еo = +1.47 В)
169. Осмотическое давление при 25 оС в ряду растворов 0.1 M HCOOH – 0.1 M Na2SO4 – 0.1 M C6H12O6:
A. изменяется немонотонно
170. Расположите лиганды в порядке увеличения устойчивости комплексов с ионами Hg2+, если константы устойчивости комплексных ионов равны: Куст[Hg(CN)4]2– = 2.5×1041; Куст[HgCl4]2– = 1.2×1015; Куст[Hg(NH3)4]2+ = 1.9×1019 (NH3 , CN- , Cl- )
1. CN-
2. NH3
3. Cl-
171. Адсорбция аммиака на активированном угле из газовой смеси (∆Hадс < 0) понижается при
C. уменьшении концентрации аммиака в газовой смеси
D. повышении температуры
172. Величина φ-потенциала мицелл положительного золя AgCl при добавлении к нему небольшого количества KNO3:
A. не изменится
173. Наименьший порог коагуляции по отношению к положительному золю гидроксида железа имеет электролит:
D. CH3COONa(?)
174. Соотнесите термины и определения: (порядок реакции, скорость реакции, тримолекулярная реакция)
A. сумма порядков всех веществ в кинетическом уравнении – порядок реакции
B. реакция, элементарный акт которой включает взаимодействие трех частиц – тримолекулярная реакция
C. изменение количества вещества какого-либо участника реакции за единицу времени в единице объема – скорость реакции
175. рКа(HNO2) = 3.14; рКа(C3H7COOH) = 4.82; рКа(HCN) = 9.2. Как изменяется сила кислот в ряду HNO2 – C3H7COOH – HCN?
B. увеличивается(?)
176. Выберите интервал рН буферного действия системы +NH3CH2COOН / +NH3CH2COO–, если для глицина pKa1 = 2.3; pKa2 = 9.6
A. 1.3 – 3.3
177. Соотнесите вещества со значениями рН их водных растворов одинаковой молярной концентрации: (Ba(OH)2 , NH3, HF )
A. 10.6 : NH3
B. 2.6 : HF
C. 12.3 : Ba(OH)2
178. Кинетическое уравнение простой реакции 2 NО(газ) + Сl2 (газ) → 2 NOCl(газ) имеет вид:
D. v = k·c1^2 (в кв)·c2
179. Заряд комплексного иона и число лигандов в комплексном соединении Na[Fe(SCN)4(H2O)2] равны соответственно:
B. 3+ и 6
180. Соотнесите основания из левой колонки с кислотами из правой колонки так, чтобы они образовывали сопряженную кислотно-основную пару: (HSO4- , SO4- , C2H5CH(NH3+)COO- )
A. HSO4– : SO4 2-
B. H2SO4 : HSO4-
C.C2H5CH(NH3+)COOH : C2H5CH(NH3+)COO-
181. рКBH+(C5H5N) = 5.17; рКBH+(CH3NH2) = 10.62; рКBH+[(CН3)2NH] = 10.77. Как изменяется сила оснований в ряду C5H5N – CH3NH2 – (CН3)2NH?
B. увеличивается
182. Схема строения мицеллы золя, полученного в результате реакции гидроксида натрия с избытком сульфата магния, имеет вид:
B.{[(mMg(OH)2)∙nMg2+∙(n – x) SO42–]∙xSO42–}
183. Молярная концентрация вещества Х в растворе, с(Х), соответствует:
D. количеству вещества Х (моль), которое содержится в 1 л раствора
184. Электротермодинамический потенциал создают:
C.потенциалопределяющие ионы
185. Восстановительный потенциал системы SO42– + 4 H+ + 2 е– ⇄ H2SO3 + H2O понижается при:
C. увеличении рН раствора
D. уменьшении концентрации ионов SO42-
--------------------------------------------
186. Соотнесите вещества со значениями рН их водных растворов одинаковой молярной концентрации: (C2H7COONa, HI , C3H7COOH )
A.3.4 - ch3cooh
B.8.9 - hi
C.2.0 - c3h7cooh
187. Оцените истинность суждений:
A. произведение растворимости малорастворимого электролита (КПР) не зависит от присутствия в растворе одноименных ионов - НЕВЕРНО
B. увеличение давления над раствором трудно растворимого соединения способствует образованию осадка - НЕВЕРНО
C. осадок малорастворимого сильного электролита растворяется, если в Пс < КПР - ВЕРНО
D. в результате химической реакции, за счет которой происходит связывание одного из образующих осадок ионов малорастворимого сильного электролита, его растворимость уменьшается - ВЕРНО
188. Гипотоническим по отношению к плазме крови (осмолярность плазмы крови 0.3 моль/л) является раствор:
B. 0.2 M Ba(NO3)2
189. При понижении температуры константа равновесия СН3СОН(газ) + H2 (газ) ⇄ С2Н5ОН(газ), (ΔH < 0)
D. увеличится
190. Cистема, обладающая буферным действием может образоваться при смешивании растворов:
D. NH3 и NH4NO3
191. Кинетическое уравнение простой реакции I2(газ) → 2 I(газ) имеет вид:
B. v = k·с(I2)
(?) 192. Укажите систему, которую лучше использовать для приготовления буферного раствора со значением рН, равным 12.5
В. NH4Cl / NH3×H2O; pKBH+ = 9.25
193. Масса сульфата меди, которую необходимо растворить в 190 г воды для приготовления 5%-го раствора CuSO4, равна:
C. 10 г
194. Расположите лиганды в порядке увеличения устойчивости комплексов с ионами Hg2+, если константы устойчивости комплексных ионов равны: Куст[HgBr4]2– = 1×1021; Куст[HgCl4]2– = 1.2×1015; Куст[HgI4]2– = 6.8×1029 ( I- , Cl- , Br- )
1. Br
2. I
3. Cl
195. Для приготовления 1 л 0.05 М раствора HCl потребуется хлороводород объемом (н.у.):
B. 1.12 л
196. Увеличение концентрации водорода сместит равновесие вправо в системах
B. СН2O(газ) + H2 (газ) ⇄ СН3OH(ж)
197. Выберите правильные утверждения:
A. кислота, отщепляя протон, превращается в сопряженное ей основание - ВЕРНО
B. гидролиз соли – это протолитический процесс взаимодействия ионов соли с молекулами воды, приводящий к образованию слабого электролита (кислоты или основания) - ВЕРНО
C. рКа(C6H5OH) > рКа(CH3COOH), следовательно, фенол является более сильной кислотой - НЕВЕРНО
198. С повышением температуры поверхностное натяжение чистых жидкостей на поверхности жидкость-воздух:
C. уменьшается
199. Агрегативная устойчивость –– это:
C. устойчивость частиц дисперсной фазы к объединению
200. Оцените истинность суждений:
A. изменение энтальпии обратной реакции равно по величине и противоположно по знаку изменению энтальпии прямой реакции - ВЕРНО
B. самопроизвольному протеканию процесса в изолированной системе способствует увеличение энтальпии - НЕВЕРНО
C. превращения одного вида энергии в другой происходят в не эквивалентных количествах - ВЕРНО
D. при растворении газов в жидкости энтропия системы, как правило, увеличивается - НЕВЕРНО
--------------------------
201. Верны ли следующие суждения о константе произведения растворимости КПР?
А. КПР постоянна при постоянной температуре и зависит только от природы малорастворимого электролита(+)
Б. КПР — константа гетерогенного равновесия между кристаллическим осадком малорастворимой соли и ионами в ее насыщенным растворе(+)
В. Если КПР < ПС, то осадок малорастворимого соединения не образуется(-)
С. Чем больше значение КПР малорастворимого соединения, тем меньше его растворимость(-)
202. Определите степень окисления и координационное число хрома в комплексном соединении [Cr(H2O)5OH]Cl2: D.+3; 6
203. Установите соответствие между структурой комплексного соединения и классом (типом) координационных соединений, к которому оно относится: [Cr(Nh3)6][CO(CN)6] , K2[Ni(CN)4] , [Zn(NH3)4(OH)2] , [CO(NH3)6]SO4Cl
A. Нейтральные-[Zn(NH3)4(OH)2]
B. смешанного типа- [Cr(Nh3)6][CO(CN)6]
C. катионные-[CO(NH3)6]SO4Cl
D. анионные-K2[Ni(CN)4]
204. В насыщенный раствор гидроксида алюминия добавили небольшое количество раствора Na2SO4. Растворимость Al(OH)3 при этом:
A.практически не изменится
205. Соотнесите значения констант нестойкости комплексных ионов с молярными концентрациями (моль/л) ионов металлов в растворах комплексных солей равных концентраций в порядке возростанияKнест([Zn(NH3)4]2+ = 3,47*10-10Kнест([Hg(CN)4]2-)=4,0*10-12Kнест([Cd(CN)4]2-=1,66*10-19
A.([Cd(CN)4]2
B.([Hg(CN)4]2-)
C.([Zn(NH3)4]2
206. Расположите лиганды в порядке увеличения устойчивости их комплексных соединений с Cu2+, если Кнест[Cu-Glu]+ = 3,98×10–15; Кнест[Cu-Ser]+ = 2,88×10–15; Кнест[Cu-Lys]+ = 2,00×10–14? (Лизин (Lys) , Серин (Ser) , Глутаминовая кислота (Glu)_
1.(Ser)
2.Glu
3.Lys
207. Определите степень окисления и координационное число железа в комплексном соединении Na3[Fe(CN)5Cl]:
D. +3; 6
208. Определите заряд комплексного иона и число лигандов в комплексном соединении [Al(H2O)6]2(SO4)3:
D. 3+; 6
210. Определите заряд комплексного иона и число лигандов в комплексном соединении Na[Pb(CH3COO)4]:
B.3+; 4
211. Выберите окислительно–восстановительную систему, потенциал которой не зависит от рН раствора
D. Br2(aq) +2ē → 2Br–
212. Как изменится величина восстановительного потенциала системыClO3– + 6H++ 6ē → Cl– + 3H2O при уменьшении концентрации ClO3– ?
D. Уменьшится
213. Как изменится величина восстановительного потенциала системыMnO2 (тв ) + 4 H+ + 2 e– → Mn2+ + 2 H2O при увеличении рН раствора?
A.уменьшится
214. Как изменится величина восстановительного потенциала системыNO3– + 4H+ +3 ē → NO + 2H2O при увеличении рН раствора?
C.уменьшится
215. Как изменится величина восстановительного потенциала системыMnO4– + 8 H+ + 5 ē → Mn2+ + 4 H2O при уменьшении концентрации Mn2+?
A. Увеличится
216. Из нижеприведенных частиц выберите те, которые проявляют только восстановительные свойства
C. Cl–
D. Ag0
217. Величина стандартной молярной энтропии в ряду веществ N2O5 (газ) – N2O3 (газ) – N2O(газ) – N2 (газ):
D. Уменьшается
218. Восстановительные свойства системы IO3– + 3 H2O + 6 е– ⇄ I– + 6 OH– усиливаются при:
A. увеличении концентрации ионов I–
D. увеличении рН раствора
219. Соотнесите вещества с областью значений рН их водных растворов: (NaNO3 , Na2C204 , HOOC-COOH )
A. < 7 HOOC-COOH
B. > 7 Na2C204
C. ≈ 7 NaNO3
220. Оцените истинность суждений:
A. координационные связи между центральным атомом и лигандами образуются по донорно-акцепторному механизму за счет неподеленных пар лигандов и вакантных электронных орбиталей центрального атома(+)
B. координирующие атомы – это атомы, непосредственно связанные с комплексным ионом.(-)
C. лиганды – это ионы или нейтральные молекулы, присоединенные к центральному атому за счет координационных связей(-)
D. молекулы Н2О и NH3 являются монодентатными лигандами(+
)221. Величина z-потенциала частиц отрицательного золя BaSO4 при постепенном добавлении к нему раствора NaNO3 будет:
B. не будет изменяться
222. Соотнесите основания из левой колонки с кислотами из правой колонки так, чтобы они образовывали сопряженную кислотно-основную пару: (H20 , HPO4 2- , OH - )
A. H2PO4– /HPO4 2-
B. H3O+ /H20
C. H2O /OH -
223. Заряд комплексного иона и число лигандов в комплексном соединении [Zn(NH3)4](NO3)2 равны соответственно:
D.2+ и 4
224. Масса глюкозы, которую необходимо растворить в 920 г воды для приготовления 8 %-го раствора, равна:
C.80 г
225. Повышение давления вызовет смещение равновесия вправо в системе:
C. СО(газ)+ 2 Н2 (газ) ⇄СН3ОН(ж)
226. Гипертоническим по отношению к плазме крови (осмолярность плазмы крови 0.3 моль/л) является раствор:
B. 0.4 M C6H12O6
227. Для приготовления 0.2 л 5 М раствора NH3 потребуется аммиак объемом (н.у.):
D.22.4 л
228. Расположите соединения в порядке увеличения молярной концентрации ионов Pb2+ в их насыщенных водных растворах, если константы произведения растворимости равны: КПР(PbC2O4) = 3.5×10–11; КПР(PbCO3) = 7.4×10–14; КПР(PbSO4) = 2.5×10–8 (PbCO3 , PbC204 , PbSO4 )
1. PbCO3
2. PbC2O4
3. PbSO4
229.Дляфизическойадсорбциихарактерны
A. невысокая специфичность
B. экзотермичность, теплота адсорбции невелика (~10 – 40 кДж/моль)
C. обратимость
230. Выберите интервал рН буферного действия системы СH3COOH / СH3COO–, если для уксусной кислоты pKa = 4.76
D.3.8 – 5.8
61.Масса серной кислоты, которая содержится в 400 мл 0.05 M раствора Н2SO4 (М = 98 г/моль), равна:
A. 4.9 г
B. 1.96 г (ВЕРНО)
C. 9.8 г
D. 19.6 г
62. Соотнесите основания из левой колонки с кислотами из правой колонки так, чтобы они образовывали сопряженную кислотно-основную пару: (C6H5NH2 , HCO3- , CO3 2- )
A. C6H5NH3+ - C6H5NH2
B. HCO3– - CO3 2-
C. H2CO3 - HCO3-
63. Оцените истинность суждений: (верно,неверно)
A. растворы, имеющие одинаковое осмотическое давление, называются изотоническими - ВЕРНО
B. гидрофобной называется дисперсная система, в которой дисперсная фаза хорошо взаимодействует с водой -НЕВЕРНО
C. осмотическое давление раствора не зависит от температуры -НЕВЕРНО
D. при одинаковой массовой доле осмолярность раствора хлорида натрия гораздо больше осмолярности золя - ВЕРНО
64. При понижении температуры константа равновесия 2 H2O(газ) + 2 Cl2 (газ) + 4 HCl(газ) + O2 (газ), (?H > 0)
A. увеличится
B. уменьшится (ВЕРНО)
C. не изменится
D. нельзя определить
65. Поверхностное натяжение на границе жидкость – воздух не зависит от:
A. природы веществ, растворенных в жидкости
B. природы жидкости
C. температуры
D. площади поверхности раздела фаз (ВЕРНО)
31. Если в обратимом процессе для прямой реакции ΔН > 0, то величина Kс для нее при повышении температуры:
A. не изменится
+B. увеличится+
C. уменьшится
D. нельзя определить
32. Восстановительный потенциал системы NO2– + H2O + 3 е– ⇄ NO + 2 OH– повышается при:
A. увеличении концентрации ионов OH–
B. уменьшении рН раствора
C. увеличении рН раствора
+D. увеличении концентрации ионов NO2– +
33. Кинетическое уравнение реакции v = k·c(А)·c0.5(В). Соотнесите следующие выражения
[1-моль/л*сек] [2- 1] [3-1.5]
А. порядок скорости реакции – [1]
B. порядок по веществу А – [2]
C. общий порядок реакции – [3]
34. Схема строения мицеллы золя, полученного при смешивании раствора гидроксида натрия и избытка раствора сульфата меди (II), имеет вид:
A. {[(mCu(OH)2)∙nOH–∙0.5(n – x)Cu2+]∙0.5xCu2+}
+B. {[(mCu(OH)2)∙nCu2+∙(n – x)SO42–]∙xSO42–}+
C. {[(mCu(OH)2)∙nOH–∙(n – x)Na+]∙xNa+}
D. {[(mCuSO4)∙nOH–∙(n – x)Na+]∙xNa+}
35.Пептизация –– это
A. суммирование коагулирующего действия электролитов.
B. процесс слипания частиц дисперсной фазы с образованием крупных агрегатов
+C. переход свежих осадков в золи при промывании их чистой дисперсионной средой+
D. процесс, протекающий при смешивании золей с разными зарядами частиц
66. Седиментационная устойчивость золей обусловлена тем, что
-коллоидные частицы способны участвовать в броуновском движении
67. Оцените истинность суждений: (верно, неверно)
-в растворе комплексного соединения всегда присутствуют только комплексные частицы (неверно)
-полидентатные лиганды связываются с ионами металла гораздо прочнее, чем монодентатные лиганды с теми же донорными атомами (верно)
-для характеристики лигандов используются понятия координационное число и валентность (неверно) -центральный атом (комплексообразователь) – это атом или ион, который является акцептором электронных пар, предоставляемых лигандами (верно)
68. Схема строения мицеллы золя, полученного по реакции NaBr + AgNO3(изб) = AgBr + NaNO3 имеет вид:
- {[(mAgBr)∙nAg+∙(n – x)NO3–]∙xNO3–}
69. Увеличение концентрации водорода сместит равновесие вправо в системах
- H2 (газ) + СН3СОН(газ) ⇄ С2Н5ОН(газ)
-СН2O(газ) + H2 (газ) ⇄ СН3OH(ж)
70. Система Cl2 + 2е– ⇄ 2Cl– (Еo = +1.36 B) в окислительно-восстановительных реакциях при стандартных условиях может выступать в качестве восстановителя по отношению к системам:
-H2O2 + 2 H+ + 2 ⇄ 2 H2O (Еo = +1.77 В)
-MnO4– + 8H+ + 5 е– ⇄ Mn2+ + 4 H2O (Еo = +1.51 В)
41. Укажите систему, которую лучше использовать для приготовления буферного раствора со значением pH, равным 5.0
- C. CH3COOH/CH3COONa; pKa=4,76
42. При добавлении 90 г воды к 10 г 40 %-го раствора серной кислоты, образуется раствор с массовой долей h2so4:
- C. 4%
43. Оценить истинность суждений: (верно, неверно)
- Хелатные комплексы-это комплексы с монголе наносными лигандами. - НЕВЕРНО
- Комплексообразователь- это атом или ион, который в комплексном соединении является акцептором электронных пар- ВЕРНО
- Дентатность лиганда определяется числом координирующих атомов в лиганде. - НЕВЕРНО
- Чем меньше константа устойчивости комплексного иона, тем меньше константа свободных ионов-комплексообразователей в растворе комлексного соединения. - ВЕРНО
44. Установите соответствие между формулой частицы и кислотно-основными свойствами, которые она может проявлять в водном растворе: HSO3-; SO3-; NH4+.
Только Кислоты;только Основания; И кислоты, и основания:
HSO3 - и кислоты, и основания
SO3- - основания
NH+ - кислоты
45. pKb[(CH3)2NH] = 3,23; pKb(C6H11Nh2) = 3,36; pKb(C6H5NH2) = 9,40.
Как изменяется сила кислот в ряду (CH3)2NH2+ - C6H11NH3+ - C6H5NH3+ ?
- A. Увеличивается
91.Расположите лиганды в порядке увеличения устойчивости комплексов с ионами Zn2+, если константы устойчивости комплексных ионов равны: Куст[Zn(CN)4]2– = 5×1016; Куст[Zn(OH)4]2– = 5×1017; Куст[Zn(NH3)4]2+ = 2.9×109 (OH- , CN- , NH3 ) 1.Куст[Zn(OH)4]2– = 5×1017 2.Куст[Zn(CN)4]2– = 5×1016 3.Куст[Zn(NH3)4]2+ = 2.9×109
92. Пептизация –– это:
-A. переход свежих осадков в золи при промывании их чистой дисперсионной средой
93. На поверхности ионных кристаллов преимущественно адсорбируются:
-ионы, входящие в состав кристаллов
94. Ацетатная буферная система может быть получена при смешивании растворов:
-CH3COOH и CH3COOK
95. Восстановительные свойства системы H2O2 + 2e– ⇄ 2 OH– усиливаются при:
- уменьшении концентрации Н2О2
110. Для приготовления 0.02 л 5 М раствора NH3 потребуется аммиак объемом (н.у.):
C. 2.24 л
111. Состояние химического равновесия в стандартных условиях характеризует условие:
B. ΔG0 = 0
112. Соотнесите вещества со значениями рН их водных растворов одинаковой молярной концентрации: (CsOH , NH3 , HNO2 )
A. 12.0 CsOH
B. 2.6 HNO3
C. 10.6 NH3
113. рКb(NH3) = 4.75; рКb(C2H5NH2) = 3.37; рКb(C6Н5NH2) = 9.4. Как изменяется сила оснований в ряду NH3 – C2H5NH2 – C6Н5NH2?
C. изменяется немонотонно
114. Выберите интервал рН буферного действия системы CO2∙H2O / HCO3–, если для угольной кислоты pKa1 = 6.4; pKa2 = 10.3
B. 5.4 – 7.4
115. Величина ζ-потенциала частиц положительного золя CaSO4 при постепенном добавлении к нему раствора CaCl2 будет:
D. сначала увеличиваться, потом уменьшаться
26. Система, обладающая буферным действием может обр. при смеш. р-ров Na3PO4 и Na2HPO4
27. Самопроизвольным явлением, сопровождающимся уменьшением площади межфазной поверхности, является стремление капель жидкости принять сферическую форму.
28. Укажите систему, которую лучше использовать для приготовления буферного раствора со значением рН, равным 2.0:
+NH3CH2COOН / +NH3CH2COO–; pKa1 = 2.3(хрень какая то, не уверен)
29. Выберите правильные утверждения:
A. при одинаковых условиях, чем сильнее кислота, тем больше рН ее раствора - Неверно
B. гидролиз соли по катиону – это реакция, обратная реакции нейтрализации слабого основания сильной кислотой - Верно
C. силу слабого основания можно охарактеризовать величиной рКВН+ - Неверно
30. Соотнесите термины и определения: (реакции первого порядка, реакции нулевого порядка, бимолекулярная реакция )
A. реакция, элементарный акт которой включает взаимодействие двух частиц - бимолекулярная реакция
B. реакции, скорость которых прямо пропорциональна концентрации реагирующего вещества - реакции первого порядка
C. реакции, скорость которых не зависят от концентрации реагирующих веществ - реакции нулевого порядка
1. Для приготовления 2 л 2.5 М раствора NH3 потребуется аммиак объемом (н.у.):
C.112 л
2. Осмотическое давление при 25 оС в ряду растворов 0.3 М С6Н12О6 – 0.15 М KCl – 0.1 М BaCl2:
C. уменьшается
3. рКBH+(NH3) = 9.25; рКBH+(CH3NH2) = 10.62; рКBH+(C6Н5NH2) = 4.60. Как изменяется сила оснований в ряду NH3 – CH3NH2 – C6Н5NH2?
C. изменяется немонотонно
4. При растворении газов в воде происходит
C. уменьшение объема системы
5. Уменьшение концентрации водорода сместит равновесие вправо в системах:
B. C4H10 (газ) ⇄ C4H8 (газ) + H2 (газ)
C. С2Н5ОН(газ) ⇄ H2 (газ) + СН3СОН(газ)
|


































