
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Выделение и очистка антител⇐ ПредыдущаяСтр 34 из 34
Для увеличения относительного количества антител обычно используют г-глобулиновую или IgG-фракции иммунной сыворотки. Наиболее полное выделение г-глобулиновой фракции без снижения ее иммунологической активности достигается при осаждении сульфатом аммония, после чего осадок длительно диализуется с частой сменой буферных растворов. Другим широко распространенным способом является осаждение полиэтиленгликолем с Air=4000-6000. В 10% -иом растворе полиэтиленгликоля происходит агрегация всех белков с Мг> ~> 150 000, в результате чего осаждаются белки г-глобулиновой фракции, а белки меньшей молекулярной массы остаются в растворе. Этот метод позволяет очень быстро получить препарат г-глобулиновой фракции антисыворотки. Способ достаточно эффективный, если препарат не подвергается хранению при низких температурах. Длительное хранение полученного препарата с сохранением иммунологической активности возможно после предварительного тщательного диализа. Антитела в большей части антигенов относятся к IgG-фракции иммунной сыворотки. С целью повышения чувствительности и специфичности анализа во многих случаях полезно использовать для сорбции на твердой фазе и для получения конъюгатов IgG-фракцию нативной сыворотки. Наиболее простой и доступный способ выделения IgG - метод ионообменной хроматографии на ДЗАЭ-сефадексе или ДЗАЭ-целлюлозе. Выделение IgG-фракции кроличьей аитисыворотки. 1. 10 мл аитисыворотки кролика разбавляют в 2 раза 0,15 M NaCl1 добавляют 6,26 г 2SO4, перемешивают и инкубируют 12-16 ч при 4°С. 2. Выпавший осадок удаляют цеитрифугироваиием, растворяют в 10 мл фосфатного буфера и затем диализуют против того же буфера в течение ночи при комнатной температуре.  3. После удаления осадка центрифугироваиием раствор наносят на колонку с ДЭАЭ-целлюлозой, уравновешенную фосфатным буфером. 4. IgG-фракцию определяют, измеряя оптическую плотность элюата при 280 им, концентрацию рассчитывают, используя коэффициент молярного поглощения е=1,5 г-'-л-см-1. Приготовление фосфатного буфера. Для выделения IgG кролика используют 50 мМ фосфатный буфер, содержащий 20 мМ ЭДТА.8 г Na2HPO4 ·2З20 н 7,4 г ЭДТА-Na растворить в 900 мл воды, довести рН до 8 IM NaOH и затем добавить воды до 1 л. Выделение антител методом иммуносорбции. Специфичность сыворотки проверяется в реакциях с используемым для иммунизации препаратом антигена и с набором близких ему по структуре химических соединений. В случае недостаточна очищенного антигена возможны неспецифические реакции, обусловленные наличием антител к применяемым антигенам. Перекрестные реакции с другими соединениями могут наблюдаться при наличии у них химических структур, близких к структуре антигенных детерминант иммуногена. Удаление неспецифических антител из антисыворотки обычно осуществляют с помощью метода адсорбции на соответствующем неспецифическом антигене. Адсорбция неспецифических антител в реакции преципитации с растворимой фракцией путем центрифугирования может привести к появлению в антисыворотке или растворимых комплексов At-Ar, или избытка добавленного Ar, присутствие которых влияет на способность антисыворотки реагировать со сцецифическим антигеном в ИФА. Наиболее удобно для адсорбции антисыворотки использовать антиген, иммобилизованный на твердой фазе. Добавляя такой иммуносорбент в антисыворотку или пропуская антисыворотку через колонку с иммуносорбентом, можно быстро освободиться от перекрестно реагирующих антител. Метод аффинной хроматографии на иммуносорбентах используется для получения препаратов очищенных антител. Наиболее широкое распространение лолучили иммуносорбенты на основе CNBr-активированной сефарозы. Выпускаемая в нашей стране CNBr-активированная агароза по своим основным параметрам не уступает зарубежному аналогу. Основные операции, используемые для получения иммобилизованных на CNBr-агарозе антигенов или антител, приведены в табл.5.1. Следует отметить, что при работе с иммуносорбентами на основе CNBr-активированной сефарозы нельзя использовать буфер, содержащий аминогруппы. Получение фрагментов антител. При разработке некоторых модификаций ИФА может возникнуть необходимость использования конъюгатов фермента не с целой молекулой иммуноглобулина, а с тем ее фрагментом, который специфически связывается с молекулой антигена - Fab-фрагментом. Обусловлено это прежде всего тем, что Fc-фрагмент молекулы, ответственный за эффекторные функции иммуноглобулина, обладает способностью неспецифически взаимодействовать с другими белками, сорбированными на носителях при проведении твердофазного ИФА. Эффект неспецифической сорбции определяется природой антигена, концентрацией сорбированного на носителе белка и рядом других факторов.
Таблица 5.1. Ковалентное связывание с CNBr-активированной сефарозой
Получение Fab-фрагментов. 1. Готовят раствор, содержащий 0,1-3 мг Р2-фрагмента в 0,45 мл 0,1 M Na-фосфатиом буфере, рН 6,0. · 2. Добавляют 0,05 мл 0,1 M 2-меркаптоэтанола в том же буфере, содержащем 5 мЛ ЭДТА. 3. Смесь инкубируют при 37 0C в течение 1,5 ч. 4. Тестирование антисывороток. Антисыворотки, полученные даже от одного животного, значительно различаются по своей способности связывать антиген. Для сравнительной характеристики и оценки качества антисывороток проводят их тестирование, которое позволяет решить следующие две важные задачи: во-первых, произвести отбор именно тех сывороток, которые по своим свойствам удовлетворяют требованиям иммунохимического анализа, во-вторых, осуществить стандартизацию антисывороток при их промышленном производстве для иммуноферментных наборов. Первичный отбор антисывороток проводят на основании нахождения их титра, который представляет собой интегральный параметр, характеризующий взаимодействие с антигеном. Более детальные сведения о сыворотке получают, определяя аффинность и концентрацию антител. Следующий этап - это установление антигенной специфичности антител, т.е. возможности взаимодействовать со структурно сходными антигенами. Принципиальное различие этих этапов заключается в следующем: при определении титра исследуют связывание выбранной концентрации антигена при различных разведениях аитисыворотки. При определении аффинности и концентрации антител исследуют связывание антисыворотки с различными концентрациями меченого антигена. При изучении специфичности антисывороток в соответствующем разведении и при постоянной концентрации меченого антигена добавляют различные концентрации перекрестно реагирующего антигена. Во всех случаях используют концентрации антигена либо близкие к минимально детектируемым в данном виде анализа, либо в том диапазоне, который соответствует их концентрации в Образце. Определение титра аитисыворотки. Титр - это эффективная величина, характеризующая связывающую способность антител, зависящая от их концентрации и аффинности. Абсолютное значение титра также зависит от метода и условий проведения эксперимента и от начальной концентрации свободного антигена. Количественно титр находят как предельное разведение сыворотки, при котором еще наблюдается положительный регистраруемый данным методом эффект взаимодействия антисыворотки с антигеном. Например, если титр устанавливают методом преципитации свободного антигена в геле и для первой сыворотки образование преципитата наблюдается при разведении в 2т раза, а для другой - в 2" раз, фп титр первой сыворотки равен 2т, а второй - 2", причем вторая антисыворотка менее активная, чем первая. Иногда оперируют понятием "50% -ный титр", подразумевая под этим, соответственно, разведение сыворотки, вызывающее 50% -ное связывание антигена. "Рабочим титром" называют то начальное разведение сыворотки, которое используют непосредственно в эксперименте. Таблица 5.2. Схема тестирования сывороток
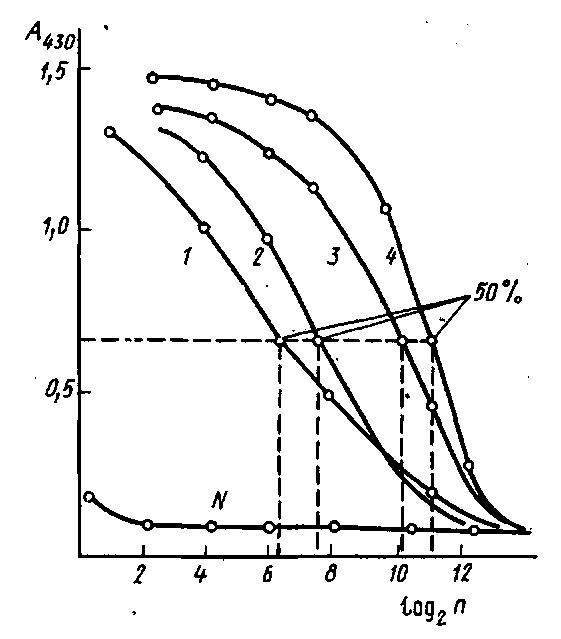
Титр антисыворотки сильно зависит от концентрации антигена, используемого для тестирования и от способа его определения. Например, одна и та же сыворотка может иметь титр 100 в тесте иммунопреципитации и 100 000 в тесте иммуноферментного анализа. Поэтому при тестировании сыворотки и определении титра лучше всего применять тот же метод, что и при анализе, а концентрацию антигена выбирать близкую к минимальной в том диапазоне, который выбран для анализа. Кроме того, следует учитывать, что в иммуноферментном анализе используют как гомогенные, так и гетерогенные методы определения концентрации антигена, которые могут сильно отличаться по структуре образующихся иммунных комплексов. В частности, в твердофазных методах вероятность образования циклических комплексов антиген - антитело значительно меньше, чем в гомогенных, а следовательно, и наблюдаемая аффинность антител в обеих системах будет разная. При разработке методов ИФА обычно пользуются значением титра антисыворотки, определенным в непрямом методе, в котором на стенках лунок микроллаты первоначально сорбируют антиген и затем изучают связывание с ним иммунной сыворотки в последовательных разведениях. Связывание исследуемых антител с иммобилизованным антигеном регистрируют с помощью антивидового конъюгата к иммуноглобулиновой фракции сыворотки животного, используемого для иммунизации. Результаты в этом случае обычно оценивают с помощью понятия "50% -ный титр". На рис. приведены кривые титрования антисывороток к инсулину, полученных иммунизацией морских свинок. Максимальный сигнал, регистрируемый по оптической плотности А продукта реакции окисления перекисью водорода 5-аминосалициловой кислоты, составляет ~1,4 оптических единиц. За титр сыворотки принимается ' такое разведение, при котором оптическая плотность, регистрируемая в ИФА, имеет значение, близкое к 0,7. Обычно такой подход используется в качестве 1-го этапа оценки качества полученных иммунных сывороток и позволяет отобрать высокоактивные иммунные сыворотки. Однако для более глубокой оценки полученных антител проводят определение их аффинности. При разработке методов ИФА ряда антигенов, присутствующих в биологических жидкостях в низких концентрациях порядка Ю-10-IO11M, должны быть использованы антисыворотки, имеющие не только высокий титр, но и достаточное содержание антител, обладающих высокой константой связывания. Аффинность антител. В основном в таких экспериментах применяются иммобилизованные антитела и антигены, меченные радиоактивной меткой.
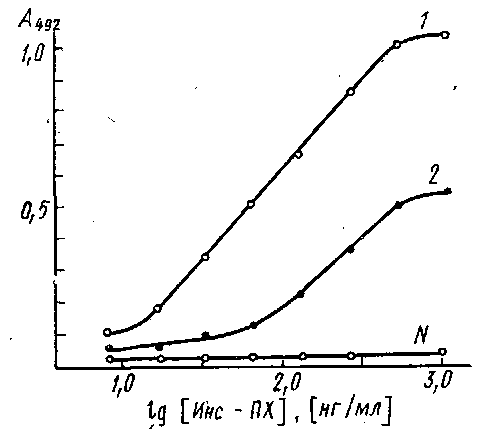
Титрование антисывороток к инсулину методом непрямого твердофазного ИФА: по оси абсцисс - разведение разбавленной в 100 раз сыворотки, по оси ординат - оптическая плотность при 430 им продукта пероксидазного окисления 5-аминосалициловой кислоты перекисью водорода. В качестве контроля - использована сыворотка крови неиммунизированного животного. При использовании ферментных меток химическая структура меченого антигена может существенно отличаться от немеченого. В этих случаях полученные значения констант связывания характеризуют, как правило, взаимодействие в данной конкретной системе, вследствие - чего иммунная сыворотка, обладающая высокой аффинностью в реакции с конъюгатом одной структуры, может иметь значительно более низкие значения константы связывания с конъюгатом, полученным другим способом. Если исследователь имеет дело с разработкой конкурентных методов ИФА, т.е. располагает набором иммунных сывороток и конъюгатом антиген-фермент, то важным этапом создания тест-системы является выбор пары антитело - конъюгат, характеризующейся Необходимой константой взаимодействия. Для проведения скрининга у-глобулиновую фракцию каждой антисыворотки иммобилизуют на поверхности микропланшета и изучают ее связывание с имеющимся набором конъюгатов. Эффективное значение связи является величиной, обратной значению концентрации конъюгата, при которой связывается 50% активных центров на носителе. На рис. приведены кривые связывания иммобилизованных на полистироле антител к инсулину с конъюгатом инсулин - пероксидаза. Исследуемые сыворотки различаются по значениям эффективных констант равновесия. Для количественного определения инсулина могут быть использованы антисыворотка и конъюгат, эффективная константа связывания которых ~109 M-1. Для других тест-систем допустимое значение Кзф будет определяться требованиями, предъявляемыми к чувствительности и точности разрабатываемого метода. Описанная процедура скрининга иммунных сывороток, как отмечалось выше, применима при наличии конъюгата антиген – фер.
Связывание конъюгата инсулин - пероксидаза с адсорбированными на полистирольном планшете антителами против инсулина, выделенными из разных сывороток: по оси ординат - оптическая плотность А при 490 нм продукта пероксидазной реакции окислення о-фенилендиамина перекисью водорода. Константы связывания антител из сывороток / и 2 равны Ю'о н 109 соответственно; N-контрольная нормальная сыворотка. Получение такого конъюгата для широкого круга антигенов представляется непростой задачей. Более универсальным реагентом являются антитела, меченные ферментом, поэтому остановимся на более общем подходе к определению аффинности антител в сыворотке или асците, основанном на твердофазном ИФА. Этот метод, предложенный Б. Фриге, позволяет определять константу связывания антител с антигеном при их взаимодействии в растворе. Постановка метода включает две основных стадии: 1) проведение реакции антиген - антитело в растворе; 2) определение концентрации антител после установления равновесия с помощью метода твердофазного ИФА. Схема реакции в растворе в общем случае имеет вид
Обозначим равновесную концентрацию связанных антител как Bp, а концентрацию свободного антигена как Fj,, тогда можно записать следующее выражение:
Если концентрации антител 0 и определять методом непрямого твердофазного ИФА, то при определенных условиях проведения эксперимента. будет выполняться соотношение / о=Л/Л0, где А и A0 - значения оптических плотностей, регистрируемых в ИФА, соответствующие концентрациям антител и о. Уравнение Клотца при этом условии может быть приведено к виду
Таким образом, для определения Кл описанным выше методом необходимо знание начальной концентрации антител о. Однако практически нахождение Кл проводится в иммунных сыворотках, или асцитах, где точная концентрация антител |Ат] о неизвестна. Если проводить реакцию комплексообразоваиия в избытке антигена, то количество связавшегося антигена незначительно по сравнению с исходным и его концентрация после установления в системе равновесия будет близка к исходной ф е.0 да. Fp. Если эксперимент проводится так, что выполняется условие о > 10 о, то
полученные радиоактивной меткой. Если представить экспериментальные данные в координатах A0/-=-1/0> то по тангенсу угла наклона прямой можно рассчитать Кд.
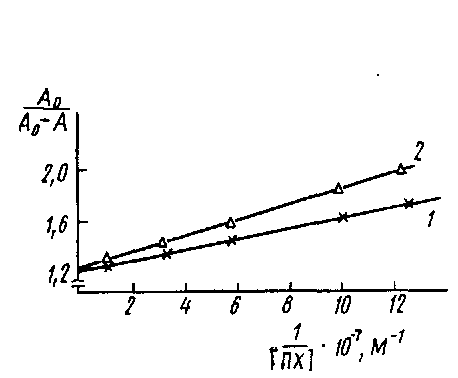
Определение константы диссоциации комплекса пероксидаза - антитела к пероксидазе в координатах Клотца: кривые 1 я 2 соответствуют значениям Cd 1,1 ·10-9 и 2.2 ·10-9 M.
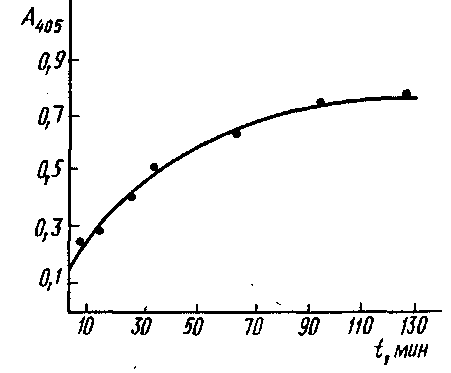
Кинетика связывания моноклональных антител с инсулином, адсорбированным иа полистирольном планшете для ИФА из раствора концентрации 1 мкг/мл. Комплекс инсулин - антитело выявлен меченными пероксидазой антимышинными IgG: Таким образом, для практического осуществления' описанного метода необходимо, прежде всего, установить наличие линейной зависимости между концентрацией определяемых непрямым методом ИФА антител и регистрируемым значением оптической плотности. Для этого готовят серии разведений исследуемой иммунной сыворотки и изучают их связывание в непрямом методе ИФА. Обычно эти зависимости имеют, вид кривых с насыщением. Для проведения эксперимента выбираются разведения антисыворотки, лежащие в линейном диапазоне кривой. Для установления равновесной константы диссоциации комплекса Ar·At концентрацию антигена варьируют в диапазоне от 10-6 до 10-8 М. На рис. приведен график для определения Кл комплекса ПХ-Ат. Однако вычисленные этим методом значения констант диссоциации комплекса At •Ar являются эффективными, поскольку при выборе уравнения не учитывается влияние взаимодействия антител с антигеном, сорбированным на твердой фазе, на равновесие в растворе. Экспериментально контроль влияния иммобилизованного антигена на равновесие в реакции Ar-At в растворе осуществляется сравнением сигналов, полученных на стадии твердофазного ИФА в двух соседних рядах лунок. Для этого содержимое лунок одного ряда переносится во второй свободный, обработанный аналогично первому, после чего сравнивают значения сигналов. Если наблюдаемые различия не превышают 10%, то можно полагать, что влияние иммобилизованного антигена на равновесия Ar-At в растворе незначительно. Более точная оценка общего случая с учетом влияния иммобилизованного антигена может быть дана в рамках модели связывания лиганда с несколькими независимыми центрами связывания:
Если К* - константа связывания антител с иммобилизованным центром связывания, а,· - концентрация различных субпопуляций антител, связывающихся с иммобилизованным антигеном, то нетрудно показать, что в этом случае окончательное выражение уравнение Клотца будет иметь вид
Обозначим С для реакций ряда антигенов был найден экспериментально, значение его не превышает 2-2,5. При этом оценка С получена в предположении, что реакция антител с иммобилизованным антигеном достигает равновесия. Кинетика этого процесса представлена на рис., из которого видно, что время установления равновесия значительно больше используемого в эксперименте при определении константы. Поэтому полученное значение С является максимальным и максимальная ошибка, которая допускается при определении Ku, составляет 200-250%. Метод может быть использован для вычисления констант связывания как поликлональных, так и моноклональных антител. МИКРОБНЫЕ ПОЛИСАХАРИДЫ В настоящее время полисахариды микроорганизмов достаточно широко используются в практике (табл. 20.2). Они находят применение в самых различных сферах человеческой деятельности: в медицине, фармацевтической, пищевой, химической и текстильной промышленности, в гидрометаллургии, при добыче нефти и в ряде других областей народного хозяйства. При этом внимание исследователей и практиков привлекают и внутриклеточные и внеклеточные гликаны, однако в технико-экономическом плане предпочтительнее последние — масштаб их производства и применения значительно шире. Возможность и перспективность использования полисахаридов в медицине в значительной мере определяется их биологической активностью.
Многие микробные полисахариды обладают лечебным и профилактическим действием: повышают устойчивость организма к бактериальным и вирусным инфекциям, обладают противоопухолевой активностью, способствуют заживлению ран и регенерации тканей, благоприятно влияют на течение и исход воспалительных процессов, устраняют болевой синдром, снижают побочное действие лекарственных препаратов и рентгенотерапии. Лечебное и защитное действие полисахаридов определяется прежде всего их способностью повышать неспецифическую иммунобиологическую реактивность организма, влиять на различные защитные реакции, поддерживающие постоянство его внутренней среды. Преимущества многих полисахаридных препаратов перед другими средствами, повышающими неспецифическую резистентность организма, определяются тем, что они свободны от примесей, оказывающих нежелательное действие на организм. Некоторые микробные полисахариды уже нашли применение в лечебной практике различных клиник мира. В нашей стране для лечения последствий травм и нарушений проводимости нервной системы, для предупреждения образования грубых послеожоговых или посттравматических рубцов успешно применяли пирогеналь — препарат, выделяемый из клеток Salmonella typhi и Pseudomanas aeruginosa. В ФРГ и США с этой же целью использовали липополисахариды, изолированные из различных патогенных бактерий. Бактериальные ЛПС обладают также и противолучевой активностью. В клиниках Советского Союза уже более 20 лет применяют продигиозан — гетерополисахаридный комплекс с липидами, выделенный из клеток Serratia marcescens, и зимозан — препарат из оболочек клеток Sacch. cerevisiae, состоящий из глюкана, глюкоманнана и минорных количеств тейхоевых кислот. Эти препараты нормализуют ряд сдвигов в иммунобиологических реакциях, оказывают положительное действие при лечении опухолей, ряда инфекционных и неинфекционных заболеваний. Перспективны в качестве противоопухолевых агентов ЛПС ряда грамотри-цательных бактерий, внутриклеточный глюкан парамилон (аста-зиан) бесцветных фитофлагеллят Astasia longa, внеклеточные полисахариды различных дрожжей родов Llpomyces, Cryptococ-cus, Bullera и др., бактерий родов Alcaligenes и Agrobacterium. Перечисленные соединения рекомендованы для клинических испытаний. Противовирусную активность проявляет продигиозан. Модифицированный (сульфатированный) полярный маннан — внеклеточный полисахарид Rhodotorula rubra — перспективен как средство профилактики и лечения атеросклероза. Полисахариды, обладающие антигенной специфичностью, начинают использоваться в медицинской практике в качестве диагностических средств. К ним относятся, например, полисаха-ридные препараты патогенных и условно патогенных видов дрожжей рода Candida, облегчающие диагностику заболеваний кандидозной природы. Показана возможность использования модифицированных ЛПС-антигенов сальмонелл в диагностике сальмоиеллезов. Очищенные специфические полисахариды менингококков групп А и С (полимеры N-ацетил, О-ацетилманнозаминфосфата и N-ацетил, О-ацетилнейраминовой кислоты соответственно) используются для получения менингококковых вакцин. Микробные полисахариды могут быть основой для создания искусственных вакцин. Достигается1 это изменением их конфигурации или конъюгацией с синтетическими полиэлектролитами. Нейтральные декстраны с молекулярным весом около 75 ООО, продуцируемые L. tnesenteroides, широко применяются у нас в стране и за рубежом в качестве заменителей плазмы крови. Перспективны как плазмозаменители пуллулан, а также леваны, синтезируемые G. oxydans и Вас. polymyxa. Декстраны определенного строения, как и многие другие полисахариды, способны стимулировать защитные реакции организма. В клиниках они применяются в комплексе с другими препаратами для лечения различных заболеваний брюшной полости. Сульфаты декстрана обладают антикоагулирующим действием, заменяют гепарин и могут применяться как антитромбогенное средство. В качестве антикоагулянта перспективен также хитин. Широкое применение микробных полисахаридов в фармацевтической, парфюмерной, пищевой и других отраслях промышленности определяется их свойствами: вязкостью, реологическими характеристиками, способностью к набуханию, взаимодействием с определенными структурами. В фармацевтике они используются в качестве основы для изготовления лекарственных форм: как мягчители, эмульгаторы и стабилизаторы суспензий, как склеивающие агенты и разрыхлители в мазях, пилюлях, таблетках. Они обеспечивают длительную устойчивость лекарственных препаратов, стабилизируют и пролонгируют их действие. На базе некоторых микробных полисахаридов (аубазидан, декстран) созданы стабильные в течение нескольких лет лекарственные препараты: бутадиона, серы, сульфаниламидов, суспензии сульфата бария для рентгеноскопии и др. Макромолекуляр-ные конъюгаты модифицированных декстринов с ферментами (стрептокиназой, трипсином, фибринолизином) пролонгируют активность ферментов и снижают их аллергизирующее действие. Микробные полисахариды применяются как гельобразующие агенты при изготовлении косметических изделий, для создания гидрофильного буфера в кремах, в качестве набухающих веществ при производстве кремов, шампуней, лосьонов. Некоторые гликаны можно использовать вместо применяемой в настоящее время натрий-карбоксицеллюлозы в качестве связующего и биологически активного компонента в зубных пастах. В пищевой промышленности полисахариды микроорганизмов используются в виде пленок — покрытий продуктов, например сыров, для защиты их от высыхания и плесневения, в качестве стабилизаторов мороженого, фруктовых соков, приправ к салатам, загустителей сиропов, джемов, подливок, желе и других кулинарных изделий. Особенно перспективным в этом плане считается ксантан. Слизеобразующие штаммы Streptococcus lactis применяют в Швейцарии при производстве густых кефиров, сметан и некоторых мягких сыров. Экзополисахариды дрожжей родов Saccharomyces и Cryptococcus, бактерий родов Azotobacter и Arthrobacter могут использоваться для улучшения качества хлеба. Добавление их к муке при выпечке хлеба повышает газоудерживающую способность теста, улучшает его реологические свойства. Хлеб, выпеченный из такого теста, отличается высоким удельным объемом, хорошей пористостью, медленнее черствеет. Как гельобразующие агенты экзогликаны применяются при производстве ядерного топлива, фотографических и рентгеновских пленок, как заменители альгиновой кислоты водорослей в пищевой, текстильной, фармацевтической и бумажной промышленности (полиурониды Azotobacter, P. aeruginosa и ряда других микроорганизмов), они могут заменять агар (гетерополисаха-риды Вас. subtilis и Ps. etodea, состоящие соответственно из глюкозы, галактозы, фукозы, глюкуроновой кислоты и глюкозы, рамнозы, глюкуроновой кислоты и О-ацетильных групп). Анионные полисахариды (ксантан, занфло —- внеклеточный гетерогликан Erwinia tahitica, состоящий из глюкозы, галактозы, фукозы, уроновой кислоты и ацетильных групп, и др.) стабилизируют и предохраняют от высыхания катиоиные водные эмалевые краски. Некоторые гликаны, например гетерополисахарид Corynebacterium equi var. mucilagenosus, обладают высокой вязкостью и могут заменять дорогие клеящие средства. Сульфаты ксантана используются как загустители клеев. С другой стороны, способность ряда полисахаридов к образованию поверхностных пленок позволяет использовать их в качестве антисклеи-вающих веществ, например при освобождении слепков из отливочных форм. Декстран рекомендуется применять и в качестве смазочного средства. Полисахариды, водные растворы которых отличаются особой стабильностью при резких изменениях температуры и в условиях агрессивной среды, используются в нефтяной и газодобывающей промышленности как стабилизаторы и структурообразователи промывных жидкостей, предназначенных для бурения нефтяных и газовых скважин, и обеспечивают более полное извлечение нефти из нефтеносных пластов. Уже около 15 лет назад более половины нефти в США добывали с помощью полисахаридов, главным образом ксантана. Промышленные испытания проходит склероглюкан — капсульный линейный нейтральный глюкан, образуемый несовершенными грибами, преимущественно рода Sclerotium. В качестве стабилизатора буровых глинистых суспензий перспективен линейный внеклеточный гетерогликан облигатнометилотрофных бактерий Methylobacillus methylophilus, состоящий из глюкозы, галактозы, маннозы, рамнозы и глюкуроновой кислоты. Применение полисахаридов в нефтедобывающей промышленности является очень перспективным в техническом отношении. Полисахариды ряда микроорганизмов (пуллулан A. pullulans, гетерополисахарид бактерий рода Methylotnonas и др.) являются флоккулирующими агентами и применяются в гидрометаллургии для получения металлических компонентов в виде гелей, включающих нерастворимые осадки. Процесс реализован при очистке, разделении и концентрации металлов из растворов их солей или смесей солей. На основе декстранов получают сефадексы, широко применяемые в лабораторной практике для гельфильтрации. Полианионные гликаны, например ксантан, хитин, рекомендуется использовать для очистки воды от тяжелых металлов, а также при промышленном синтезе полимеров для извлечения их из органических растворителей. Хитин может найти применение и для очистки сточных вод. В качестве носителя иммобилизованной а-амилазы используют аубазидан. Перспективны для иммобилизации ферментов курдлан и хитин. Микробные леваиы — источники получения чистого препарата фруктозы, хитин — D-глюкозамина и ЇЧ-ацетил-О-глюкозами-на — соединений, используемых в химическом синтезе, из манна-нов дрожжей можно получать маннозу. Полисахариды некоторых бактерий, например левам Вас. роlymyxa, оказались полезными в сельском хозяйстве. При внесении в почву они повышают выживаемость семян культурных растений, способствуя сохранению в них влаги. Альгинатными пленками покрывают корни и семена растений для предохранения их от высыхания во время хранения и перевозок. Возможности практического применения полисахаридов микроорганизмов полностью еще не раскрыты. Всестороннее изучение гликанов в этом плане открывает новые перспективы и, несомненно, приведет к расширению соответствующей области микробиологической промышленности. |
||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 418. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
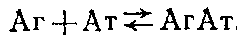
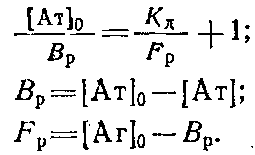
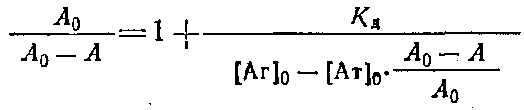
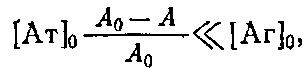
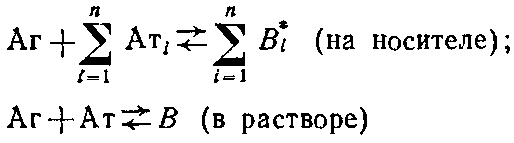
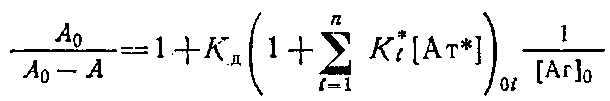
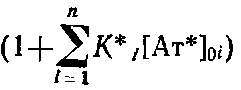 как С. Параметр
как С. Параметр