Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Метод учета ОМЧ на мясопептонном агаре
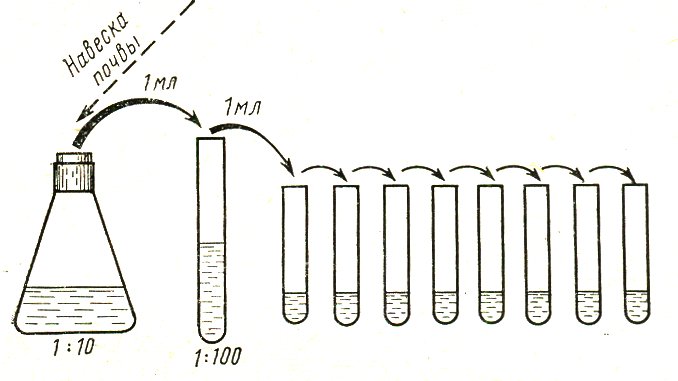
Почву берут на глубине 10-15 см стерильным ножом (из разных мест не менее 10 проб) в стерильную банку. Образцы почвы, доставленные в лабораторию, освобождают от крупных примесей –стекол, камней, корней и др. Крупные комочки почвы измельчают, затем образцы пропускают через сито с диаметром отверстий не более 3 мм, объединяют и из этой смеси берут навеску 10г. Приготовленную навеску вносят в колбу с 90 мл стерильной дистиллированной воды и тщательно перемешивают взбалтыванием в течение 5-10 мин. Такая обработка необходима для того, чтобы извлечь микроорганизмы из комочков земли и с поверхности почвенных частиц. Полученную равномерную взвесь отстаивают 2 мин и затем готовят из нее ряд 10-кратных разведений, последовательно перенося стерильной пипеткой по 1 мл в пробирки с 9 мл стерильной дистиллированной воды. Схема последовательных разведений почвы представлена на схеме. При приготовлении разведений взвесь переносят в каждую последующую пробирку новой стерильной пипеткой. Таким образом, готовят разведения до 1:1000000 и более в зависимости от того, из каких почв были взяты пробы для исследования, и их предполагаемой заселенности микроорганизмами. Для посева используют не менее двух различных разведений (обычно используют два последних, максимальных). Из каждого выбранного разведения по 1 мл вносят в 2 стерильные чашки Петри (для получения средних показателей) и заливают 15-20 мл расплавленного и охлажденного до 45ºС МПА. Осторожно передвигая чашки по поверхности стола, перемешивают агар с внесенными в него разведениями почвы. После застывания питательной среды чашки инкубируют в термостате при температуре 30-35ºС в течение 24 - 48 ч. Количество микроорганизмов, содержащихся в 1г исследуемой почвы, определяют следующим образом. Подсчитывают количество колоний, выросших на каждой из двух чашек, суммируют полученные результаты и делят на 2, вычисляя среднеарифметический показатель, и умножают его на степень разведения. Для подсчета берут чашки, на которых выросло от 50 до 150 колоний. Пример. В чашках, засеянных почвенной суспензией, взятой из разведения 1: 10000, выросли в среднем 75 колоний. 75 умножаем на степень разведения - 10000 и получаем результат - 750000 бактерий. То есть такое количество микроорганизмов содержится в 1 г исследуемого образца почвы. 
Схема последовательных разведений почвы.
Определение общего количества бактерий группы кишечной палочки - БГКП Методика. Различные разведения почвенной суспензии засевают по 1 мл в пробирки со средой Кесслера (1л дистиллированной воды, 10 г пептона, 50 мл бычьей желчи, 10 г лактозы; рН 7,4-7,6; 4 мл 1% водного раствора генцианового фиолетового). Разливают в пробирки с поплавками. Инкубируют при 43°С 48 часов. При получении в средах газообразования и помутнения производят высев петлей на среду Эндо. Отбирают типичные для кишечной палочки колонии, делают мазки, окрашивают по Граму, микроскопируют. При выявлении в мазках Гр- палочек ставят пробу на оксидазу. Если проба отрицательная (изменение окраски на синий цвет) проверяют ферментативные свойства выделенной культуры посевом на полужидкую среду с глюкозой. Появление в среде кислоты и газа подтверждает наличие Е. coli. Определение наличия Cl. perfringens Для определения перфрингенс-титра различные разведения почвенной суспензии засевают в пробирки со стерильной железосульфитной средой Вильсон-Блера. Инкубация при 43°С 48 часов. Учитывают результаты по образованию черных колоний Cl. perfringens в агаровом столбике среды. Мазки окрашивают по Граму, микроскопируют (Гр+ крупные палочки со спорами овальной формы, центрального или субтерминального расположения), вычисляют перфрингенс-титр (наибольшее разведение посевного материала, посев которого приводит к почернению и разрыву среды впервые 12 часов роста при 430 С).
К работе № 4 Микрофлора рук и предметов окружающей среды Санитарный надзор за состоянием объектов общественного питания и пищеблоков в лечебных и детских учреждениях осуществляется взятием смывов с рук обслуживающего персонала, посуды, поверхности столов, досок и т. д. При взятии смыва с рук пользуются стерильными ватными тампонами, которые перед употреблением смачивают в среде Кесслера, содержащейся в пробирке, в которой находится тампон. Смывы делают с обеих рук, тщательно протирая ладони, межпальцевые промежутки и подногтевые пространства сначала левой руки, а затем правой. С исследуемых предметов стерильным ватным тампоном, увлажненным изотоническим раствором NaCl, делают смыв. Тампон помещают в среду Кесслера или втирают в поверхность среды Эндо. Для исследования гладких поверхностей и тканей смывы с делают с помощью трафаретов из проволоки, имеющих площадь 25 см2. Посевы выдерживают в термостате при температуре 43° С в течение суток. При наличии брожения в среде Кесслера делают высев на среду Эндо. Колонии, подозрительные на кишечную палочку, подвергают дальнейшей идентификации. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 234. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |