
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
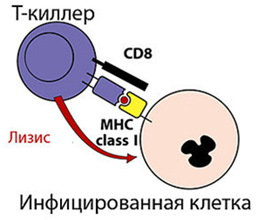
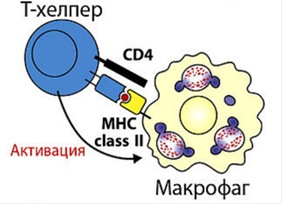
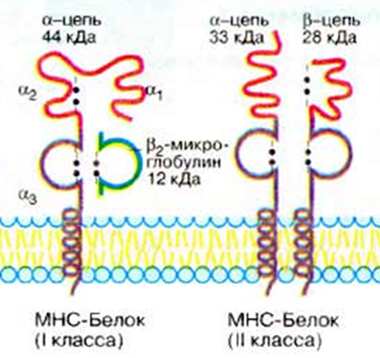
Гены MHC делятся на три группы. ⇐ ПредыдущаяСтр 3 из 3 Каждая группа включает гены, контролирующие синтез полипептидов одного из трех классов MHC: MHC-I класс.Гены групп HLA-A, HLA-B и HLA-C кодируют молекулы MHC класса I. MHC-II класс.Гены групп HLA-DP, HLA-DQ и HLA-DR кодируют молекулы MHC класса II. MHC-IIIобозначает область между MHC-I и MHC-II, здесь картированы гены, кодирующие некоторые ком-ты сис-мы комплемента (C4a и C4b, С2), цитокинов - (TNF-α и лимфотоксина), др. Вышеперечисленные являются классическими генами. Неклассическиегены не принадлежат ни к одному из классов MHC. Описано 6 таких генов в области расположения генов MHC-I (Е, F, G, Н, J, X), и 6 - в области MHC-II (DM, DO, CLIP, TAP, LMP, LNA). Экспрессия на мембране клетки Гены MHC кодоминантны, т.е. одновременно экспрессируются гены материнской и отцовской хромосом. Генов MHC-I по 3 (А, В, С) в каждой из гомологичных хромосом, генов MHC-II - также по 3 (DP, DQ, DR); следовательно, если у матери и отца нет одинаковых аллелей, то каждый человек имеет как минимум 12 различных основных аллелей каждого гена MHC классов I и II, вместе взятых. МНС I классасостоит из 2-х цепей. Тяжелой α-цепи и легкой β2-микроглобулина α-цепь, включает три фрагмента: внеклеточный, трансмембранный и цитоплазматический. Внеклеточный содержит 3 домена - α1, α2 и α3. Связывание антигенного пептида происходит в щели, образованной α1- и α2-доменами. Экспрессия и функции МНС 1 класса Экспрессия:антигены представлены на всех клетках, тканях и органах, поэтому они являются главными трансплантационными антигенами. РИСУНОК 1!! Функции:Р-ция отторжения трансплантата;Рестрикция акт-ти цитотоксических р-ций Т-киллеров. Презентация АГ MHC-I «обслуживают» зону цитозоля, сообщающегося через ядерные поры с содержимым ядра. Здесь происходит фолдинг синтезированных белковых молекул.  При возникновении ошибок (в том числе и при синтезе вирусных белков) белковые продукты расщепляются в мультипротеазных комплексах (протеосомы). Образующиеся пептиды связываются с молекулами MHC-I, которые представляют T-лимфоцитам внутриклеточно образующиеся пептидные АГ. Поэтому CD8+ T-лимфоциты, которые распознают комплексы АГ с MHC-I, участвуют в первую очередь в защите от вирусных, а также внутриклеточных бактериальных инфекций. Этапы подготовки вирусных белков к взаимодействию с молекулами I класса главного комплекса гистосовместимости: I этап - разрушение вирусных белков, находящихся в цитозоле, с помощью протеазного комплекса - протеосомы. II этап - транспорт образовавшихся пептидов во внутреннее пространство эндоплазматического ретикулума с помощью ТАР-1 и ТАР-2, образующих гетеродимер на эндоплазматической мембране. III этап - встреча транспортируемых пептидов с молекулами I класса МНС. Взаимодействие пептида с молекулой I класса приводит к отсоединению калнексина. Образовавшийся комплекс пептид: молекула I класса готов к дальнейшему транспорту к плазматической мембране. IV этап - комплекс через аппарат Гольджи транспортируется к клет. поверхности, вирусн.пептид в комплексе с молекулой МНСI становится доступным для его распознавания TCR. МНС II класса: гетеродимер из двух нековалентно связанных цепей α и β, каждая из которых включает два домена: α1, α2 и β1, β2 (соответственно). Антигенсвязывающую область образуют α1- и β1-домены. Экспрессия: антигены представлены на макрофагах, В-лимфоцитах и активированных Т-лимфоцитах. РИСУНОК 2!! Функции: Реакция трансплантат против хозяина, Рестрикция взаимодействий: Т-h1 и Т-h2. Презентация АГ MHC-II: Зона «обслуживания» связана с внеклеточной средой и с клеточными органоидами (аппарат Гольджи, ЭПС, лизосомы, эндосомы и фагосомы). Пептиды, образующиеся в данной зоне, имеют внеклеточное происхождение - это продукты протеолиза белков, захваченных клеткой посредством эндоцитоза или фагоцитоза. Молекулы MHC-II с помощью кальнексина экспонируются внутрь везикул (эндосом или фаголизосом) и только здесь, связавшись с пептидным АГ, принимают необходимую конформацию для дальнейшей экспрессии на мембране клетки. Таким образом, молекулы MHC-II осуществляют представление АГ при развитии иммунных реакций на внеклеточные инфекции. Главную роль в этих реакциях играют CD4+ T-лимфоциты, распознающие АГ в комплексе с MHC-II. Этапы подготовки вирусных белков к взаимодействию с молекулами II класса главного комплекса гистосовместимости: I этап - поглощение бактерий или их токсинов фагоцитирующей, способной к презентации антигена клеткой и разрушение захваченного материала до отдельных пептидов в фаголизосомах. II этап - во внутреннем пространстве ЭПР происходит сборка молекул II класса, которые до встречи с пептидом комплексированы со с инвариантной цепью (Ii). Этот белок защищает молекулу II класса от случайной встречи с бактериальными пептидами в эндоплазматическом ретикулуме. Комплекс молекулы II класса с Ii покидает эндоплазматический ретикулум в составе вакуоли. III этап - вакуоль, содержащая комплекс молекулы II класса с Ii, сливается с фаголизосомой. Протеазы разрушают Ii белок и снимают запрет на взаимодействие МНС II с бактериальными пептидами. Комплекс пептид + МНС II в составе секреторной вакуоли перемещается к мембране. Результат – экспрессия АГ пептида в комплексе с МНС II класса на клеточной поверхности. Это обеспечивает доступность АГ пептида для TCR Т-клеток.
РИСУНОК 1 РИСУНОК 2 РИСУНОК 3 (строение МНС I и МНС II)
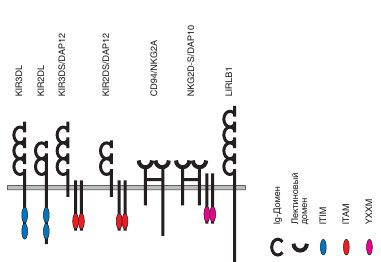
2.NK-клетки – крупные (10-12 мкм) лимфоциты с азурофильной зернистостью в цитоплазме (гранулярные лимфоциты). Перфорин, гранзимы, гранулолизин-основные компоненты гранул NK. Отличие NK-клеток от других популяций лимфоцитов-отсутствие на NK-клетках антигенспецифических рецепторов, кодируемых генами, перестраиваемыми в процессе дифференцировки клеток. NK-клетки развиваются в кост. м. и происходят от общего лимфоидного предшественника, который дает начало всем разновидностям лимфоцитов. В развитииNK-клеток важную роль играет влияние микроокружение, реализуемое через прямые межклеточные контакты и посредством цитокинов (взаимодействие представленного на мембране NK-клетки лимфотаксина α с рецепторами на стромальных клетках). Цитокины IL-7, IL-15, а также Ftl-3 необходимы для дифференцировки натуральных киллеров. На этапе выбора пути дифференцировки от общего лимфоидного предшественника в направлении Т- и В-линий, потенциал развития сохраняется за Т/ NKР клетками. На Т/ NKР клетках экспрессируются CD34, C-kit, Fit-3, CD132(γ). Условие дифференцировки NK-клеток – экспрессия внутриклеточных факторов дифференцировки Id2 и Ets1. После отделения от Т-линии дифференцирующие NK-клетки обозначаются NKР-клетки. При переходе на эту стадию развития на поверхности клетки экспрессируется β-цепь(122), общая для рецептов IL-2 и IL-15. Затем клетка экспрессирует α-цепь рецептора для IL-15. IL-15- становится основным цитокином определяющий развитие, выживаемость, гомеостаз NK-клеток. Формирование зрелой NK-клетки происходит при участии IL-15, IL-18, IL-12. Характерно последовательное появление маркеров и рецепторов для NK-клеток: NK1.1, CD94/NKG2 и NKG2D. Важное условие экспрессии рецепторных молекул Ly49, CD94/NKG2 взаимодействие NKР-клеток со стромальными клетками костного мозга, экспрессирующими молекулы МНС-1- лиганды этих рецептов. В то же время на NK-клетках появляются интегрины(β2-интегрин Мас-I(αмβ2)), и исчезает молекула CD34. Происходит несколько актов деления NK-клетки. Переход от стадии NKР к зрелым NK-клеткам блокируется при выключении генов самого IL-15, α-цепи его рецептора и связанной с ней тирозинкиназы Jak3, транскрипционных факторов STAT5(αβ), обеспечивающий передачу сигнала от рецептора, и факторов IRF-1и IRF-2, необходимых для секреции IL-15. Зрелые NK-клетки покидают кост. м. и мигрируют в периферический отдел ИС. Находится в циркуляции периферической крови, в синусоидах печени, эндометрии матки, лимфатических узлах, селезенке в красной пульпе. 5% NK-клеток крови экспрессирует рецептор ССR7, учавствующий в преодолении эндотелиального барьера в посткапиллярных венулах и миграции лимфоцитов в Т-зоны вторичных лимфоидных органов. Расселение натуральных киллеров обусловлено хемокиновыми рецепторами: CXCR4, CCR1, CCR5. Эти рецепторы определяют миграцию клеток по градиенту хемокинов: CXCL12(SDF-1) и многих β хемокинов. Выживаемость NK-клеток зависит от IL-15, дополнительную роль в поддержании жизнеспособности играет IL-17. Выделяют активирующие и ингибирующие рецепторы NK-клеток. К активир. р-рам относятся группы: KIR, CD94/ NKG2, NKG2D, FcR, NCR. Основной из них рецептор NKG2D-трансмембранный белок 2 типа (наружу направлен С-конец молекулы), С-лектин. В мембране NKG2D электростатически связан с адапторным белком DAP-10, имеющий в своей цитоплазматической части активационный мотив YXXM (образован остатками тирозина и метионина, разделенными двумя любыми аминокислотными остатками). При связывании рецептора с лигандом (MICA,MICB) происходит фосфолирование остатка тирозина в этом мотиве, что обеспечивает взаимодействие YXXM с липидной киназой-PI3K, приводящее к ее фосфорилированию и активации. Далее активационный сигнал поступает в ядро, где происходит индукция комплекса генов, связанных с цитолизом. Ф-ция ингибир. р-ров – предотвращение контактного цитолиза клеток-мишеней, несущих те же молекулы МНС-1, что и сама NK-клетка. Группы ингибир. р-ров: KIR, CD94/ NKG2, LILR. Все они распознают молекулы МНС-1: одна группа рецепторов распознает все молекулы МНС-1 независимо от их аллельной принадлежности(CD94/ NKG2 и LILR); другая распознает определенные аллельные формы молекулы-HLA-C, HLA-A, HLA-B, HLA-G(KIR). Ингибир. Р-ры имеют длинный цитоплазматический участок, содержащий последовательность ITIM. Через нее рецептор контактирует с тирозинтрифосфатазами семейства SHP1, SHP2, SHIP, десфосфорилирующими активированные белки, и тем самым прерывающими активационный сигнал.
1,2ITIM 3,4ITAM 5YXXM
Наличие мотива ITАM или ITIM в цитоплазматической части молекулы или дополнительной полипептидной цепи определяет тип рецептора- активирующий или ингибирующий. Группы KIR, CD94/ NKG2 содержат как ингибирующие, так и активирующие рецепторы. NK-клетки могут вызывать несекреторный и секреторный лизис клетки- мишени. Несекреторный лизис происходит, когда клетки-мишени имеют рецепторы апоптоза типа антигена CD95(Fas, или APO-1), а взаимодействующие с ними NK-клетки имеют Fas-лиганд, включающий апоптоз. Обычно цитотоксическое действие NK-клеток обусловлено перфоринзависимым механизмом-секреторным лизисом, как и у цитотоксических Т-лимфоцитов. Они имеют гранулы с цитотоксическими веществами, сходные с перфорином, гранулизимом, гранзимом Т-цитотоксических лимфоцитов. Перфорины и гранулизины, проникнув в мембрану клетки-мишени, полимеризуются, образуя пору из 10-20 мономеров. Через перфориновые поры в клетку проникают гранзимы (сериновые протеазы), которые активируют каспазы, запускающие апоптоз клетки-мишени. NK-клетки могут уничтожать клетки-мишени покрытые антителами (антителозависимый). При соединении Fc-рецепторов (CD16) NK-клетки с Fc-фрагментом антител, покрывающих клетку-мишень, развивается антителозависимая клеточная (клеточно-опосредственная) цитотоксичность и гибель клетки-мишени. Выделяют 2 субпопуляции NK-клеток, различающиеся соотношением мембранных маркеров и функциями: CD Наиболее важные функции NK-клеток-цитотоксическая активность в отношении(трансформированных, инфицированных вирусами, подвергшихся действию стресса) клеток организма и секреция цитокинов ( в первую очередь IFNγ), что играет важную роль в регуляции иммунных процессов.
Билет 23 1. Теория врожденного иммунитета.Теория паттерн распознования – второй закон иммунологии. Суть – в процессе эволюции микроорганизмы любого происхождения сформировали индивидуальные поверхностные защитные структуры, утрата которых приводит к гибели организма от воздействия факторов окр. ср. Эти структуры являются общими для крупных таксонов микроорганизмов. Таким образом, распознавая эти поверхностные структуры мы можм идентифицировать этот таксон микроорганизма. Например, наличие в клеточной стенке тейхоевых кслот характерно для грамм+, хитин для грибов. Данная теория была предложена Ч. Дженеуэем и Р. Меджитовым. Эти поверхностные структуры называются патогенассоциированные паттерны. Они обладают следующими свойствами: 4. Эволюционно консервативен (не меняется в ходе эволюции). Если организм откажется от этой структуры он погибнет. 5. Общий для большого таксона микроорганизмов. 6. Такой структуры не должно быть в организме хозяина. Патогенассоциированный паттерн наша имм.сис. распознает паттерн – распознающими рецепторами. Патогенраспознающие рецепторы: 4. Находящиеся на поверхности мембран § Цитоплазматические § На всех внутр. Мембранах клетки 5. Находящиеся в цитоплазме каждой клетки и во всех жидких средах организма. 6. Секретируемые. Группы рецепторов: 4. TLR – универсальная группа рецепторов.Нах. на внутр. И наружной поверхностях мембран.Распознают паттерны белков, углеводов, жиров, нуклеин.кислот. 5. Scavenger рецепторы (рецепторы мусорщики) – распознают липидные паттерны в чистом виде или в связанном. 6. Лектиновые рецепторы – распознают паттерн, в состав которых входит сахар в чистом виде или в комплексе. TLR рецепторы всегда состоят из 2 субъединиц и делятся на гомодимеры (состоят их 2 одинаковых) и гетеродимеры (их 2 разных субъединиц). По строению их наружная часть состоит из лейцинбогатых доменов (из них формируются лигандраспозн. И связывающ. Части) и цитоплазматического домена (TIR домен). TLR 3, 7, 9 – рецепторы на внутренней мембране. Они распознают нуклеиновый паттерн (бактерии и вирусы). Гетерорецепторы 1, 2, 6 распознают паттерн, в состав которых входят липиды в чистом виде или в комплексе. TLR 4 – распозн. Липополисахариды TLR 5 – только белки, из которых состоят жгутики и реснички TLR11 – белки, характерные для клеточной стенки грибов. TLR находятся на всех клетках миелоцитарного и лимфоцитарного ряда. Но оснащены ими все клетки по – разному. Все TLR имеет макрофаг ДК миелоцит. Происхождения. Несколько меньше у В – лимфоцитов. Еше меньше у нейтрофилов. И совсем немного у Т – лимфоцитов. Сигналинг от TLR осуществл. С помощью древней системы каскадов в несколько этапов: взаимодействие контактных поверхностей групп адаптерных белков TIR и TRAF домена и MyD88. Это приводит к образованию docing сайта для IRAK киназы (сериновая протеинкиназа), которые аутофосфорилируют друг друга. IRAK киназы фосфорилируют киназу ингибитора NFкаппа –b. TLR – самое сильное активирующее семейство Scavenger рецепторы – только мембранные (тип А и В). Тип А – три полипепт.цепи, переплет. Как α – спирали между собой. Каждая заканчивается лиганд связывающим доменом. Тип В – состоит из одной полипептидной цепи, закрепленной по концам в цитоплазматической мембране. Распознают патогенассоциированые паттерны липидной природы, распознают и связывают апоптот. Тельца и спосбствуют их удалению. Участвую в процессах клеточной адгезии. Сигналинг от тих рецепторов осуществляется через Ras белок. Лектиновые рецепторы –самая большая группа (около 6о видов). Лектиновые могут быть мембранные и растворимые. Распознают остатки сахаров. Главная часть их структуры – углеводраспознающий домен в виде букета тюльпанов. Наиболее важные лектиновые рецепторы на цитоплазме мембраны: § Дектиновые – состоят из1 субъединицы и цитоплазмат. Домена на внутренней части (здесь находится ITAM последовательность) и на внешней части – углеводраспознающий домен. § Пентраксены – растворимые (синтетич. И секретир. Иммунными клетками). Находятся в жидкой среде. Состоят из 5 углеводраспознающих доменов. (СРБ, сывороточный амилоидный протеин). Механизм действия углеводраспознающих паттернов – запуск лектинового пути активации комплемента. § Сурфактантные белки – находятся в сурфактантной жидкости легких. Их активация приводит к запуску лектинового пути системы комплемента. § Маннансвязывающий лектин – состоит из 5 или 8 углеводраспознающих доменов и запускает систему комплемента по лектиновому пути. 2.TCR – сигналинг.TCR — сложная многокомпонентная структура из двух распознающих антиген цепей (α и β), соединенных дисульфидной связью, и нековалентно связанных сигнальных субъединиц СDЗ-комплекса, способных передавать активационный сигнал в клетку. Также в составе TCR есть субъединицы CD8 и CD28, которые тоже передают активационный сигнал в клетку. Любой сигналинг начинается с взаимодействия CD45 с сиаловыми кислотами. В результате происходит диссоциация двух субъединиц CD45.Цитоплазматический домен CD45 приобретает фосфотазную активность и начинает дефосфорилировать саркомовые киназы. Сближение клеток MHCI или MHCII презентирует комплекс антиген – пептид, который связывается в антигенсвязывающем центре. В результате контактного взаимодействия поверхностей изменяется заряд и конформация и заряд передается дзета цепям. Корецептор CD3 находится в непосредственной близости и заряд передается CD3. Происходит изменение конформации и его тирозины выворачиваются в раствор.Тирозин фосфорилируют PI3 киназы и как результата много фосфотирозина. На них фиксируются ферменты сигналинга. В цитоплазматической части дзета-цепи расположены 3 последовательности ITAM, предназначенные для взаимодействия с остатками тирозина тирозинкиназы ZAP-70 — ключевого фактора в передаче сигнала от TCR при его связывании с лигандом. ZAP-70 родная сестра Syk киназы. С помощью домена SH2 фермент ZAP-70 фиксируется на ITAM последовательности дзета цепей. Получает заряд, меняет конформацию, открываются ее собственные тирозины и саркомовые киназы фосфорилируют ZAP-70.Дальнейшая передача сигнала обусловлена взаимодействием ZAP-70 с ее главным субстратом — адапторным белком LAT. Этот белок связан с мембраной и входит в состав рафтов. ZAP-70 связывается с LAT, образуется заряд, который проходит через мембрану и распространяется по липидному слою мембраны. В том месте , где проходит заряд мембрана меняет свою стуктуру и становится жидкой. Возникает «липидное озеро». Это озеро вместе с зарядом распространяется и когда достигает LAT отдает ему заряд. LAT открывает свои тирозины, которые фосфорилируются Srk киназой.PI3 киназа фосфорелирует липиды на мембране. Дифосфаты превращаются в трифосфаты. Фосфолипаза-с-гамма садится туда, у нее есть SH2 домен, фосфорелируется. Там еще есть PI3 киназа, которая приссоеденяет 3-ий фосфат. Фосфолипаза-с-гамма расщепляет липиды на мембране на 2 части: диацилглицерин, который в мембране и инозитол-3-фосфат, который идет в цитоплазму, так как он гидрофильный. В цитоплазме, в одной из частей эндоплазматического ретикулума есть хранилище кальция – кальциевое депо. В мембранах есть кальциевые белки. Иназитол-3-фосфат связывается с кальциевыми белками, меняется конформация, каналы открываются и кальций выходит из хранилища в цитоплазму. Кальций распространяется вверх к мембране и вниз к ядру. Кальций, который пошел в цитоплазму связывается с кальмодулином, котрый его фосфорелирует. Кальмодулин меняет свою конформацию и может связываться с ферментом кальцийневрином. Комплекс кальмодулин+кальцийневрин становится активной фосфотазой и дефосфорелирует NFAT, котрый поступает в ядро. На LAT садится протеинкиназа-с. За сет SH2, она получает заряд, меняет конформацию. Диацилглицерол связывается с диацилглицериновым рецептором пртеинкеназы-с. Кальций, который добрался до мембраны связывается с кальциевым рецепторм протеинкиназы-с. У протеинкиназы-с, открывается тирозин, который фосфорелируется ZAP-70. Протеинкиназа-с становится активной. Протеинкиназа-с – ключевой фермент для запуска суперсемейства факторов трнаскрипции. Протеинкиназа-с фосфорелирует киназу ингибитора NF-каппа-b. Только после этого киназа ингибитора приобретает активность. Киназа ингибитора NF-каппа-В фосфорелирует ингибитор NF-каппа-В. Он диссоциирует от NF-каппа-В. NF-каппа-В поступает в ядро, а ингибитор разрушается в протеосоме. С другой стороны на LAT садится SHC белок, он связывает фосфотирозиновую группу, получает заряд, меняется конфоррмация. Его фосфорелирует syk-киназа. Рядом находится белок GRB2, в котором есть SH2 домен, который связывает эту фосфотиразиновую группу и связывает с первой. Меняется конформация, получает фосфотиразиновую группу. В составе GRB2 так же есть SH3 домен, котрый связывает пролиновый мотив в составе mSOS. Передается электрический заряд, меняется коформация mSOS и у него открывается контактная поверхность и присоединяется Ras-белок. Ras-белок присоединяет ГТФ и mSOS помогает отсоединять ГДФ. Ras белок с ГТФ получил название raf-киназа. Получает заряд, меняется конформация, открываются каталитические центры и запускается MAPK-каскад. Он состоит из 3-х ферментов – серин-треаниновых протеинкиназ, последовательно активирующих друг друга. Связывающий белок имеет 3 кармана. В этих 3-х карманах 3 белка. Самый последний фермент МАРК киназа, фермент, который его активирует – киназа МАРК киназы, а его активирует киназа киназы МАРК киназы.
Билет 24 1. Лиганд - молекула, специфически взаимодействующая с участком определенной структуры другой молекулы. Связывание лиганда с рецептором обычно происходит при помощи сил межмолекулярного взаимодействия, таких, как ионные связи, водородные связи, силы Ван дер Ваальса. Селективные и неселективные лиганды. Бивалентные лиганды состоят из двух соединённых молекул, каждая из которых является лигандом для определённого подтипа рецепторов (одного и того же или разных), причём в силу особенностей пространственного строения обе части молекулы способны одновременно связываться с двумя частями «составного» гомо- или гетеродимерного рецепторного комплекса. Бивалентные лиганды используются в научных исследованиях с целью обнаружения и исследования рецепторных гомо- и гетеродимерных комплексов и изучения их свойств. TLR - рецепторы экспрессированы на поверхности и в цитоплазматических гранулах различных клеток организма. Больше всего экспрессируют миелоидные клетки (моноциты и макрофаги). Цитоплазматическая (C-концевая) часть рецептора представлена TIR-доменом, ответственным за взаимодействие с адаптерными молекулами сигнальных путей. TIR-домен состоит из центрального β-слоя , окруженного 5 α-спиралями. Число вариантов TLR у человека оно составляет 10.TLR: гомо и гетеродимеры. Внеклеточная часть состоит из лейцин богатых доменов, из них форми-ся лигандраспознающий и лигандсвязывающий части- LRR-домен. На внутр части 3,7,8,9- распознают нуклеиновые паттерны. Все остальные на ЦП.TLR 1,2,6 распознают паттерны, в состав которого входят липиды.4 распознает патт, в состав которого входит полисахарид. Сигналинг При связывании PAMP с мембранным TLR возникают конформационные изменения внеклеточной части рецептора,передающиеся на внутриклеточный домен TIR. В передаче активацион-ного сигнала от TIR-домена ТLR участвует несколько адапторных белков(MyD88, TIRAP, TRIF, TRAM), активирующих 2 основных сигнальных пути — MyD88-зависимый и TRIF-зависимый. MyD88-зависимый путьучаствует в передаче сигнала от всех ТLR, кроме TLR-3, использущегоTRIF-зависимый путь. Передача сигнала от TLR-4 происходит с участиемобоих сигнальных путей. MyD88 (при участии TIRAP) играет роль «мости-ка» между активным димером TLR и первой сигнальной киназой — серин-треониновой киназой IRAK-4. Активированная IRAK-4 запускает каскадреакций активации сигнальных ферментов: киназы IRAK-1, убиквитин-лигазы TRAF6 и киназы ТАК1. На этом этапе передача сигнала может идти по двум путям. Один из них — активация тирозинфосфатазы IKK. Активация IKK происходит также при поступлении сигналов от эндолизосомального TLR-3 при посредстве адапторного белка TRIF и киназы RIP1. Основная мишень IKK — IκB (ингибирующая цепь неактивного комплекса, содержащего транскрипционный фактор NF-κB). Фосфорилирование IκB вызывает ее связывание с убиквитином, после чего она подвергается расщеплению в протеасоме. Освобожденный от IκB комплекс содержит активный димер NF-κB, миг-рирущий в ядро и связывающийся с промоторными участками многих провоспалительных генов (цитокинов, молекул адгезии, бактерицидных пептидов, ферментов и т.д.). Таким образом достигается главная цель активации — превращение клеток в эффекторы, обеспечивающие развитие воспалительной реакции и реализацию защитных функций врожденного иммунитета. 2. В-лимфоциты (bursa fabricius) - клетки иммунной системы, через которые реализуются реакции гуморального иммунного ответа. Предшественники В-лимфоцитов обнаружены в островках гемопоэтической ткани эмбриональной печени на 8-9-й неделе эмбрионального развития плода. Затем образование В-клеток в ней прекращается и далее происходит в костном мозге. В-лимфоциты развиваются в костном мозге из плюрипотентных стволовых клеток в ответ на сигнал стромальных клеток (растворимые цитокины, межклеточный контакт). Различают: антигеннезависимую дифференцировку В-лимфоцитов (в костном мозге) антигензависимую дифференцировку В- лимфоцитов (периферические органы иммунной системы). Стадии дифференцировки В-лимфоцитов: 1)пре-В (появляются цитоплазматические μ-цепи IgM), легкие цепи отсутствуют. 2)незрелые В-клетки (появляются легкие цепи с последующей сборкой рецептора в виде IgM, встроенного в ЦПМ). 3)зрелые В-клетки (происходит ориентация клеток на синтез антител определенного класса. Они несут либо поверхностные IgM, либо IgM в комплексе с IgA или IgG. Экспрессия поверхностного IgD клетка готова к антигенной стимуляции). 4)активированные В-клетки (после стимуляции антигеном IgD утрачивается и у всех клеток памяти не обнаруживаются). 5)плазмоцит (поверхностные иммуноглобулиновые рецепторы утрачиваются полностью). В-лимфоциты образуются в костном мозге на протяжении всей жизни организма. Созревшие В2-лимфоциты покидают участки, где проходила их дифференцировка, и перемещаются к периферическим или вторичным лимфоидным органам (например, к селезенке, лимфатическим узлам, а также к ассоциированным со слизистой оболочкой лимфоидным тканям). Рецептор В-линфоцитов (BcR) обеспечивает: связывание с антигеном, активацию, пролиферацию и созреванию В-лимфоцитов в АОК, эндоцитоз антигена внутрь клетки, переработку антигена, возвращение пептидов переработанного антигена на поверхность В- клетки вместе с молекулами МНС II класса. BCR построен из молекулы мембранного иммуноглобулина (mlg, состоящий из двух одинаковых тяжелых Н- и двух одинаковых легких - L-цепеи) и двух молекул CD79 (Igα, Igβ) - BcR имеет трансмембранные и внутрицитоплазматические сегменты, передающие внутриклеточные сигналы. В цитоплазматических участках Igα и Igβ присутствуют характерные последовательности аминокислотных остатков, называемые иммунорецепторными тирозинсодержащими активирующими последовательностями (ITAM); такие же последовательности присутствуют в проводящих сигнал компонентах антигенраспознающего рецептора T-клеток. В дополнительный корецепторный комплекс мембранных молекул, связанных с внутриклеточными системами проведения сигналов, входят 3 мембранные молекулы: CD19, CR2 (CD21) и TAPA-1 (CD81). Фенотип В-лимфоцитов BCR CD19 , CD20 , CD21,CD23 . Функции В2-лимфоцитов: способность дифференцироваться в плазматические клетки и продуцировать антитела; выступать в роли антигенпредставляющих клеток. B-лимфоциты своим иммуноглобулиновым Рц связывают растворимый Аг, поглощают его эндоцитозом, подвергают внутри себя процессингу и экспонируют на поверхность фрагменты Аг в составе комплексов с молекулами MHC-II и MHC-I. TCR T- лимфоцита связывает Аг на поверхности B-лимфоцита, выступая в качестве АПК; кроме того, устанавливаются все необходимые и достаточные корецепторные взаимосвязи между T- и B-лимфоцитами. Такое взаимодействие происходит в T-зависимых зонах периферической лимфоидной ткани в начале развития иммунного ответа. В2-лимфоциты отвечают только на Т зависимые антигены, продуцируют антитела различных классов только при участии Т-клеток, образуют В-клетки памяти. Выполняя роль антигенпрезентирующей клетки при дифференциации (АПК) и, после преобразований (в результате связывания антигена) В-лимфоциты дифференцируются в плазматические клетки, продуцирующие антитела. В-лимфоциты получают антиген от фолликулярных дендритных клеток (FDC), несущих иммунные комплексы антиген-антитело, а также в результате рецептор-опосредованного поглощения. Плазмоциты — клетки лимфоидной ткани, продуцирующие иммуноглобулины и развивающиеся из В-лимфоцитов через более молодые стадии (плазмобласт и проплазмоцит). У здорового человека в периферической крови плазмоциты присутствуют очень редко. Они могут появляться при плазмоцитоме, вирусных инфекциях (корь, краснуха, ветряная оспа, инфекционный мононуклеоз, инфекционный гепатит), длительной персистенции Аг (сепсис, туберкулёз, аутоиммунные болезни), состояниях после облучения, новообразованиях. V(D)J-реаранжировка— механизм соматической рекомбинации ДНК, происходящий на ранних этапах дифференцировки лимфоцитов и приводящий к формированию антиген-распознающих участков иммуноглобулинов и Т-клеточного рецептора. Гены иммуноглобулина и Т-клеточного рецептора состоят из повторяющихся сегментов, принадлежащих к трем классам: V (variable), D (diversity) и J (joining). В процессе V(D)J-перестройки генные сегменты, по одному из каждого класса, соединяются вместе. Объединенная последовательность сегментов V(D)J кодирует вариабельные домены каждой из цепей рецептора или иммуноглобулина. Реаранжировка генов рецепторов лимфоцитов начинается с экспрессии под влиянием дифференцировочных стимулов генов V(D)J-рекомбинацион-ного комплекса. Это комплекс содержит 6 компонентов: димер рекомбиназ (экзонуклеаз) RAG-1/RAG-2; ДНК-зависимуюпротеинкиназу; ДНК-лигазуIV; терминальную дезоксинуклеотидилтрансферазу (TdT), кодирующую нематричный синтез олигодезоксинуклеотидов; гетеродимер HMG 1/2; гетеродимер Ku70/Ku80. Cначала происходит перестройка на участке между D- иJ-сегмента-ми с формированием тандема DJ. Далее перестройка захватывает участок между V- иDJ-сегментами.В обоих случаях сначала происходит реорганизация пространства между перестраиваемыми участками с помощью RSS. Этот процесс начинается с экспрессии геновRAG. МолекулыRAG-1иRAG-2присоединяются к концам последовательностей 12 и 23 соединяемых участков гена. Затем субъединицы RAG димеризуются и происходит сближение связанных с ними участков. Разорванные нити ДНК замыкаются друг на друга. В результате формируется «шпилька», в которой ведущая нить ДНК переходит в комплементарную ей нить. Вырезанный отрезок, содержащий RSS, замыкается при соединении разорванных нитей. В результате формируется кольцевая структура-рекомбинационное вырезанное кольцо. На следующем этапе происходит «разрешение» шпилек с обеих сторон от места разрыва: при участии ДНК-зависимой протеинкиназы эндонуклеаза повторно разрывает ДНК, но не на вершине «шпильки», а сбоку, образуемые при этом отрезки ДНК различаются по длине. Более длинная нить разворачивается, и на ней комплементарно достраивается вторая. Описанные события приводят к появлению в составе ДНК новой последовательности. Такую последовательность называют «Р-вставка». В этот же очень короткий промежуток времени с участием TdT происходит добавление на свободных концах ДНК олигонуклеотида случайного состава. Поскольку синтез этого олигонуклеотида происходит не на матрице ДНК, такой вариант вставки называют N-вставкой. ПротяженностьN-вставок не превышает 20 нуклеотидов. Только после этого происходит воссоединение нитей ДНК с 5’- и3’-концов.В процессах репарации ДНК участвуютДНК-лигаза IV,ДНК-зависимая протеинкиназа. На этом процесс реаранжировки конкретного гена завершается. Синтез и секреция антител.Результатом активизации и созревания В-лимфоцитов является образование АТ, которые реагируют специфически с эпитопами, идентифицированными его рецепторами.Плазмат. клетки синтезируют и секретируют АТ. Они распростр. во всех лимфоидн. органах и тканях, в основании ворсинок слизистой кишечника, в сальнике и соединит. ткани. Механизм синтеза антител аналогичен синтезу любых белков и происходит на рибосомах. Легкие и тяжелые цепи синтезируются отдельно, затем соединяются на полирибосомах, а окончательная их сборка происходит в пластинчатом комплексе. При первичном иммунном ответе в антителообразовании различают две фазы: индуктивную( происходит пролиферация и дифференцировка лимфоидных клеток в направлении синтеза IgM) и продуктивную (уровень АТ резко возрастает,уменьшается число клеток, синтезирующих IgM, и нарастает продукция IgA
|
||
|
Последнее изменение этой страницы: 2018-05-30; просмотров: 239. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
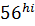 CD
CD  и CD
и CD 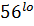 CD
CD 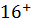 клетки (hi-высокий, lo-низкий уровень экспрессии маркера). CD
клетки (hi-высокий, lo-низкий уровень экспрессии маркера). CD