Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Гены MHC делятся на три группы.Стр 1 из 3Следующая ⇒ Билет 1, 12 1.BcR обеспечивает связывание с антигеном, активацию, пролиферацию и созреванию В-лимфоцитов, эндоцитоз антигена внутрь клетки, переработку антигена, возвращение пептидов переработанного антигена на поверхность В- клетки вместе с молекулами МНС II класса. Основная часть BCR - молекулы мембранного иммуноглобулина (mlg, состоящий из двух одинаковых тяжелых Н- и двух одинаковых легких - L-цепеи) и двух молекул CD79 (Igα, Igβ) - BcR имеет трансмембранные и внутрицитоплазматические сегменты, передающие внутриклеточные сигналы. В цитоплазматических участках Igα и Igβ присутствуют характерные последовательности аминокислотных остатков, называемые иммунорецепторными тирозинсодержащими активирующими последовательностями (ITAM).Способен участвовать в активации клетки. Связывание с лигандом двух и более рецепторов приводит к их физическому сближению на мембране. При этом их цитоплазменные концы, связанные с ферментами, оказываются в непосредственной близости. Главная часть распознает PAMP, получает заряд, заряд передается на цитоплазматическую часть рецептора и там открывается тирозин на ITAM последовательности. До этого момента параллельно независимо две CD45 взаимодействуют с сиаловыми кислотами. Превращаются в фосфотазы и дефосфорелируют Src-киназы. Src-киназы подвижно прикреплены ко внутренней поверхности мембраны.Src-киназы фосфорелируют тиразины в составе ITAM киназы. Для того, чтобы активировать сигналинг, необходимо аутофосфорилирование двух соседних BCR. В результате активируется Syk киназа.Syk киназа содержит два домена SH2. С помощью этих доменов Syk киназа фиксируется на ITAM последовательности. Для того, что бы произошел сигналинг у 2-х рецепторв нужно, что бы они были рядом, потому что две Syk киназы фосфорелируют друг друга. Для ее активации необходимо, чтобы оба тирозина в составе ITAM были фосфорилированы. Будучи прикрепленной к ITAM, она фосфорилируется киназами семейства Src, а также аутофосфорилированием.  Кроме основной части есть система корецепторв. Для того, что бы усиливать сигнал, больше каскадов. 2 вида: 1большой относится к системе комплемента – CD21, взаимодействует с C3. Второй относится к суперсемейству Ig – CD19. СD21 связывается с C3 компонентом комплемента и сигнал распространяется и передается на CD19. У него длинный цитоплазматический хвост. Когда туда приходит заряд – открываются тиразины. Они фосфорелируются Srk киназой. На эти места садится PI3 киназа и фосфолипаза-с-гамма. С81 удерживает CD21 и CD19 на мембране. PI3 киназа фосфорелирует липиды на мембране. Дифосфаты превращаются в трифосфаты. Фосфолипаза-с-гамма садится туда, у нее есть SH2 домен, фосфорелируется. Там еще есть PI3 киназа, которая приссоеденяет 3-ий фосфат. Фосфолипаза-с-гамма расщепляет липиды на мембране на 2 части: диацилглицерин, который в мембране и инозитол-3-фосфат, который идет в цитоплазму, так как он гидрофильный. В цитоплазме, в одной из частей эндоплазматического ретикулума есть хранилище кальция – кальциевое депо. В мембранах есть кальциевые белки. Иназитол-3-фосфат связывается с кальциевыми белками, меняется конформация, каналы открываются и кальций выходит из хранилища в цитоплазму. Кальций распространяется вверх к мембране и вниз к ядру. Кальций, который пошел в цитоплазму связывается с кальмодулином, котрый его фосфорелирует. Кальмодулин меняет свою конформацию и может связываться с ферментом кальцийневрином. Комплекс кальмодулин+кальцийневрин становится активной фосфотазой и дефосфорелирует NFAT, который поступает в ядро. На LAT садится протеинкиназа-с. За сет SH2, она получает заряд, меняет конформацию. Диацилглицерол связывается с диацилглицериновым рецептором пртеинкеназы-с. Кальций, который добрался до мембраны связывается с кальциевым рецепторм протеинкиназы-с. У протеинкиназы-с, открывается тирозин, который фосфорелируется Syk-киназой. Протеинкиназа-с становится активной. Протеинкиназа-с – ключевой фермент для запуска суперсемейства факторов трнаскрипции. Протеинкиназа-с фосфорелирует киназу ингибитора NF-каппа-b. Только после этого киназа ингибитора приобретает активность. Киназа ингибитора NF-каппа-В фосфорелирует ингибитор NF-каппа-В. Он диссоциирует от NF-каппа-В. NF-каппа-В поступает в ядро, а ингибитор разрушается в протеосоме. С другой стороны на LAT садится SHC белок, он связывает фосфотирозиновую группу, получает заряд, меняется конфоррмация. Его фосфорелирует syk-киназа. Рядом находится белок GRB2, в котором есть SH2 домен, который связывает эту фосфотиразиновую группу и связывает с первой. Меняется конформация, получает фосфотиразиновую группу. В составе GRB2 так же есть SH3 домен, котрый связывает пролиновый мотив в составе mSOS. Передается электрический заряд, меняется коформация mSOS и у него открывается контактная поверхность и присоединяется Ras-белок. Ras-белок присоединяет ГТФ и mSOS помогает отсоединять ГДФ. Ras белок с ГТФ получил название raf-киназа. Получает заряд, меняется конформация, открываются каталитические центры и запускается MAPK-каскад. Он состоит из 3-х ферментов – серин-треаниновых протеинкиназ, последовательно активирующих друг друга. Связывающий белок имеет 3 кармана. В этих 3-х карманах 3 белка. Самый последний фермент МАРК киназа, фермент, который его активирует – киназа МАРК киназы, а его активирует киназа киназы МАРК киназы.
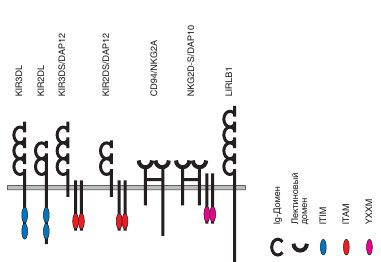
2.Эозинофилы составляют небольшую часть клеток крови (у человека —0,5–2%от числа лейкоцитов). В крови они циркулируют меньше суток (от 30 мин до 18 ч), после чего мигрируют в ткани и пребывают там в течение10–12сут. Зрелые эозинофилы представляют крупные клетки(18–20мкм в диаметре) с сегментированным (двудольным) ядром. Они содержат крупные (до 1 мкм) эозинофильные гранулы. в зрелых эозинофилах присутствуют еще три типа гранул — первичные, мелкие гранулы, а также липидные тельца. На поверхности эозинофилов присутствуют маркерные молекулы CD9 и CD35 (рецептор для комплемента — CR1). на клеточной мембране зозинофилов содержится ряд функционально важных рецепторов для антител изотипов IgG (FcγRII, FcγRIII — соответственно CD32 и CD16) и IgE (FcεRII, или CD23), цитокинов (дляIL-5,GM-CSF,IL-3и др.) и хемокинов (в особенности рецептор для эотаксинов CCR3). На поверхности эозинофилов экспрессированы молекулы MHC I и II класса, что позволяет эозинофилам выступать в качестве АПК. на поверхности эозинофилов представлены разнообразные молекулы адгезии, среди которых преобладаютβ2-,β1- иβ7-интегриныи их рецепторы. Главный щелочной белок (MBP — major basic protein), определяющий эозинофильность гранул; эозинофильный катионный белок (ECP — eosinophil cationic protein); эозинофильная пероксидаза (ЕРО — eosiophilic peroxydase) и нейротоксин, происходящий из эозинофилов (EDN —eosinophil-derived neurotoxin) — основные компоненты крупных (специфических) эозинофильных гранул. МВР представлен в кристаллической форме и формирует сердцевину гранул. Три других белка содержатся в матриксе гранул. Для МВР и ЕСР характерна токсичность в отношении гельминтов, обусловленная способностью этих молекул встраиваться в мембрану клеток гельминтов и тем самым нарушать их целостность. ECP и EDN обладают активностью фермента, расщепляющего рибонуклеиновую кислоту (РНКазы), что определяет их участие в противовирусной защите. Все четыре белка могут быть токсичными для собственных тканей организма. В специфических гранулах присутствуют также цитокины и ферменты (коллагеназа, эластаза,β-глюкурнонидаза,катепсин, РНКаза, миелопероксидаза). В мелких гранулах, присутствующих только в тканевых формах эозинофилов, содержатся ферменты (кислая фосфатаза, арилсульфатаза, пероксидаза и ряд других), а в первичных гранулах — кристаллыШарко–Лейдена,основу которых составляет липофосфолипаза. Липидные тельца содержат все необходимое для синтеза эйкозаноидов: арахидоновую кислоту, липоксигеназу и циклоксигеназу. Секреция содержимого гранул осуществляется за счет экзоцитоза и дегрануляции. При секреции кристаллический МВР переходит в растворимую форму. Роль эозинофилов в иммунной защите в первую очередь состоит в осуществлении внеклеточного цитолиза, которому принадлежит основная роль в защите от многоклеточных паразитов. В его основе лежит комплексное воздействие на обьект цитолиза продуктами респираторного взрыва и содержимого гранул, которые высвобождаются в результате дегрануляции во внеклеточную среду. Большинство белков эозинофилов повреждают клетки макропаразитов; некоторые (MBP, ECP и EPO) — также нормальные клетки организма; ECP и EDN обладают активностью рибонуклеазы и оказывают противовирусное действие. Основные белки эозинофилов способствуют развитию аллергических реакций (через активацию тучных клеток и базофилов с участием МВР), оказывают регулирующее действие на иммунные процессы (действуя на Т-клетки). Эозинофилам свойственна слабая фагоцитарная активность. При активации в них образуются и затем секретируются разнообразные бактерицидные вещества — производные «кислородного взрыва»: активные формы кислорода, перекиси, производные оксида азота, цианидов и галогенов. Эозинофилы секретируют широкий спектр цитокинов:IL-2,IL-3,IL-4,IL-5,IL-6,IL-8,IL-10,IL-12,IL-13,IL-16,IL-18,TNFα, IFNγ, TGFβ,GM-CSF,а также ряд хемокинов (эотаксин — ССL11, RANTES — ССL5,MIP-1α— ССL3), эйкозаноиды (лейкотриены, фактор агрегации тромбоцитов — PAF), нейропептиды. Хемотаксическими факторами для эозинофилов служат эотаксины (CCL11, CCL24, CCL26), RANTES, а такжеIL-5.Основные хемокиновые рецепторы эозинофилов — CCR1, CCR2 и CCR3, взаимодействующие с RANTES и эотаксинами. Именно эотаксины 1, 2 и 3 обусловливают основное направление спонтанной миграции эозинофилов — впищеварительный тракт (они локализуются в lamina propria слизистых оболочек). Во время менструальных циклов и при беременности усиливается миграция эозинофилов в матку и молочные железы, где они принимают участие в морфогенезе. Ограниченные количества эозинофилов мигрируют втимус. Привлечение эозинофилов в очаг аллергического поражения осуществляется преимущественно провоспалительным хемокином RANTES (CCL5), лейкотриенами, PAF и IL-5.Из молекул адгезии наиболее важны для миграции эозинофилов в ткани интегрины: β7- (α4β7), β1-(VLA-4— α4β1) и все триβ2-интегрина, экспрессируемые на поверхности эозинофилов. Функция эозинофилов в норме заключается в регуляции развития тучных клеток и морфогенетических процессов, связанных с беременностью и половым циклом у самок. Малоизученным остается участие эозинофилов в положительной селекции Т-клетокв тимусе. Благодаря механизму внеклеточного цитолиза, основными факторами которого служат белки гранул эозинофилов, при биологической агрессии эти клетки играют ключевую роль в защите от некоторых гельминтов и других патогенов. Являясь источником ряда цитокинов, эозинофилы участвуют в запускеTh2-зависимыхиммунных процессов, в частности аллергических. Образование эозинофилов происходит в красном костном мозге из стволовых клеток(это полипотентные клетки, которые редко делятся и могут давать начало всем форменным элементам крови).Стволовые клетки дифференцируются в полустволовые клетки двух видов: Предшественники миелопоэза и лимфопоэза. Из клеток предшественников миелопоэза, под действием регуляторов (эритропоэтина, лейкопоэтина и тромбопоэтина) образуются колониеобразующие клетки КоЕ – Гн Э (дифференцируются в нейтрофильные гранулоциты и эритроциты); КоЕ – ГМ (дифференцируются в нейтрофилы, эозинофилы, базофилы и моноциты); КоЕ –М Гц Э (в мегокариоциты и эритроциты, а также предшественники лимфопоэза. Затем деление и созревание этих клеток приводит к образованию бластов. Для эозинофилов это – миелобласт эозинофильный, который дифференцируется в промиелоцит эозинофильный. Промиелоцит дифференцируется в миелоцит. Миелоцит дифференцируется метомиелоцит палочкоядерный. Метомиелоцит палочкоядерный дифференцируется в сегментоядерный. После окончания кроветворения зрелые клетки поступают в кровь, где циркулируют 30 мин, а затем оседают в тканях (печени, почках, селезёнке и др.) Билет 2 1.Передачи информации внутри иммунной системы осуществляется несколькими механизмами: 1) образованием информационного мостика (контактный киллинг); 2)рецептор-рецепторным взаимодействием; 3)информационным обменом с помощью химического мессенджера (цитокинов, хемокинов) Виды рецепции входящего сигнала: 1) Внутренняя рецепция (с помощью рецепторов, находящихся в цитоплазме) 2) Внешняя или мембранная (является главной). Она может быть как наружной,когда рецепторы находятся на цитоплазматической мембране, и внутренней – трецептор находится на внутренних мембранах (ЭПР, лизосомы, вакуоли). Осуществляется в 2 этапа: 1 – проникновение лиганда через мембрану. 2 – взаимодействие лиганда с рецепрором, в результате образуется лиганд-рецепторный комплекс. Этот комплекс превращается в фактор транскрипции, проникает через ядерную пору пору в ядро по принципу пространственной комплементарности. Находит промоторную зону своего гена и связываясь с ней формирует докинсайт для сборки ферментов транскрипции (ДНК-зависимая РНК-полимераза). Этот фермент состоит из 3 субъединиц, которые могут собраться только при наличии ДНК-промоторной полимеразы. Распознавание и связывание лиганда осуществляет внеклеточный домен. Распознавание осуществляется по принципу пространственной комплементарности при этом образуется множество нековолентных связей. В результате образуется электрическое поле, электрический заряд распостраняется по трансмембранной части , меняется заряд, конформация молекулы и на цитоплазматической части открываются активные центры: каталитические ферментативные (начинают запускать ферментативные каскады), контактная поверхность (находящийся рядом фермент, взаимодействуя с контактной поверхностью, запускает ферментативный каскад). Ферментов запускающих каскад может бать как 1 так и несколько. Каждый каскад проходит через всю цитоплазму и доходит до ядра. Основные элементы внутриклеточной системы передачи сигнала : ферменты, адапторные белки, низкомолекулярные вторичные мессенджеры, факторы транскрипции. Принципы фиксации подмембранных элементов сигналинга. Фермент Е1 всегда находится под рецептором и подвижно зафиксирован под мембраной. Е2 подвижно зафиксирован под мембраной. Адаптерные белки удерживаюи Е 3 в непосредственной близости от Е2 и осуществляют переход от подмембранного пространства к цитоплазме. Е3 находится в цитоплазме и активирует сразу много других цитоплазматических ферментов, каждый из которых запускает свой ферментативный каскад. 2.Тучные клетки (мастоциты) и базофилы имеют костномозговое происхождение и принадлежат к миелоидному ряду. Предполагают, что у тучных клеток и базофилов есть общий предшественник. Однако, неясно, развиваются ли они непосредственно из общего миелоидного предшественника или служат ответвлением эозинофильно-базофильного. Под действием цитокинов (GM-CSF и IL-5) общий миелоидный предшественник дифференцируется в предшественника эозинофильно-базафильного. Затем эта клетка предшественник эозинофильно-базофильный под действием комплекса факторов, главные из которых SCF дифференцируется в предшественника базофила. А под действием IL-3 – в предшественника тучной клетки. Окончательная дифференциация предшественников этих клеток происходит в селезенке. Базофилы могут созревать как в костном мозгу, так и в селезенке, и мигрируют в кровоток. Предшественники тучных клеток поступают в кровоток. Из кровотока предшественники тучных клеток мигрируют в ткани (в наибольшем количестве — в слизистую оболочку кишечника), где и завершается созревание мастоцитов. Основные факторы, определяющие дифференцировку тучных клеток — SCF и IL-3; в качестве кофакторов выступают IL-4, IL-9, IL-10 и фактор роста нервов (NGF). В частности, эти факторы обусловливают формирование гранул и пролиферацию клеток. В слизистых оболочках в роли фактора, необходимого для развития тучных клеток, выступает IL-33. Тучные клетки представляют собой овальные или круглые клетки диаметром 10—13 мкм, цитоплазма которых заполнена базофильными секреторными гранулами. Сравнительно мелкое сферическое ядро расположено центрально, часто маскируется цитоплазматическими гранулами. Диаметр секреторных гранул составляет 0,3— 2,0 мкм. Они имеют гетерогенную внутреннюю структуру, представленную отчетливыми элементами в виде свитков. Базофилы имеют округлую форму, палочкоядерное или сегментоядерное ядро. В цитоплазме содержатся различные по величине и форме гранулы. Среди мембранных молекул тучных клеток и базофилов наиболее важны для реализации их функции высокоаффинные рецепторы IgE — FcεRI. FcεRI состоит из трех вариантов цепей: альфа, бета и гамма и в интактном состоянии имеет структуру альфа-бета-гамма2 альфа цепь ориентирована внеклеточно и является местом приклепления молекулы IgЕ к клетке, гамма цепь представлена димером. Каждая из субъединиц у цепи несет цитоплазматический, направленный в клетку хвост. ответственный за передачу сигнала. В отличие от альфа и гамма цепей бета цепь четыре раза пересекает клеточную мембрану и тоже, подобно у цепи, имеет цитоплазматический хвост: такая структура позволяет бета цепи быть передатчиком сигнала в клетку и играть роль кальциевого канала. Тучные клетки локализуются в подслизистом слое слизистых оболочек (особенно в кишечнике), дерме, серозных оболочках, селезенке, периваскулярной соединительной ткани. В 1 г названных тканей содержится 104–106 тучных клеток.Для тучных клеток характерны поверхностные маркеры: CD117 (с-Kit) — рецептор для SCF и CD123 — рецептор для IL-3. Тучные клетки несут на своей поверхности также высокоаффинные FcγI-рецепторы и рецепторы для компонентов комплемента C3b и С3d (мукозные тучные клетки лишены CR1), что свидетельствует об их участии в реакциях врожденного иммунитета. На поверхности тучных клеток присутствуют молекулы МНС обоих классов; наличие МНС-II, а также костимулирующих молекул CD86 придает мастоцитам способность выполнять функции АПК, особенно при индукции Th2-клеток. Тучные клетки несут некоторые патогенраспознающие рецепторы (TLR-2, TLR-3, TLR-4), что позволяет им распознавать патогены и их продукты напрямую. В противоположность тучным клеткам базофилы в норме представлены в кровяном русле. Их содержание в крови очень невелико — до 0,5% от числа лейкоцитов. Для базофилов миграция в очаг аллергии — основное условие выполнения их функций.На них больше, чем на тучных клетках, экспрессировано рецепторов для хемотаксических факторов — бактериального формилметионильного пептида, анафилатоксинов С3а и С5а, α- и β-хемокинов (СXCR1, СXCR4, CCR1, CCR2, CCR3). В отличие от мастоцитов, базофилы не экспрессируют FcRγI. Не несут на своей поверхности с-Кit. Спектр TLR, экспрессируемых базофилами, значительно беднее, чем у тучных клеток. Спектр активных веществ, секретируемых базофилами, ограничен; он включает: лейкотриен C4, IL-4, IL-13 и ряд других цитокинов. Функция базофилов в тканях сходна с функцией тучных клеток — они поддерживают аллергический процесс, инициированный тучными клетками, высвобождая содержимое гранул в ответ на перекрестное связывание FcεRI. В отличие от тучных клеток, базофилы не способны восстанавливать гранулы. Активаторы тучных клеток подразделяются на IgE-зависимые (антигены) и IgE-независимые.К IgE-независимым активаторам тучных клеток относятсяанафилатоксинами (С3а, С4а, С5а), различными лекарственными веществами (например, такими, как синтетический АКТГ, кодеин, морфин) и соединениями, индуцирующими поток Са2+ в клетку.Тучные клетки могут активироваться и под действием физических факторов: холода, механического раздражения, тепла и физической нагрузки. При IgE-зависимой активации антиген должен соединиться по крайней мере с двумя молекулами IgE на поверхности тучной клетки, поэтому антигены, несущие один участок связывания с антителом, не активируют тучные клетки. Перекрестное связывание фиксированных IgE на тучных клетках ведет к агрегации Fcε-рецепторов и активации ассоциированных с ними тирозинкиназ (ТК). Под влиянием ТК происходит фосфорилирование фосфолипазы С (ФЛС). которая превращает фосфатидилинозитол-4,5-бисфосфат (ФФ;) в диацилглицерол (ДГ) и инозитолтрифосфат (ИФ3). ДГ активирует протеинкиназу С (ПКС), которая вместе Са2+ необходима для сборки микротрубочек и слияния гранул, содержащих биологически активные вещества с плазматической мембраной клетки. ИФ3 мобилизует внутриклеточные запасы Са2+. Перекрестное связывание FcεR также активирует энзимы, которые превращают фосфатидилсерииы (ФС) в фосфатидилэтаноламины (ФЭТ). Фактически ФЭТ метилируются в фосфатидилхолины (ФХ) с помощью фосфолипидметилтрансфераз (ФМТ). Аккумуляция ФХ на поверхности магматической мембраны приводит к увеличению подвижности мембраны и способствует формированию Са2+-каналов. Поступающий в клетку Са2+ активирует фосфолипазу А2 (ФЛ-А2), которая стимулирует превращение ФХ в лизофосфатидилхолины и арахидоновую кислоту. Арахидоновая кислота конвертируется в медиаторы двух типов: лейкотриены и простагландины. Перекрестное связывание FcεRI также активирует мембранные аденилатциклазы. приводящие к транзиторному повышению цАМФ . цАМФ-зависимые протеинкиназы также фюсфорилируют мембранные белки, тем самым повышая их проницаемость для воды и Са2+. Набухание гранул в результате этих процессов облегчает их слияние с плазматической мембраной клетки и. таким образом, способствует высвобождению медиаторов. Все медиаторы, выбрасываемые из тучных клеток, делятся на первичные и вторичные. Первичные медиаторы продуцируются в клетках до дегрануляции и хранятся в гранулах. К наиболее значимым из них относятся гистамин, серотонин, Фактор хемотаксиса эозинофилови, фактор хемотаксиса нейтрофилов, протеазы, гепарин. Вторичные медиаторы синтезируются после антигенной активации клеток. К ним относятся фактор активации тромбоцитов, лейкотриены, простагландины, брадикинины, цитокины: ИЛ-1, ФНО-α, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ФРО-β, ГМ-КСФ. В различных тканях и анатомических зонах концентрации и спектр первичных и вторичных медиаторов, содержащихся в тучных клетках, не одинаковы. Билет 3, 10, 18 1. TCR – сигналинг.TCR — сложная многокомпонентная структура из двух распознающих антиген цепей (α и β), соединенных дисульфидной связью, и нековалентно связанных сигнальных субъединиц СDЗ-комплекса, способных передавать активационный сигнал в клетку. Также в составе TCR есть субъединицы CD8 и CD28, которые тоже передают активационный сигнал в клетку. Любой сигналинг начинается с взаимодействия CD45 с сиаловыми кислотами. В результате происходит диссоциация двух субъединиц CD45.Цитоплазматический домен CD45 приобретает фосфотазную активность и начинает дефосфорилировать саркомовые киназы. Сближение клеток MHCI или MHCII презентирует комплекс антиген – пептид, который связывается в антигенсвязывающем центре. В результате контактного взаимодействия поверхностей изменяется заряд и конформация и заряд передается дзета цепям. Корецептор CD3 находится в непосредственной близости и заряд передается CD3. Происходит изменение конформации и его тирозины выворачиваются в раствор.Тирозин фосфорилируют PI3 киназы и как результата много фосфотирозина. На них фиксируются ферменты сигналинга. В цитоплазматической части дзета-цепи расположены 3 последовательности ITAM, предназначенные для взаимодействия с остатками тирозина тирозинкиназы ZAP-70 — ключевого фактора в передаче сигнала от TCR при его связывании с лигандом. ZAP-70 родная сестра Syk киназы. С помощью домена SH2 фермент ZAP-70 фиксируется на ITAM последовательности дзета цепей. Получает заряд, меняет конформацию, открываются ее собственные тирозины и саркомовые киназы фосфорилируют ZAP-70.Дальнейшая передача сигнала обусловлена взаимодействием ZAP-70 с ее главным субстратом — адапторным белком LAT. Этот белок связан с мембраной и входит в состав рафтов. ZAP-70 связывается с LAT, образуется заряд, который проходит через мембрану и распространяется по липидному слою мембраны. В том месте , где проходит заряд мембрана меняет свою стуктуру и становится жидкой. Возникает «липидное озеро». Это озеро вместе с зарядом распространяется и когда достигает LAT отдает ему заряд. LAT открывает свои тирозины, которые фосфорилируются Srk киназой.PI3 киназа фосфорелирует липиды на мембране. Дифосфаты превращаются в трифосфаты. Фосфолипаза-с-гамма садится туда, у нее есть SH2 домен, фосфорелируется. Там еще есть PI3 киназа, которая приссоеденяет 3-ий фосфат. Фосфолипаза-с-гамма расщепляет липиды на мембране на 2 части: диацилглицерин, который в мембране и инозитол-3-фосфат, который идет в цитоплазму, так как он гидрофильный. В цитоплазме, в одной из частей эндоплазматического ретикулума есть хранилище кальция – кальциевое депо. В мембранах есть кальциевые белки. Иназитол-3-фосфат связывается с кальциевыми белками, меняется конформация, каналы открываются и кальций выходит из хранилища в цитоплазму. Кальций распространяется вверх к мембране и вниз к ядру. Кальций, который пошел в цитоплазму связывается с кальмодулином, котрый его фосфорелирует. Кальмодулин меняет свою конформацию и может связываться с ферментом кальцийневрином. Комплекс кальмодулин+кальцийневрин становится активной фосфотазой и дефосфорелирует NFAT, котрый поступает в ядро. На LAT садится протеинкиназа-с. За сет SH2, она получает заряд, меняет конформацию. Диацилглицерол связывается с диацилглицериновым рецептором пртеинкеназы-с. Кальций, который добрался до мембраны связывается с кальциевым рецепторм протеинкиназы-с. У протеинкиназы-с, открывается тирозин, который фосфорелируется ZAP-70. Протеинкиназа-с становится активной. Протеинкиназа-с – ключевой фермент для запуска суперсемейства факторов трнаскрипции. Протеинкиназа-с фосфорелирует киназу ингибитора NF-каппа-b. Только после этого киназа ингибитора приобретает активность. Киназа ингибитора NF-каппа-В фосфорелирует ингибитор NF-каппа-В. Он диссоциирует от NF-каппа-В. NF-каппа-В поступает в ядро, а ингибитор разрушается в протеосоме. С другой стороны на LAT садится SHC белок, он связывает фосфотирозиновую группу, получает заряд, меняется конфоррмация. Его фосфорелирует syk-киназа. Рядом находится белок GRB2, в котором есть SH2 домен, который связывает эту фосфотиразиновую группу и связывает с первой. Меняется конформация, получает фосфотиразиновую группу. В составе GRB2 так же есть SH3 домен, котрый связывает пролиновый мотив в составе mSOS. Передается электрический заряд, меняется коформация mSOS и у него открывается контактная поверхность и присоединяется Ras-белок. Ras-белок присоединяет ГТФ и mSOS помогает отсоединять ГДФ. Ras белок с ГТФ получил название raf-киназа. Получает заряд, меняется конформация, открываются каталитические центры и запускается MAPK-каскад. Он состоит из 3-х ферментов – серин-треаниновых протеинкиназ, последовательно активирующих друг друга. Связывающий белок имеет 3 кармана. В этих 3-х карманах 3 белка. Самый последний фермент МАРК киназа, фермент, который его активирует – киназа МАРК киназы, а его активирует киназа киназы МАРК киназы. 2.NK-клетки – крупные (10-12 мкм) лимфоциты с азурофильной зернистостью в цитоплазме (гранулярные лимфоциты). Перфорин, гранзимы, гранулолизин-основные компоненты гранул NK. Отличие NK-клеток от других популяций лимфоцитов-отсутствие на NK-клетках антигенспецифических рецепторов, кодируемых генами, перестраиваемыми в процессе дифференцировки клеток. NK-клетки развиваются в кост. м. и происходят от общего лимфоидного предшественника, который дает начало всем разновидностям лимфоцитов. В развитииNK-клеток важную роль играет влияние микроокружение, реализуемое через прямые межклеточные контакты и посредством цитокинов (взаимодействие представленного на мембране NK-клетки лимфотаксина α с рецепторами на стромальных клетках). Цитокины IL-7, IL-15, а также Ftl-3 необходимы для дифференцировки натуральных киллеров. На этапе выбора пути дифференцировки от общего лимфоидного предшественника в направлении Т- и В-линий, потенциал развития сохраняется за Т/ NKР клетками. На Т/ NKР клетках экспрессируются CD34, C-kit, Fit-3, CD132(γ). Условие дифференцировки NK-клеток – экспрессия внутриклеточных факторов дифференцировки Id2 и Ets1. После отделения от Т-линии дифференцирующие NK-клетки обозначаются NKР-клетки. При переходе на эту стадию развития на поверхности клетки экспрессируется β-цепь(122), общая для рецептов IL-2 и IL-15. Затем клетка экспрессирует α-цепь рецептора для IL-15. IL-15- становится основным цитокином определяющий развитие, выживаемость, гомеостаз NK-клеток. Формирование зрелой NK-клетки происходит при участии IL-15, IL-18, IL-12. Характерно последовательное появление маркеров и рецепторов для NK-клеток: NK1.1, CD94/NKG2 и NKG2D. Важное условие экспрессии рецепторных молекул Ly49, CD94/NKG2 взаимодействие NKР-клеток со стромальными клетками костного мозга, экспрессирующими молекулы МНС-1- лиганды этих рецептов. В то же время на NK-клетках появляются интегрины(β2-интегрин Мас-I(αмβ2)), и исчезает молекула CD34. Происходит несколько актов деления NK-клетки. Переход от стадии NKР к зрелым NK-клеткам блокируется при выключении генов самого IL-15, α-цепи его рецептора и связанной с ней тирозинкиназы Jak3, транскрипционных факторов STAT5(αβ), обеспечивающий передачу сигнала от рецептора, и факторов IRF-1и IRF-2, необходимых для секреции IL-15. Зрелые NK-клетки покидают кост. м. и мигрируют в периферический отдел ИС. Находится в циркуляции периферической крови, в синусоидах печени, эндометрии матки, лимфатических узлах, селезенке в красной пульпе. 5% NK-клеток крови экспрессирует рецептор ССR7, учавствующий в преодолении эндотелиального барьера в посткапиллярных венулах и миграции лимфоцитов в Т-зоны вторичных лимфоидных органов. Расселение натуральных киллеров обусловлено хемокиновыми рецепторами: CXCR4, CCR1, CCR5. Эти рецепторы определяют миграцию клеток по градиенту хемокинов: CXCL12(SDF-1) и многих β хемокинов. Выживаемость NK-клеток зависит от IL-15, дополнительную роль в поддержании жизнеспособности играет IL-17. Выделяют активирующие и ингибирующие рецепторы NK-клеток. К активир. р-рам относятся группы: KIR, CD94/ NKG2, NKG2D, FcR, NCR. Основной из них рецептор NKG2D-трансмембранный белок 2 типа (наружу направлен С-конец молекулы), С-лектин. В мембране NKG2D электростатически связан с адапторным белком DAP-10, имеющий в своей цитоплазматической части активационный мотив YXXM (образован остатками тирозина и метионина, разделенными двумя любыми аминокислотными остатками). При связывании рецептора с лигандом (MICA,MICB) происходит фосфолирование остатка тирозина в этом мотиве, что обеспечивает взаимодействие YXXM с липидной киназой-PI3K, приводящее к ее фосфорилированию и активации. Далее активационный сигнал поступает в ядро, где происходит индукция комплекса генов, связанных с цитолизом. Ф-ция ингибир. р-ров – предотвращение контактного цитолиза клеток-мишеней, несущих те же молекулы МНС-1, что и сама NK-клетка. Группы ингибир. р-ров: KIR, CD94/ NKG2, LILR. Все они распознают молекулы МНС-1: одна группа рецепторов распознает все молекулы МНС-1 независимо от их аллельной принадлежности(CD94/ NKG2 и LILR); другая распознает определенные аллельные формы молекулы-HLA-C, HLA-A, HLA-B, HLA-G(KIR). Ингибир. Р-ры имеют длинный цитоплазматический участок, содержащий последовательность ITIM. Через нее рецептор контактирует с тирозинтрифосфатазами семейства SHP1, SHP2, SHIP, десфосфорилирующими активированные белки, и тем самым прерывающими активационный сигнал.
1,2ITIM 3,4ITAM 5YXXM
Наличие мотива ITАM или ITIM в цитоплазматической части молекулы или дополнительной полипептидной цепи определяет тип рецептора- активирующий или ингибирующий. Группы KIR, CD94/ NKG2 содержат как ингибирующие, так и активирующие рецепторы. NK-клетки могут вызывать несекреторный и секреторный лизис клетки- мишени. Несекреторный лизис происходит, когда клетки-мишени имеют рецепторы апоптоза типа антигена CD95(Fas, или APO-1), а взаимодействующие с ними NK-клетки имеют Fas-лиганд, включающий апоптоз. Обычно цитотоксическое действие NK-клеток обусловлено перфоринзависимым механизмом-секреторным лизисом, как и у цитотоксических Т-лимфоцитов. Они имеют гранулы с цитотоксическими веществами, сходные с перфорином, гранулизимом, гранзимом Т-цитотоксических лимфоцитов. Перфорины и гранулизины, проникнув в мембрану клетки-мишени, полимеризуются, образуя пору из 10-20 мономеров. Через перфориновые поры в клетку проникают гранзимы (сериновые протеазы), которые активируют каспазы, запускающие апоптоз клетки-мишени. NK-клетки могут уничтожать клетки-мишени покрытые антителами (антителозависимый). При соединении Fc-рецепторов (CD16) NK-клетки с Fc-фрагментом антител, покрывающих клетку-мишень, развивается антителозависимая клеточная (клеточно-опосредственная) цитотоксичность и гибель клетки-мишени. Выделяют 2 субпопуляции NK-клеток, различающиеся соотношением мембранных маркеров и функциями: CD Наиболее важные функции NK-клеток-цитотоксическая активность в отношении(трансформированных, инфицированных вирусами, подвергшихся действию стресса) клеток организма и секреция цитокинов ( в первую очередь IFNγ), что играет важную роль в регуляции иммунных процессов.
Билет 4 1. Способы рецепции входящего сигнала:1. Внешняя(мембранная) 2. Внутренняя (цитоплазматическая). Этапы1. Проникновение лиганда ч/з мембрану. 2. Взаимодействие лиганда с рецепторами (LR) – здесь он превращается в фактор транскрипции, способен проникать в ядро по типу пространственной комплементарности, находит промоторную область своего гена и связывается с ней, формируя докин сайт для сборки фермента транскрипции, который называется ДНК-зависимая РНК-полимераза(состоит из 3х субъединиц).Запускают синтез гена. Осуществляется передача сигнала. Распознование и связывание лиганда происходит по принципу пространственной комплементарности, при этом между двумя распознающимися поверхностями образуется множество ковалентных взаимодействий( водородные, гидрофобные, электростатические)Эти все виды явл-ся электрическими. В рез-те образуется элек. Поле.Заряд распросраняется по трансмембранной части внутриклеточно, в результате менеятся конформация молекулы и на цитоплазматической части открываются активные центры:1) ферментативные каталитические центы на ЦП мембране, которые запускаю ферментативные сигнальные каскады. 2) на ЦП-ой части открывается контактная поверхность, сней взаимодействует фермент, находящийся рядом, который запускает ферментативный каскад. Каждый ферментативный каскад проходит ч/з всю цитоплазму и заканчивается образованием фактора транскрипции. Организация системы трайд Е1- ферментначинает транскрипцию, находится рядом с доменом ЦП рецептора,под мембраной Е2 – также. Е3 – распол-ся: переход от подмембранного к цитоплазме. Адаптерные белки удерживают Е3 с Е2и осуществляю переход от постмембранного в цитоплазматическое пространство. Е3 активирует много других цитоплазматических ферментов, каждый из которых запускают свой ферментативный каскад. Хим реакция, которая используется при сигнальных реакциях – фосфорилирование. Субстрат-боковые остатки АК тирозин. Обр-ся фосфотирозин. Фосфотирозиновые группы обладают большим зарядом и значительным размером, поэтому их образование изменяет конформацию белка, что приводит к его активации. Они используются: 1Регуляторные функции – активируют белок. 2. Отсоединение фосфатной группы. 3. Организация докин сайтов. Они необходимы ферментам сигналинга для фиксации на адаптерных белках. Эти докинг-сайты могут быть неупорядочены, упорядоченые, формируя иммунорецепторные последовательности1. ITAM- — тирозинсодержащий активационный мотив (последовательности аминокислот), структуры иммунорецепторов. Локализован в цитоплазматическом домене белков мембраны ИКК (ТСR, ВCR и др.). Обеспечивает проведение внутриклеточного сигнала, определяющего процессы активации лимфоцитов. 2. ITIM тирозинсодержащий ингибиторный мотив иммунорецепторов, локализующийся в цитоплазматическом домене ряда из них (Fc и др.). Участвует в формировании и проведении внутриклеточного сигнала, вызывающего ингибицию функциональной активности иммунокомпетентных клеток. Ферменты сигнальных каскад 1. Фосфорилирование белков а) ГТФ-азы б) протеинкиназы в) протеинфосфатазы 2. Фосфорилирование и расщепление липидов а) фосфоиназитол-3-киназы б) фосфолипазы ГТФ-азы 1 G- белок 2 сигнальный белок RAS G –белок(α,β,γ) : два якоря на α и β субъединицах. Серпантинные рецепторы, представляют собой перли, пересекающие мембрану и формирующие каскады путем взаимодействия с G- белком, он диссоциирует на 2 части:α+β и γ. Эти части открывают собственные каталитические центры Так работают рецепторы хемокинов. RAS белок состоит из α спиралей и β складок. Передача сигнала. SHC белок связывает фосфотирозиновую группу, получает заряд, меняется конфоррмация. Рядом находится белок GRB2, в котором есть SH2 домен, который связывает эту фосфотиразиновую группу и связывает с первой. Меняется конформация, получает фосфотиразиновую группу. В составе GRB2 так же есть SH3 домен, котрый связывает пролиновый мотив в составе mSOS. Передается электрический заряд, меняется коформация mSOS и у него открывается контактная поверхность и присоединяется Ras-белок. Ras-белок присоединяет ГТФ и mSOS помогает отсоединять ГДФ. Ras белок с ГТФ получил название raf-киназа. Получает заряд, меняется конформация, открываются каталитические центры и запускается MAPK-каскад. Он состоит из 3-х ферментов – серин-треаниновых протеинкиназ, последовательно активирующих друг друга. Связывающий белок имеет 3 кармана. В этих 3-х карманах 3 белка. Самый последний фермент МАРК киназа, фермент, который его активирует – киназа МАРК киназы, а его активирует киназа киназы МАРК киназы. Протеинкиназы 1 Серинпротеиновые: мембранноассоциированные – протеинкиназы С(α,β,γ) 2 тирозиновые – RAFкиназы, MAPKкиназы. Протеинкмназы С – для запуска суперсемейства фактора транскрипции (NFᴂB состоит из 2х субъединиц, живут в околоядерной мембране). Протеинкиназа-с фосфорелирует киназу ингибитора NF-каппа-b. Только после этого киназа ингибитора приобретает активность. Киназа ингибитора NF-каппа-В фосфорелирует ингибитор NF-каппа-В. Он диссоциирует от NF-каппа-В. NF-каппа-В поступает в ядро, а ингибитор разрушается в протеосоме. Протеинкиназа С может фосфорилироватьRAF киназу, которая запускает MAPK каскад. Тирозиновые киназы 1) Группа саркомовых киназ Srk киназы. 2) М70 киназы. 3)TEC киназы. 4) JAK киназы. JAK киназы – боковая веточка эволюции.Работает только с рецепторами интерлейкинов.Работают в паре, активируются аутофосфорилированием друг друга.Цитокиновые рецепторы обычно в собранном состоянии, на клетке их нет. Они состоят из 2-3 субъединиц. Когда появляется цитокин, он связывается с главной субъединицей, после заряда меняется конформация и присоединяется вторая субъединица. Заряд передается в ЦП часть второй субъеединице рецептора. С каждой субъединицей связываетсясвои YAK киназы. Они получают заряд, меняется конформация, открываются каталитические центры, они фосфорилируют друг друга. На них садятся факторы транскрипции STAT белки. С YAK киназой два STAT белка, один получает заряд, открываются тирозины,они фосфорилируются YAK киназой, дальше они идут в ядро STAT. Фосфолипазы. Фосфолипаза-с-гамма расщепляет липиды на мембране на 2 части: диацилглицерин, который в мембране и инозитол-3-фосфат, который идет в цитоплазму, так как он гидрофильный. В цитоплазме, в одной из частей эндоплазматического ретикулума есть хранилище кальция – кальциевое депо. В мембранах есть кальциевые белки. Иназитол-3-фосфат связывается с кальциевыми белками, меняется конформация, каналы открываются и кальций выходит из хранилища в цитоплазму. Кальций распространяется вверх к мембране и вниз к ядру. Кальций, который пошел в цитоплазму связывается с кальмодулином, котрый его фосфорелирует. Кальмодулин меняет свою конформацию и может связываться с ферментом кальцийневрином. Комплекс кальмодулин+кальцийневрин становится активной фосфотазой и дефосфорелирует NFAT, котрый поступает в ядро. На LAT садится протеинкиназа-с. За сет SH2, она получает заряд, меняет конформацию. Диацилглицерол связывается с диацилглицериновым рецептором пртеинкеназы-с. Кальций, который добрался до мембраны связывается с кальциевым рецепторм протеинкиназы-с. У протеинкиназы-с, открывается тирозин, который фосфорелируется Syk-киназой. Протеинкиназа-с становится активной. 2. моноцитопоэз идет в костном мозге. Продукция моноцитов в костном мозге находится под контролем целой группы ростовых факторов: ИЛ-3 и колониестимулирующие факторы (ГМ-КСФ, M-КСФ) стимулируют митотическую активность предшественников моноцитов, а простагландин Е (ПГE) и интерфероны (IFN-α, IFN-β) ингибируют деление этих клеток. Образовавшиеся в костном мозге моноциты менее чем через сутки мигрируют в периферическую кровь. Часть из них остается в костном мозге, превращаясь в резидентные макрофаги костного мозга. В крови моноциты распределяются на пристеночный и циркулирующий пулы. В ткань – макрофаг. стволовая клетка; монобласт; промоноцит; моноцит костного мозга; моноцит периферической крови; тканевой макрофаг . Макрофаги локализуются в определённых участках лимфоидной ткани: медуллярных тяжах лимфатических узлов, красной и белой пульпы селезёнки. Клетки, производные моноцитов, присутствуют практически во всех нелимфоидных органах: клетки Купфера в печени, микроглия нервной системы, альвеолярные макрофаги, клетки Лангерганса кожи, остеокласты, макрофаги слизистых оболочек и серозных полостей, интерстициальной ткани сердца, поджелудочной железы, мезангиальные клетки почек (на рисунке не показаны). Макрофаги способствуют поддержанию гомеостаза, очищая организм от стареющих и апоптотических клеток, восстанавливая ткани после инфекции и травмы. Презентация анттигена TCR расспознает антигенную детерминанту(эпитоп), экпресс-ю на поверхности АПК вместе с молекулой MHC II класса.участвуют CD4. В результате взаимодействия АПК секрктируют IL1, стиму-е в Th синтез и секрецию цитокинов. Показаны CD40/CD40L и CD28/B7- участвуют в проведение костимулирующих сигналов, нужных для активации клеток. Фагоцитоз -поглощение клеткой частиц размером более 0,5 мкм. выделяют 8 стадий фагоцитоза : приближение к объекту фагоцитоза в результате хемотаксиса; адгезия; активация мембраны; погружение; образование фагосомы; слияние фагосомы и лизосомы; киллинг и расщепление объектов фагоцитоза; выброс продуктов деградации Распознавание мишеней фагоцитоза через различные мембранные рецепторы фагоцитов приводит к запуску процессов активации и к погружению и последующему разрушению частицы( Fc-рецепторов и рецепторы системы комплемента) Это приводит (за счет конформационных изменений) к активации прилежащих к цитоплазматической части рецепторовтирозинкиназ семейства Src. Эти киназы фосфорилируют цитоплазматические участки рецептора, в том числе остатки тирозина в мотиве ITAM, Далее активационная волна передается на ряд ферментов. На данном этапе наиболее важна активация двух ферментов: PI3K и PLC. Следующий этап активации направлен на образование продуктов, участвующих в полимеризации актина — процесс, на котором основан фагоцитоз. Для реализации этого этапа необходимо участие ГТФаз — Rac-1,Cdc42 (их активность преобладает при FcγR-зависимом фагоцитозе) и Rho (задействована преимущественно в комплемент-зависимом поглощении частицы). На мембране макрофагов экспрессированы различные рецепторы для захвата микроорганизмов: макрофагальный маннозный рецептор (ММR), scavenger-рецептор (MSR), рецепторы для бактериального липополисахарида (CD14). MMR опосредует захват многих микроорганизмов: Mycobacteria, Leishmania, Legionella, Pseudomonas aeruginosa и др. Через MSR идет эндоцитоз модифицированных липопротеинов при превращении макрофага в пенистую клетку. Через те же MSR мгут фагоцитироваться большинство бактерий как Грам-положительных, так и Грамотрицательных. Однако влияние бактериального липополисахарида (ЛПС) на макрофаги опосредовано специальным рецептором CD14. Экспрессия этого рецептора повышается на макрофагах при воспалении и иммунном ответе. Рецепторы для комплемента - CR3 (интегрин CD11b/CD18) и CR4 (интегрин CD11c/CD18). Помимо комплемента они связывают и ряд бактериальных продуктов: ЛПС, липофосфогликан Leishmania, гемагглютинин из филаментов Bordetella, поверхностные структуры дрожжевых клеток Candida и грибков Histoplasma. - CD64 - рецептор для Fc-фрагментов IgG - FcγRI (Fcy-рецептор первого типа), обеспечивающий фагоцитоз макрофагами иммунных комплексов. Сила связывания FcyRI с иммуноглобулинами различных изотипов убывает в ряду: IgG3 > IgG1 > IgG4 > CD40, B7, MHC-II - мембранные молекулы для контактов с комплементарными мембранными молекулами лимфоцитов, т.е. для непосредственных межклеточных взаимодействий. Кислороднезависимые механизмы внутриклеточной цитотоксичности фагоцита обеспечиваются действием лизосомальных ферментов, разрушающих объект фагоцитоза. 1. Лизоцим разрушает клеточную стенку бактерий. 2. Катионные белки повреждают бактериальную цитоплазматическую мембрану. 3. Рибонуклеаза разрушает РНК микроорганизмов. Дезоксирибонуклеаза разрушает ДНК микробов. 4. Лактоферрин активно связывает железо, необходимое для размножения бактерий. Б. Кислородзависимые механизмы внутриклеточной цитотоксичности фагоцита описываются как «респираторный взрыв» при активации НАДФ Н2 1. После поглощения объекта фагоцитоза у фагоцита возрастает потребность в кислороде, вследствие которой происходит интенсификация метаболизма О2. 2. В результате резко повышается синтез токсических кислородных продуктов, обладающих микробоцидной активностью (ведущий из них – синглетный кислород; кроме него к этой группе веществ относятся супероксидный радикал, перекись водорода и катализирующая ее токсическое воздействие на микроорганизмы миелопероксидаза, гидроксильный радикал, хлорноватистая кислота). Функции моноцитов - макрофагов (система фагоцитирующих мононуклеаров): фагоцитарная защита организма против микробной инфекции; токсический эффект метаболитов макрофагов на паразитов в организме человека; участие в иммунном ответе организма и воспалении; регенерация тканей и противоопухолевая защита; регуляция гемопоэза; фагоцитоз старых и поврежденных клеток крови, регуляция продукции острофазных белков печенью.
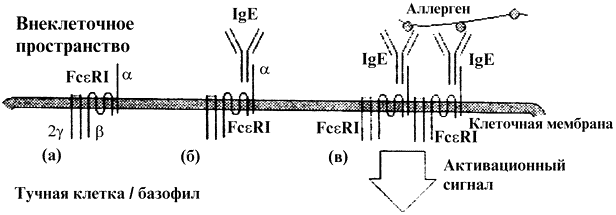
Билет 5 1. TCR – сигналинг.TCR — сложная многокомпонентная структура из двух распознающих антиген цепей (α и β), соединенных дисульфидной связью, и нековалентно связанных сигнальных субъединиц СDЗ-комплекса, способных передавать активационный сигнал в клетку. Также в составе TCR есть субъединицы CD8 и CD28, которые тоже передают активационный сигнал в клетку. Любой сигналинг начинается с взаимодействия CD45 с сиаловыми кислотами. В результате происходит диссоциация двух субъединиц CD45.Цитоплазматический домен CD45 приобретает фосфотазную активность и начинает дефосфорилировать саркомовые киназы. Сближение клеток MHCI или MHCII презентирует комплекс антиген – пептид, который связывается в антигенсвязывающем центре. В результате контактного взаимодействия поверхностей изменяется заряд и конформация и заряд передается дзета цепям. Корецептор CD3 находится в непосредственной близости и заряд передается CD3. Происходит изменение конформации и его тирозины выворачиваются в раствор.Тирозин фосфорилируют PI3 киназы и как результата много фосфотирозина. На них фиксируются ферменты сигналинга. В цитоплазматической части дзета-цепи расположены 3 последовательности ITAM, предназначенные для взаимодействия с остатками тирозина тирозинкиназы ZAP-70 — ключевого фактора в передаче сигнала от TCR при его связывании с лигандом. ZAP-70 родная сестра Syk киназы. С помощью домена SH2 фермент ZAP-70 фиксируется на ITAM последовательности дзета цепей. Получает заряд, меняет конформацию, открываются ее собственные тирозины и саркомовые киназы фосфорилируют ZAP-70.Дальнейшая передача сигнала обусловлена взаимодействием ZAP-70 с ее главным субстратом — адапторным белком LAT. Этот белок связан с мембраной и входит в состав рафтов. ZAP-70 связывается с LAT, образуется заряд, который проходит через мембрану и распространяется по липидному слою мембраны. В том месте , где проходит заряд мембрана меняет свою стуктуру и становится жидкой. Возникает «липидное озеро». Это озеро вместе с зарядом распространяется и когда достигает LAT отдает ему заряд. LAT открывает свои тирозины, которые фосфорилируются Srk киназой.PI3 киназа фосфорелирует липиды на мембране. Дифосфаты превращаются в трифосфаты. Фосфолипаза-с-гамма садится туда, у нее есть SH2 домен, фосфорелируется. Там еще есть PI3 киназа, которая приссоеденяет 3-ий фосфат. Фосфолипаза-с-гамма расщепляет липиды на мембране на 2 части: диацилглицерин, который в мембране и инозитол-3-фосфат, который идет в цитоплазму, так как он гидрофильный. В цитоплазме, в одной из частей эндоплазматического ретикулума есть хранилище кальция – кальциевое депо. В мембранах есть кальциевые белки. Иназитол-3-фосфат связывается с кальциевыми белками, меняется конформация, каналы открываются и кальций выходит из хранилища в цитоплазму. Кальций распространяется вверх к мембране и вниз к ядру. Кальций, который пошел в цитоплазму связывается с кальмодулином, котрый его фосфорелирует. Кальмодулин меняет свою конформацию и может связываться с ферментом кальцийневрином. Комплекс кальмодулин+кальцийневрин становится активной фосфотазой и дефосфорелирует NFAT, котрый поступает в ядро. На LAT садится протеинкиназа-с. За сет SH2, она получает заряд, меняет конформацию. Диацилглицерол связывается с диацилглицериновым рецептором пртеинкеназы-с. Кальций, который добрался до мембраны связывается с кальциевым рецепторм протеинкиназы-с. У протеинкиназы-с, открывается тирозин, который фосфорелируется ZAP-70. Протеинкиназа-с становится активной. Протеинкиназа-с – ключевой фермент для запуска суперсемейства факторов трнаскрипции. Протеинкиназа-с фосфорелирует киназу ингибитора NF-каппа-b. Только после этого киназа ингибитора приобретает активность. Киназа ингибитора NF-каппа-В фосфорелирует ингибитор NF-каппа-В. Он диссоциирует от NF-каппа-В. NF-каппа-В поступает в ядро, а ингибитор разрушается в протеосоме. С другой стороны на LAT садится SHC белок, он связывает фосфотирозиновую группу, получает заряд, меняется конфоррмация. Его фосфорелирует syk-киназа. Рядом находится белок GRB2, в котором есть SH2 домен, который связывает эту фосфотиразиновую группу и связывает с первой. Меняется конформация, получает фосфотиразиновую группу. В составе GRB2 так же есть SH3 домен, котрый связывает пролиновый мотив в составе mSOS. Передается электрический заряд, меняется коформация mSOS и у него открывается контактная поверхность и присоединяется Ras-белок. Ras-белок присоединяет ГТФ и mSOS помогает отсоединять ГДФ. Ras белок с ГТФ получил название raf-киназа. Получает заряд, меняется конформация, открываются каталитические центры и запускается MAPK-каскад. Он состоит из 3-х ферментов – серин-треаниновых протеинкиназ, последовательно активирующих друг друга. Связывающий белок имеет 3 кармана. В этих 3-х карманах 3 белка. Самый последний фермент МАРК киназа, фермент, который его активирует – киназа МАРК киназы, а его активирует киназа киназы МАРК киназы. 2.Дендритные клетки – это отросчатые ветвистые клетки, основные представители АПК. Морфологически это крупные клетки (15-20 мкм) с эксцентрически расположенным ядром и многочисленными отростками мембраны, имеют довольно большое количество митохондрий. Локализуются в лимфотических органах и барьерных тканях. ДК костномозгового происхождения делят на миелоидные (1 тип) и лимфоидные (2тип). Популяции ДК. 1) ДК образуются из кроветворных клеток-предшественников в ответ на действие ФНО-альфа, ИЛ-4, ГМ-КСФ. В ответ на действие ФНО-альфа образуются кл. Лангерганса (экспрессирует АГ CD1a+), она имеет гранулы Бирбека, возможно участвующими в захвате АГ. После захвата АГ в коже и в ответ на выделение цитокинов ФНО-альфа кл.Ланг. созревают и переносятся в Т-клеточную область лимфоузла, где активируют АГ-специфичные Т-лимфоциты. 2) Зрелые моноциты экспрессируют АГ (CD11c+,13+,33+14+,1c+) способны к дифференцировке в интерстициальные ДК в различных органах. Моноциты перемещаются сквозь эндотелий, где взаимод с адгезионными молекулами и хемотаксинами. Образовавшиеся ДК и интерстициальные ДК перемещаются в зарод.центры лимфоузлов, где активируют Т и В-клетки. 3) Так же существуют предшественники ДК 1 типа (Миелоидные ДК), которые экспрессируют миелоидные АГ CD13+, 11c+, 11c, BDCA3+. Происходят из общего миелоидного гемопоэтического предшественника. Локализованы в различных органах и тканях, где захватывают чужеродные антигены путем пино- и фагоцитоза, после чего экспрессируют антигенную детерминанту в комплексе с молекулами MHC II класса. В условиях in vitro на сигнал ИЛ-4, ГМ-КСФ и ФНО-альфа они превращаются в типичные ДК. Секретируют большое кол-во ИЛ-12. Специфическими маркерами миелоидных дендритных клеток крови являются молекулы BDCA-1 (CD1c) и BDCA-3 (CD141). 4) Некоторые одноядерные клетки крови реагируют на образование ИЛ-3, Flt3L давая начало предшественникам ДК-2(лимфоидные предш). Эти клетки — лимфоидного происхождения и морфологически напоминают плазматические клетки. pDCs экспрессируют TLR-9, лигандами которого являются CpG-олигонуклеотиды бактериальной ДНК. Эти клетки мигрируют паракортикальную область лимфоузла, входя в контакт с эндотелиальными венулами. В ответ на ИЛ-3 и на связывание CD40 они преобретают морфологические признаки ДК и секретируют альфа-ИФ и ИЛ-10. К маркерам плазмацитоидных дендритных клеток относят молекулы BDCA-2 (CD303), BDCA-4 (CD304). Жизненный цикл миелоидных ДК. Миелоидные ДК высоко мобильны. В коже представлены клетками Лангерганса и дермальными ДК. Захватив и переработав АГ, кл.Лангерганса перемещаются из базальных и супрабазальных слоев эпидермиса кожи по афферентным лимфатическим сосудам в виде вуалевидных клеток в парокортикальные тимусзависимые зоны лимфоузлов, где они становятся интердигитирующими (переплетенными отростками) клетками. Интердигитирующие клетки с помощью МНС презентируют АГ наивным Т-лимфоцитам. Такую же миграцию перетерпивают и другие лимфоидные клетки.
ДК некостномозгового происхождения (фолликулярные ДК) находятся в первичных и во вторичных фолликулах лимфоузлов, селезенки и лимфоидной ткани слизистых оболочек. Они несут поверхностные иммунные комплексы АГ-АТ(без поглащения) и презентируют АГ В-лимфоцитам с помощью Fc-рецептора для IgG и рецепторов к комплементу CR1(CD25) и CR2 (CD21), связанных с мембраной FDC. FDC не имеют молекул MHC 2 класса и не мигрируют из мест своего расположения, соединяясь отростками, они образуют стабильную сеть. Рекрутирование предшественников ДК и миграция ДК. Эпителий миндалин и пищеварительного канала секретирует хемокин MIP-3альфа, являющийся лигандом хемокинового рецептора CCR6 на незрелых ДК. Синтез MIP-3альфа индуцируется при восполительном процессе, он способствует хемотаксису незрелых ДК и клеток Лангерганса. При созревании ДК перестают экспрессировать CCR6, они избегают локального действия MIP-3альфа и обзаводятся хемотаксиновым рецептором CCR7. В результате зрелые ДК начинают реагировать на хемокины MIP-3бетта и SLC, которые выделяются и связываются лимфатическими сосудами, эндотелиальными клетками и стромальными клетками лимфоузлов. Под действием данного хемокинового градиента Т-клетки так же перемещаются в лимфатические узлы. В Т-зоне лимфоузла ДК могут взаимодействовать с АГ-специфичными Т-клетками. Собственные ДК лимфоузла сами производят ЫSLC и MIP-3-бетта, что способствует дополнительному рекрутированию Т-клеток и ДК, приводящему к усилению иммунного ответа. Молекулы, учавствующие во взаимодействии Т-клеток с ДК.Взаимодействие CD40 с лигандом CD40 провоцирует созревание ДК и синтез ими большого количества ИЛ-12. Взаимодействие CD28 и CD 80/86 оказывает стимулирующий эффект. Узнавание АГ Т-клеточным рецептором обеспечивает 1-ый сигнал активации Т-клеток. Второй сигнал подаётся при взаимодействии АГ CD28 c CD80(или 86) на АПК. АГ CTLA4 является наиболее высоко аффинным рец-ом для CD80(86). Он конкурирует с CD28и ингибирует развитие клеточного цикла. Этот неготивный сигнал, подаваемый CTLA-4, возможно, служит сигналом для прекращения активации Т-клеток с целью предотвращения слишком сильного им.ответа. После активации Т-клеток с участием TCR-комплекса привлекается манозный костимулятор ICOS, который может опосредовать мощную костимуляцию Т-клеток и способствовать их пролиферации. Последние исследования показывают что стимуляция с помощью ICOS может индуцировать дифференцировку и Тн1 и Тн2.
Билет 6 1.Лиганд - молекула, специфически взаимодействующая с участком определенной структуры другой молекулы. Связывание лиганда с рецептором обычно происходит при помощи сил межмолекулярного взаимодействия, таких, как ионные связи, водородные связи, силы Ван дер Ваальса. Селективные и неселективные лиганды. Бивалентные лиганды состоят из двух соединённых молекул, каждая из которых является лигандом для определённого подтипа рецепторов (одного и того же или разных), причём в силу особенностей пространственного строения обе части молекулы способны одновременно связываться с двумя частями «составного» гомо- или гетеродимерного рецепторного комплекса. Бивалентные лиганды используются в научных исследованиях с целью обнаружения и исследования рецепторных гомо- и гетеродимерных комплексов и изучения их свойств. TLR - рецепторы экспрессированы на поверхности и в цитоплазматических гранулах различных клеток организма. Больше всего экспрессируют миелоидные клетки (моноциты и макрофаги). Цитоплазматическая (C-концевая) часть рецептора представлена TIR-доменом, ответственным за взаимодействие с адаптерными молекулами сигнальных путей. TIR-домен состоит из центрального β-слоя , окруженного 5 α-спиралями. Число вариантов TLR у человека оно составляет 10.TLR: гомо и гетеродимеры. Внеклеточная часть состоит из лейцин богатых доменов, из них форми-ся лигандраспознающий и лигандсвязывающий части- LRR-домен. На внутр части 3,7,8,9- распознают нуклеиновые паттерны. Все остальные на ЦП.TLR 1,2,6 распознают паттерны, в состав которого входят липиды.4 распознает патт, в состав которого входит полисахарид. Сигналинг При связывании PAMP с мембранным TLR возникают конформационные изменения внеклеточной части рецептора,передающиеся на внутриклеточный домен TIR. В передаче активацион-ного сигнала от TIR-домена ТLR участвует несколько адапторных белков(MyD88, TIRAP, TRIF, TRAM), активирующих 2 основных сигнальных пути — MyD88-зависимый и TRIF-зависимый. MyD88-зависимый путьучаствует в передаче сигнала от всех ТLR, кроме TLR-3, использущегоTRIF-зависимый путь. Передача сигнала от TLR-4 происходит с участиемобоих сигнальных путей. MyD88 (при участии TIRAP) играет роль «мости-ка» между активным димером TLR и первой сигнальной киназой — серин-треониновой киназой IRAK-4. Активированная IRAK-4 запускает каскадреакций активации сигнальных ферментов: киназы IRAK-1, убиквитин-лигазы TRAF6 и киназы ТАК1. На этом этапе передача сигнала может идти по двум путям. Один из них — активация тирозинфосфатазы IKK. Активация IKK происходит также при поступлении сигналов от эндолизосомального TLR-3 при посредстве адапторного белка TRIF и киназы RIP1. Основная мишень IKK — IκB (ингибирующая цепь неактивного комплекса, содержащего транскрипционный фактор NF-κB). Фосфорилирование IκB вызывает ее связывание с убиквитином, после чего она подвергается расщеплению в протеасоме. Освобожденный от IκB комплекс содержит активный димер NF-κB, миг-рирущий в ядро и связывающийся с промоторными участками многих провоспалительных генов (цитокинов, молекул адгезии, бактерицидных пептидов, ферментов и т.д.). Таким образом достигается главная цель активации — превращение клеток в эффекторы, обеспечивающие развитие воспалительной реакции и реализацию защитных функций врожденного иммунитета. 2.Дендритные клетки – это отросчатые ветвистые клетки, основные представители АПК. Морфологически это крупные клетки (15-20 мкм) с эксцентрически расположенным ядром и многочисленными отростками мембраны, имеют довольно большое количество митохондрий. Локализуются в лимфотических органах и барьерных тканях. ДК костномозгового происхождения делят на миелоидные (1 тип) и лимфоидные (2тип). Популяции ДК. 1) ДК образуются из кроветворных клеток-предшественников в ответ на действие ФНО-альфа, ИЛ-4, ГМ-КСФ. В ответ на действие ФНО-альфа образуются кл. Лангерганса (экспрессирует АГ CD1a+), она имеет гранулы Бирбека, возможно участвующими в захвате АГ. После захвата АГ в коже и в ответ на выделение цитокинов ФНО-альфа кл.Ланг. созревают и переносятся в Т-клеточную область лимфоузла, где активируют АГ-специфичные Т-лимфоциты. 2) Зрелые моноциты экспрессируют АГ (CD11c+,13+,33+14+,1c+) способны к дифференцировке в интерстициальные ДК в различных органах. Моноциты перемещаются сквозь эндотелий, где взаимод с адгезионными молекулами и хемотаксинами. Образовавшиеся ДК и интерстициальные ДК перемещаются в зарод.центры лимфоузлов, где активируют Т и В-клетки. 3) Так же существуют предшественники ДК 1 типа (Миелоидные ДК), которые экспрессируют миелоидные АГ CD13+, 11c+, 11c, BDCA3+. Происходят из общего миелоидного гемопоэтического предшественника. Локализованы в различных органах и тканях, где захватывают чужеродные антигены путем пино- и фагоцитоза, после чего экспрессируют антигенную детерминанту в комплексе с молекулами MHC II класса. В условиях in vitro на сигнал ИЛ-4, ГМ-КСФ и ФНО-альфа они превращаются в типичные ДК. Секретируют большое кол-во ИЛ-12. Специфическими маркерами миелоидных дендритных клеток крови являются молекулы BDCA-1 (CD1c) и BDCA-3 (CD141). |
||
|
Последнее изменение этой страницы: 2018-05-30; просмотров: 208. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 CD
CD  и CD
и CD  CD
CD  клетки (hi-высокий, lo-низкий уровень экспрессии маркера). CD
клетки (hi-высокий, lo-низкий уровень экспрессии маркера). CD