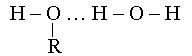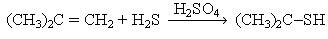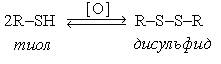Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
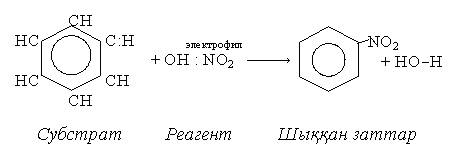
Гипоксантин, 6-гидроксипурин 2 страницаРеакциялауға алған затты субстрат, ал оған әрекет ету үшін қолданған затты реагент деп атайды. Реагенттер үш түрге бөлінеді: радикалдар, электрофилдер, нуклеофилдер. Радикалдар деп бос атомдары немесе жұпсыз электроны бар бөлшектерді айтады. Олар атомдардың арасындағы коваленттік байланыс гомолитикалық жолмен үзілгенде түзіледі. Молекуладағы коваленттік байланыс гетеролитикалық жолмен үзілгенде электрофильдік (электрофильдер) немесе нуклеофильдік (нуклеофильдер) реагенттер пайда болады. Электрофильдерге (электрон сүйетіндер) карбкатиондар және электрон қабаттары толмаған қосылыстар, мысалы, Н+, NO2-, O3+, AlCl3, Br2 және т.с. жатады. Химиялық реакцияларда олар өзіне электрон қосып алады. Электрофильдер қос байланысы бар заттармен рекцияға оңай түседі. Нуклеофильдерге (ядроны жақсы көретіндерге) карбкатиондар, бөлінбеген электрондары немесе π- электрондары (қос байланысы) бар жүйелер, мысалы, Н+ (гидрид-ион), ОН-, CN:, =O:, ≡N:, =S жатады. Химиялық реакцияларда нуклеофильдер өз электрондарын береді немесе өзінің электрондарымен басқа атомдар ядросымен бөліседі. Олар электрондар рөлін атқарады. Субстраттағы байланыстардың үзілу түріне және реагенттің табиғатына қарай барлық химиялық реакциялар радикалдық, иондық және келісілгшен (синхронды) реакцияларға бөлінеді. Радикалдық немесе гомолитикалық реакциялар (символы R). Бұл реакцияларда субстрат молекуласындағы коваленттік байланыс гомолитикалық әдіспен үзіледі және реакцияға радикал қатысады.  Cl● + H : CH3 → HCl + CH3● Иондық немесе гетеролитикалық реакциялар. Бұл реакцияларда субстрат молекуласындағы коваленттік байланыс гетеролитикалық әдіспен үзіледі. Реагенттің табиғатына байланысты иондық реакция не электрофильдік (символы Е), не нуклеофильдік (символы N) болады. Мысалы: Электрофильдік реакция
Нуклеофильдік реакция
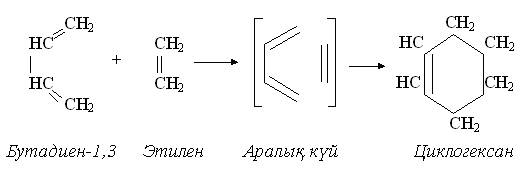
Синхронды немесе келісілген реакциялар. Жоғарыда келтірілген реакциялардан айырмашылығы бұл реакцияларда радикалдар немесе иондар қатыспайды, тек еселі байланыстар үзілу арқылы жаңа қосылыстар пайда болады. Мысал ретінде диендерден циклды қосылыстар алу реакциясын келтіруге болады.
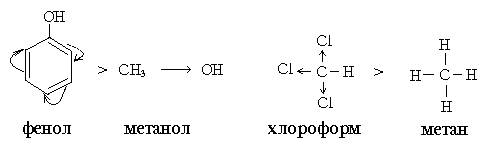
Келісілген реакцияларды қыздыру немесе сәуле түсіру арқылы жүргізуге болады. Органикалық қосылыстардың реакцияласу қабілетінің ең маңызды аспектілерне олардың қышқылдық және негіздік қасиеттері жатады. Осы қасиеттер көптеген органикалық бимолекулалардың тән жағдайында иондық күйде болуын қамтамасыз етеді. Протонның тасымалдануы саналуан биохимиялық реакциялар барысында байқалады. Көптеген биохимиялық процестерде қышқылдық немесе негіздік катализ үлкен рөл атқарады. Органикалық қосылыстардың қышқылдығы мен негізділігін бағалауда Бренстед пен Льюис теориялары аса зор маңызға ие. Бренстед қышқылдары протонды беруге қабілеті (протон донорлары) бейтарап молекулалар немесе иондар. Бренстед негіздері протон қосып алуға қабілетті (протон акцепторлары) бейтарап молекулалар немесе иондар. Қышқылдық пен негіздік қосылыстардың абсолюттік емес, салыстырмалы қасиеттері: қышқылдық қасиеттер тек негіз қатысында ғана, негіздік қасиеттер тек қышқылдың қатысуында ғана ашылады. Органикалық қосылыстардың қышқылды-негіздік қасиеттері қышқыл немесе негіз ретінде қабылданатын суға қатысты анықталады. Бренстед қышқылдары протонмен байланысқан элемент табиғатына байланысты төмендегідей жіктеледі: О-Н – қышқылдар: карбон қышқылдары, фенолдар, спирттер. S-H – қышқылдар: тиолдар N-H – қышқылдар: амидтер, аминдер, имидтер С-Н – қышқылдар: көмірсутектер және олардың туындылары карбон қышқылдарынан басқа органикалық қышқылдар әлсіз қышқылдық қасиет көрсетеді және индикаторға әсер етпейді. Қосылыстың қышқылдылығы қышқылдық орталықтағы элементтің электротерістігі мен полярлануына және радикалдың құрылымына тәуелді. Атомның полярлануы дегеніміз – сыртқы электрон бұлтының электр өрісінің әсерінен ығысуы. Атомда неғұрлым электрон көп болса, және неғұрлым олар ядродан алыс орналасса, соғұрлым ол атомның полярлануы жоғары болады. Радикалдары бірдей Бренстед қышқылдары қышқылдық қасиеттерінің жоғарлауына байланысты төмендегі ретпен орналасады: СН- қышқылдар <NH- қышқылдар <ОН- қышқылдар <SH- қышқылдар. Электроноакцепторлы орынбасушылар қышқылдық қасиетін ұлғайтады, электронодонорлы орынбасушылар төмендетеді. Мысалы: фенолдың қышқылдық қасиеті спиртке қарағанда күшті. Хлороформның СН- қышқылдығы метанмен салыстырғанда жоғары.
Протонмен коваленттік түзу үшін Бренстед негіздерінде π-электрондар немесе, O, N, S гетероатомдарының бос электрон жұбы болуы тиіс. Бренстед негіздері екі топқа бөлінеді: π-негіздері және n-негіздері (оний). π-негіздерінде негіздік орталық π-электрондар болып табылады. Олар өте әлсіз негіздер.
Оний негіздері жұп электроны арқылы протонды қосып алатын гетероатомның табиғатына яғни негіздік орталыққа байланысты жіктеледі. а) аммонийнегіздері (негіздік орталық - N <) – біріншілік R-NH2, екіншілік R2NH, үшіншілік R3N аминдер, гетероциклді азотты қосылыстар және т.б. б) оксоний негіздері (негіздік орталығы –О–, =O) –спирттер – OH, жай эфирлер R-O-R, альдегидтер R-C, кетондар R-C-R, карбон қышқылдарының туындылары R-C (X: –OR, –NH2, галогендер). в) сульфоний негіздері(негіздік орталығы –S–) – тиоспирттер R–SH, тиоэфирлер (сульфидтер) R –S –R. Негіздік орталықтағы атомның электротерісітігі жоғарылаған сайын негіздік қасиет кемиді (оксоний негіздері аммоний негіздерінен әлсіз), полярлануы артқан сайында негіздік қасиет азаяды, (сульфоний негіздері оксоний негіздерінен әлсіз). Электронодонорлы орынбасушы-лар негіздік қасиетті арттырады, электроноакцепторлар негіздік қасиетті кемітеді.
Кейбір органикалық қосылыстар негіздік әрі қышқылдық қасиет көрсетеді, яғни амфотерлі болады. Сондықтан олар сутектік байланыстар арқылы молекулааралық ассоциаттар түзеді.
Амфотерлі қосылыстар a-аминоқышқылдары тәрізді ішкі тұз түзеді.
Спирттер
Бір немесе бірнеше гидроксил тобы бар алифатты қосылыстарды спирттер деп атайды. Бір атомды спирттерге құрамында көмірсутегі радикалымен байланысқан гидроксотобы бар органикалық заттар жатады. Бұл спирттердің жалпы формуласы R–OH. Молекуладағы гидроксо тобының орналасуына және қандай көміртек атомымен байланысқанына қарай спирттер біріншілік (І), екіншілік (ІІ) және үшіншілік (ІІІ) спирттерге бөлінеді:
Спирттер молекулааралық және молекула ішіндегі сутектік байланыс түзеді:
Сутектік байланыстың түзілуі молекуланың физикалық және химиялық қасиеттеріне әсер етеді. Мысалы, сутектік байланыс түзуге байланысты этанолдың қайнау температурасы (78,30С) диметилэфирінің CH3ОСН3 (-240С) қайнау температурасына қарағанда жоғары. Судағы ерітіндіде спирттер сутектік байланыс арқылы гидратацияға ұшырайды:
Спирттердің молекулаларының арасында сутекті байланыс болғандықтан олардың қайнау температуралары төмен болады. Спирттердің гидроксотобындағы сутек пен судың оттек атомымен немесе гидроксотоптағы оттек пен судың сутек атомдарының арасында сутекті байланыс түзетін қасиеттеріне қарай олардың суда ерігіштігі артады. Төменгі молекулалық спирттер (метанол, этанол, пропанол-1) суда кез-келген мөлшерде еритін сұйықтар. Молекулалық массалары өскен сайын олардың ерігіштігі төмендейді. Жоғарғы молекулалық спирттер (С12-ден жоғарылары) суда ерімейтін қатты заттар. Бір атомды спирттер – бейтарап заттар. Сондықтан олардың судағы ерітінділері нейтралдық ортаны көрсетеді, индикатордың түсін өзгертпейді, сілтілердің ерітіндісімен де, сұйытылған қышқылмен де реакцияға түспейді.
Қаныққан бір атомды спирттер Метил спирті (метанол) СН3ОН Этил спирті (этанол) СН3СН2ОН Н-пропил спирті (пропанол-1) СН3СН2СН2ОН Изопропил спирті (пропанол-2) СН3СНОНСН3 Н-бутил спирті (бутанол-1) СН3(СН2)2СН2ОН Изобутил (2-метилпропанол-1) (СН3)2СНСН2ОН Екіншілік-Бутил (бутанол-2) СН3СН(ОН)СН2СН3 Үшіншілік-Бутил (2-метилпропанол-2) (СН3)3СОН Циклогексанол Бензил спирті С6Н5СН2ОН Қанықпаған бір атомды спирттер Аллил спирті СН2 = СН−СН2ОН Корич спирті С6Н5СН = СН−СН2ОН
Спирттерді алу жолдары. Қаныққан бір атомды спирттерді оларға сәйкес қанықпаған көмірсутектерін гидратациялау немесе қаныққан көмірсутектерінің галоген туындыларын сілтілермен немесе сумен әрекеттестіру арқылы алады:
СН2=СН2 + НОН → СН3−СН2ОН Этен Этанол
СН3−СН2Сl + NaOH → СН3−СН2ОН + NaCl Хлорэтан
СН3−СН2Br + HOH → СН3−СН2ОН + HBr Бромэтан
Қанықпаған көмірсутектерін гидратациялау арқылы алғанда Марковниковтың ережесі сақталады. Қос байланыс (π-байланыс) үзілгенде сутегі көп көміртек атомына сутек атомы, ал сутегі аз көміртек атомына гидроксотоп барып қосылады.
Спирттерді карбонилді қосылыстарды тотықсыздандыру арқылы да алуға болады. Альдегидтерді тотықсыздандырғанда біріншілік спирттер, ал кетондарды тотықсыздандырғанда екіншілік спирттер түзіледі. Спирттердің химиялық қасиеттері. Спирттер ауада қыздырғанда жанады, сілтілік металдармен, галогендермен, қышқылдармен және бір-бірімен әрекеттеседі, дегидратацияланады.
С2Н5ОН +О2 → 2СО2 + 3Н2О СН3ОН +НСl → СH3Cl + Н2О
Сумен салыстырғанда спирттердің сілтілік металдармен әрекеттесуі баяу жүреді. Сілтілік металдармен қатар спирттер басқа да активтігі жоғары металдармен (Са, Mg, Al) алкоголяттар түзеді. Алкоголяттар әлсіз қышқылдан (спирттен) және күшті негізден құралған тұздардың қасиетін көрсетеді. Сулы ортада олар гидролизденеді:
С2Н5ОNa +H2O → С2Н5ОН + NaOH Натрий этилаты
Спирт пен қышқыл әрекеттескенде күрделі эфир түзіледі. Осы реакцияны этерификация реакциясы дейді. Бұл қайтымды процесс, тепе-теңдікті эфир түзілу жағына ауыстыру үшін катализатор ретінде минералдық қышқыл, мысалы Н2SO4 қосады, ал кері ауыстыру үшін сілті қосады. Спирттер бір-бірімен әрекеттескенде жай эфир түзеді:
С2Н5ОН + СН3ОН → С2Н5ОСН3 + Н2О Метилэтил эфирі Спирттер дегидратацияланғанда қанықпаған көмірсутектерін түзеді: Спирттер тотығу реакциясына өте оңай түседі. Олардың табиғатына және реакциясының жүру жағдайына байланысты әр түрлі заттар түзіледі. Мысалы, біріншілік спирттер алдымен альдегидтер, сосын қышқылдар береді:
Екіншілік спирттерден кетондар түзіледі: Үшіншілік спирттерді тотықтыру реакциясына түсіру қиындау, оларды тотықтыру үшін күшті тотықтырғыштар қолданылады және олар тотыққанда көміртек-көміртекті байланыс үзіледі де кетондар мен қышқылдардың қоспасы шығады. Көпатомды спирттер Молекулаларындағы гидроксил тобының санына байланысты көпатомды спирттер екіатомдық, үшатомдық және т.с.с. болып бөлінеді. Екіатомдық спирттерді диолдар немесе гликолдар; үшатомдық спирттерді триолдар немесе глицериндер; ал егер гидроксил тобының саны үштен жоғары болса полиолдар деп атайды. Көпатомды спирттер суда жақсы еритін, ал органикалық еріткіштерде нашар еритін заттарға жатады, олардың қайнау температуралары өте жоғары. Бір гидроксил тобының екінші гидроксил тобына тигізетін І-эффектіне байланысты біратомдық спирттерге қарағанда қышқылдық қасиеттері жоғары болады. Көпатомды спирттерді алу жолодары және химиялық қасиеттері біратомдық спирттерге ұқсас келеді. Фенолдар Молекулаларында бензол ядросымен тікелей байланысқан гидроксил топтары бар ароматтық көмірсутектерінің туындыларын фенолар деп атайды. Гидроксил тобының санына байланысты фенолар бір-, екі- немесе көпатомдық болып бөлінеді: Осы қосылыстардың ішіндегі ең маңыздысы фенол болып есептеледі. Радикал С6Н5-фенил деп аталады. Фенол (С6Н5ОН) – ерекше иісі бар түссіз кристалды зат. Көбіне ауада оңай тотығатындығына байланысты фенолдың түрі шамалы қызғылттау болып келеді. Фенол 430С-де балқиды, бөлмелік температурада суда нашар ериді. Улы зат, ол теріге тигенде күйдірумен қатар, тері арқылы өтіп, организмді уландырады. Фенолды алу жолдары. 2С6Н5ОNa + H2SO4 → 2С6Н5ОН + Na2SO4 натрий феноляты фенол Химиялық қасиеттері. Фенолдың химиялық қасиеттері біратомдық қаныққан спирттердің қасиеттеріне өте ұқсас келеді. Бірақ гидроксил тобы және бензол ядросы бір-біріне қатты әсер етуіне байланысты фенолдың ерекшелік қасеиттері бар. Фенол өте әлсіз қышқыл болғанымен оның су және спирттермен салыстырғанда қышқылдық қасиеті жоғары: С6Н5ОН > H2O > С2Н5ОН Фенолдар спирттер әрекеттеспейтін сілтілермен реакцияға түседі: Фенолдың қышқылдық қасиеті өте төмен болғандықтан ол лакмустың түрін өзгертпейді, оны феноляттардан әлсіз көмір қышқылы да ығыстырып шығара алады.
С6Н5ОNa + СО2 + H2O → С6Н5ОН + NaHCO3
Біратомдық спирттер сияқты фенол сілтілік металдармен әрекеттесіп феноляттар, ал феноляттар алкилгалогенидтермен және ароматты галогентуындыларымен жай эфирлер түзеді. Мысалы. Фенолдар спирттер сияқты қышқылдармен тікелей әрекеттесіп, күрделі эфирлер түзбейді. Күрделі эфирлер фенолдарды хлорангидридімен немесе қышқыл ангидридімен әрекеттестіру арқылы алынады: Фенол бром суымен оңай әрекеттесіп, трибромфенолдың ақ тұнбасын түзеді (фенолдарға сапалық реакция): Фенолдардың ішінде биологиялық маңызы бар болып екі атомдық фенолдар саналады. Бұларға пирокатехин, резорцин, гидрохинон жатады, олар көптеген табиғи қосылыстардың құрамында кездеседі. Пирокатехин (о-дегидроксибензол, катехол) көптеген биологиялық активті заттардың, соның ішінде катехол аминдердің құрылымдық элементі болып саналады. Оның монометил эфирін – гваяколды дәрі зат ретінде жоғарғы тыныс жолдары науқастанғанда қолданады. Резорцин (м-дигидроксибензол) тері ауруларын емдегенде майларға және сұйық дәрілердің құрамына қосылады. Крезолдар (2-метилфенол, 3-метилфенол, 4-метилфенол) дезинфекциялық дәрілерге жатады. Спирттерден алынған жай эфирлердің ішінде диэтилэфирі медицинада кеңінен қолданылады. Ол ингаляциялық наркоз жасауға, денені сылауға және әр түрлі тұндырмалар мен сығындылар дайындауға, сонымен қатар жануарлардан немесе өсімдіктерден алынатын заттарды ерітуге пайдаланылады. Ашық ауада сақтағанда ол оталғыш қасиеттері бар гидропероксидке айналады.
Тиолдар және олардың туындылары Тиолдар (тиоспирттер, меркаптандар) деп спирттерге және фенолдарға ұқсас құрамында оттектің орнына күкірт атомы бар қосылыстарды айтады. Олардың жалпы формуласы R–SH. Жай эфирлер мен органикалық пероксидтерге ұқсас қосылыстарды сульфидтер және дисульфидтер деп атайды. Тиолдар, сульфидтер және дисульфидтер Метантиол (метилмеркаптан) CH3SH Этантиол (этилмеркаптан) C2H5SH Тиофенол C6H5SH Диметилсульфид CH3SCH3 Диметилдисульфид CH3S-SCH3
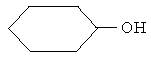
Тиолдар келесі әдістермен алынады: 1. Алкилгалогенидтерді натрий гидросульфидімен әрекеттестіру арқылы: С2Н5Br + NaSH → C2H5SH + NaBr 2. Қыздырылған катализатор (торий оксиді, 4500С) арқылы спирт пен күкіртсутектің буын өткізгенде: С3Н7ОН + Н2S → C3H7SH + H2O 3. Қышқылды ортада алкендерді күкіртсутекпен реакциялау арқылы: Тиолдардың химиялық қасиеттері күкіртсутектің қасиеттеріне жақын. Спирттерге қарағанда тиолдардың қышқылдық қасиеттері жоғары, себебі күкірт атомының радиусы оттек атомының радиусынан едәуір үлкен, сондықтан күкірт атомындағы теріс зарядтар тиімді таралған, демек алкилсульфид-иондарының тұрақтылығы алкокси-иондарынан анағұрлым жоғары келеді. Тиолдар сілтілердің сулы ерітінділерінде еріп тиоляттар (меркаптидтер) R–Sna береді: СН3СН2SH + NaОН → СН3СН2S-Na+ + H2O Этантиол Натрийдің этантиоляты (этилсульфиді) Спирттерде көміртегі атомы тотықса, тиолдарда күкірт атомы тотығады. Әлсіз тотықтырғыштың әсерінен дисульфид түзіледі: –S–S– байланыс дисульфидтік байланыс деп аталады. Бұл реакция және оған қайтымды процесс тотықсызданудың биологиялық жүйелерде маңызы зор. Мысалы олар клеткадағы тотығу-тотықсыздану процесінің негізінде болады. Дисульфидтік байланыс белоктардың үшіншілік құрылымын тұрақтандыруға маңызы зор. Тиолдар күшті тотықтырғыштармен сульфон қышқылдарына дейін тотығады. Дисульфид тобы бар қосылыстардың медициналық маңызы зор. Мысалы, құрамында дисульфид тобы бар тетурам (анабус) деген препарат маскүнемдікті емдеуге кеңінен қолданылып жүр. Себебі бұл дәрі ацетальдегидоксидаза ферментінің организмдегі тотығу процестеріне қатысуына кедергі келтіреді, сондықтан этанолдың тек қана ацетальдегидке дейін тотығуына мүмкіндік туады, осыған байланысты көп мөлшерде пайда болған ацетальдегид адамға жағымсыз сезім тудырады.
Аминдер Аминдер – аммиак молекуласындағы сутек атомдары көмірсутек радикалдарына алмасудан түзілген органикалық заттар деп қарастыруға болатын қосылыстар. Аммиак молекуласындағы көмірсутек радикалдарына алмасқан сутегі атомдарының санына қарай аминдерді біріншілік, екіншілік, үшіншілік деп бөледі. Мысалы, бутиламин С4Н9 – NН2 біріншілік амин, диметиламин (СН3)2 – NН екіншілік амин, триметиламин (СН3)3N мен диметилэтиламин (СН3)3N – С2Н5 үшіншілік аминдер. Аминдердің қасиеттері аммиакқа ұқсас, төменгі молекулалы аминдер (метиамин, диметиламин, триметиламин және этиламин) газдар, иістері аммиак сияқты жағымсыз, өткір. Көміртек атомының саны көбейгенде аминдер сұйық заттарға, С12Н25NН2-ден жоғарылары қатты заттарға жатады. Аминдердің судағы ерітінділепі аммиакқа ұқсас негіздік қасиет көрсетеді. Аминдерді сондықтан органикалық негіздер деп атайды. |
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 1481. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |