
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
МЕРЫ ПРЕДОСТОРОЖЕННОСТИ ПРИ ПРОВЕДЕНИИ РАБОТ С ХИМИЧЕСКИМИ РЕАКТИВАМИСтр 1 из 3Следующая ⇒ МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ _______________ Федеральное государственное образовательное учреждение высшего профессионального образования ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДЫ МЕТОДИЧЕСКИЕ УКАЗАНИЯ к лабораторной работе № 17 по курсу “Экология” ПЕНЗА 2015 УДК 574(075) О - 62 Представлены необходимая терминология, описание титрометрического метода определения временной и общей жесткости воды, способы устранения жесткости, порядок выполнения лабораторной работы и последовательность обработки полученных результатов. В заключении даны контрольные вопросы для самостоятельной проверки усвоения теоретического материала. Методические указания составлены на кафедре "Техносферная безопасность" и предназначены для студентов всех специальностей. Ил.3, табл.3, библиогр. 3 назв. С о с т а в и т е л и : Г.И.Фомичева, И.П. Ястребова Р е ц е н з е н т В.К. Марьин, заведующий кафедрой экологии Пензенского технологического института, академик, д-р техн.наук, профессор. Цель работы - овладение методом количественного анализа воды по показателям общей и временной жесткости. I. ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ ЖЕСТКОСТЬ ВОДЫ - это показатель природной воды, обусловленный наличием в ней растворенных солей кальция и магния. Измеряется жесткость в миллиграмм - эквивалентах в литре раствора (мгэкв/л). Миллиграмм – эквивалент учитывает весовую концентрацию каждого иона в мг/л, его молекулярный вес и электрический заряд. Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность).  Кальциевую и магниевую жесткости можно перевести в весовое содержание этих элементов в воде и наоборот в следующих соотношениях: МСа = 20,04 ЖСа (мг/л); ЖСа = МСа/20,04 (мг-экв/л) МMg = 12,16 ЖMg (мг/л); Ж Mg = М Mg/ 12,16 (мг-экв/л) где М - весовое содержание кальция или магния в миллиграмах на 1 литр. НОРМАЛЬНЫЙ РАСТВОР содержит в 1 кубическом дециметре (литре) один г-экв растворенного вещества. Для наглядности сравнения нормальной и процентной концентраций рассмотрим подсчет процентности децинормального раствора соляной кислоты, (0,1N НCl), который используется при титровании в данной работе. ТИТР - в объемном химическом анализе - концентрация раствора реактива, число граммов вещества в 1 мл раствора. ТИТРОВАНИЕ - это метод объемного химического анализа, состоящий в постепенном струйно-капельном приливании реактива известной концентрации к известному объему другого реактива, концентрацию которого нужно установить в ходе опыта. ИНДИКАТОР МЕТИЛОВЫЙ ОРАНЖЕВЫЙ, цветовой определитель рН среды. Цвет индикатора в растворах: • кислая среда - розовый • нейтральная среда – оранжевый • щелочная среда –желтый
Оценку изменения объема кислоты в бюретке проводят по уровню жидкости на шкале с точностью до десятых долей миллилитра. Рисунок 2 иллюстрирует как правильно фиксировать уровень кислоты в бюретке.
а) б) в) Рис.2 Способ отсчета по мениску жидкости а – правильный отсчет; б – завышенный отсчет; в – заниженный отсчет. МЕРЫ ПРЕДОСТОРОЖЕННОСТИ ПРИ ПРОВЕДЕНИИ РАБОТ С ХИМИЧЕСКИМИ РЕАКТИВАМИ 1. Работайте всегда на одном и том же месте. 2. Не загромождайте рабочий стол свертками, папками, книгами. 3. Запрещается приносить в лабораторию съестное, напитки, использовать жевательную резинку во время работы. 4. Соблюдать в лаборатории тишину и чистоту. 5. Перед каждой лабораторной работой внимательно изучить теоретический материал по указанной теме. 6. Приступить к опыту только после того, как уяснена его цель ипорядок выполнения. 7. Особая осторожность требуется при работе со стеклянной посудой и приборами. 8. Децинормальные растворы солей, кислот и щелочей имеют низкую процентную концентрацию, но при работе с ними не следует забывать общие правила предосторожности при работе с химическими веществами. II. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Суммарное содержание солей кальция и магния называют общей жесткостью. Общая жесткость подразделяется накарбонатную (временную или устранимую)и некарбонатную (постоянную). Временная жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния Са(НСО3)2 и Мg(НСО3)2. Соли карбонатной (временной) жесткости устраняют при нагревании воды до 120-150 ºС, при этом образуются осадки карбонатов кальция и магния Са(НСО3)2 to СаСО3↓ + СО2↑+ Н2О Мg(НСО3)2 to МgСО3↓ + СО2↑+ Н2О Эта реакция обратима (равновесна), так как при контакте СО2 с раствором можно снова получить кислую соль. Только при кипячении СО2 улетучивается и равновесие смещается в сторону нерастворимой соли. Остающаяся после кипячения жесткость называется постоянной. Постоянная жесткость - это жесткость кипяченой воды, вызывается присутствием в воде хлоридов и сульфатов кальция и магния двухвалентных CaSO4, MgSO4, CaCl2, MgCl2. По величине жесткости различают воду: • очень мягкую (0–1,5 мг-экв/л); • мягкую (1,5–3 мг-экв/л); • средней жесткости (3–6 мг-экв/л); жесткую (6–9 мг-экв/л); • очень жесткую (более 9 мг-экв/л). Общая жесткость колеблется от единиц до десятков, иногда сотен мг-экв/дм3, причем карбонатная жесткость составляет до 70–80% от общей жесткости. Обычно преобладает жесткость, обусловленная ионами кальция (до 70%); однако в отдельных случаях магниевая жесткость может достигать 50–60%. В естественных условиях ионы кальция и магния, обуславливающих жесткость, в основном, поступают в воду в результате растворения карбонатных (известняки, доломиты, мергели), сульфатных (гипс) горных пород или продуктов их химического преобразования. Другим источником этих ионов являются также микробиологические процессы, протекающие в почвах на площади водосбора (в донных отложениях). После смерти организмов кальций быстро переходит в минеральную форму и поступает в почву. Поэтому почвенные растворы, как правило, являются кальциевыми. На урбанизированных территориях источником поступления ионов кальция и магния являются сточные воды различных предприятий. Мягкими являются воды Севера, дождевые, талые, фильтрующиеся через кристаллические породы. Повышенной жесткостью обладают воды, фильтрующиеся через известняки, доломиты, гипс. Жесткость морской воды и океанов значительно выше (десятки и сотни мгэкв/дм3). Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья. Наилучшие вкусовые свойства имеет вода с жесткостью 1,6–3,0 мгэкв/л, а, согласно СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения», физиологически полноценная вода должна содержать солей жесткости до 7 мг-экв/лПо постановлению главного государственного санитарного врача по соответствующей территории для конкретной системы водоснабжения на основании оценки санитарноэпидемиологической обстановки в населенном пункте и применяемой технологии водоподготовки, норма общей жесткости воды может быть установлена на уровне 10 мг-экв/л. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая действие на органы пищеварения, провоцирует отложения солей в суставах (полиартриты, остеохондрозы), нарушает обменные процессы в организме. Ионы кальция и магния омыляют жиры, нарушая процессы всасывания питательных веществ в кишечнике, вызывая дерматиты. Повышенное содержание кальция в питьевой воде на фоне йодной недостаточности вызывает заболевания щитовидной железы. Повышенное содержание магния снижает моторику кишечника, препятствуя пищеварительному процессу. Пониженное содержание солей жесткости (ВОЗ ограничивает нижний допустимый предел 1,5 мг-экв/л) также опасно и вызывает у населения кариес и ослабление костей скелета, так как организм в этом случае восполняет недостаток кальция за счет внутренних ресурсов. Допустимая жесткость промышленных вод различна для разных производств. При жесткости воды выше 4,5 мг-экв/л происходит интенсивное накопление осадка в системе водоснабжения и на сантехнике, нарушается работа бытовых приборов. Обычно умягчение проводят до остаточной жесткости 1,0–1,5 мг-экв/л, что соответствует зарубежным нормативам по эксплуатации бытовой техники. Вода, имеющая жесткость ниже 0,5 мг-экв/л является коррозионно-активной по отношению к трубам и котлам, способна вымывать отложения в трубах, накапливающиеся при долгом застаивании воды в системе водоснабжения. Это влечет за собой появление неприятных запаха и вкуса воды. Для пищевой промышленности опасны как повышенные, так и пониженные значения жесткости, поэтому предпочитается интервал от 5 до 7 единиц. |
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 243. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

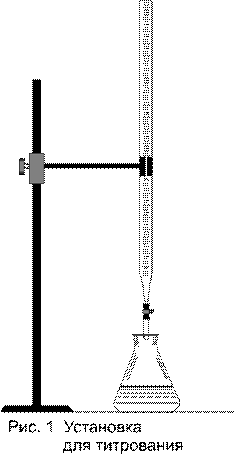 Титрование происходит в присутствии индикатора рН среды, по изменению цвета которого и прекращают титрование. Установка для титрования приведена на рисунке 1. Она состоит из металлического штатива, на котором закреплена стеклянная бюретка с кислотой и колбы с анализируемой жидкостью.
Титрование происходит в присутствии индикатора рН среды, по изменению цвета которого и прекращают титрование. Установка для титрования приведена на рисунке 1. Она состоит из металлического штатива, на котором закреплена стеклянная бюретка с кислотой и колбы с анализируемой жидкостью.