
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Основные понятия термодинамикиСтр 1 из 5Следующая ⇒ Тема 1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ТЕРМОДИНАМИКИ
Термодинамические системы В термодинамике реальному объекту исследования сопоставляется эквивалентная ему модель, которая называется термодинамической системой (ТС). Если объектом является некоторое вещество, то количество образующих его частиц (молекул, атомов, ионов, электронов, фотонов) должно быть достаточно большим, чтобы к их совокупности можно было применять законы статистики. На макроскопическом уровне ТС может представлять собой совокупность материальных тел и полей, находящихся в механическом и тепловом равновесии и обменивающихся между собой веществом и энергией. Молекулярная структура тел при этом не рассматривается. В технических приложениях в качестве ТС рассматриваются энергетические установки, в которых осуществляются процессы преобразования внутренней энергии или теплоты в полезную работу, а также обратные процессы (примерами могут служить тепловые двигатели и холодильные установки). Перечисленные уровни описания ТС составляют предмет исследования классической термодинамики, основные законы которой были установлены в XIX веке. В стадии становления находится неравновесная термодинамика, имеющая целью исследование ТС вдали от состояния термодинамического равновесия. Такие системы обнаруживают новые свойства, наиболее существенными из которых является способность к самоорганизации и обмену информацией. Каждая конкретная ТС всегда является частью, подсистемой более полной системы. По отношению к выделенной подсистеме остальная часть более полной системы является окружающей средой (ОС). Часто окружающей среде приписывают свойство термостата, который поддерживает постоянными некоторые из внешних по отношению к рассматриваемой подсистеме условий (температуру, давление, химический потенциал, напряженность внешних полей и т.п.).  Различные ТС обычно отделяются друг от друга оболочками или поверхностям раздела (ПР), которые в общем случае являются самостоятельными ТС с особыми свойствами: способностью пропускать или не пропускать через себя вещество, импульс, энергию, информацию, быть жесткой или деформируемой, обладать собственной поверхностной энергией. Во многих случаях ПР является воображаемой поверхностью, выделяющей некоторый объем вещества или пространства. Некоторые ТС вообще могут не иметь определенной ПР (например, подсистема электронного газа в неравновесной плазме, имеющая собственную электронную температуру, которая отличается от температуры ионов и атомов). Взаимодействие ТС между собой и с ОС осуществляется путем обмена энергией (в форме теплоты и работы) и веществом (энергоносителем). По характеру участия во взаимодействиях выделяют три типа ТС: изолированная - независимая, замкнутая ТС, совершенно не взаимодействующая с ОС и с другими ТС (т.е. не обменивающаяся энергией и веществом); закрытая ТС - не обменивающаяся с ОС и другими ТС веществом (заключенная в непроницаемую для вещества оболочку или ПР); открытая ТС - способная обмениваться с ОС и другими ТС веществом и энергией. Свойства ТС в термодинамике описываются термодинамическими переменными, которые являются количественной мерой соответствующих свойств. Наибольшее распространение среди ТД переменных получили давление (p), температура (T), объем (V), энтропия (S), внутренняя энергия (U), хотя нередко используются и другие переменные. ТД переменные, фиксированные в условиях рассматриваемой задачи, называются ТД параметрами. ТД переменные разделяют на интенсивные и экстенсивные. Интенсивные (p,Т...) отражают локальные свойства ТС, экстенсивные (V, S, U...) описывают свойства ТС в целом; они могут быть преобразованы к интенсивным переменным, если привести их к единице массы, единице объема, одному молю или к значениям, приходящимся на одну частицу. Различают гомогенные и гетерогенные ТС. Гомогенные имеют в пределах своего объема одинаковые значения всех интенсивных ТД переменных. Гетерогенные ТС состоят из отдельных частей, разграниченных ПР, причем на ПР хотя бы одна интенсивная ТД переменная изменяется скачкообразно. Гомогенная часть гетерогенной ТС, ограниченная ПР, называется фазой. ТС могут быть однокомпонентными (состоящими из одного вещества) и многокомпонентными (состоящими из двух или более индивидуальных веществ). Другие необходимые определения, относящиеся к ТС, будут рассмотрены по ходу последующего изложения материала.
Основные понятия термодинамики Совокупность интенсивных ТД переменных ТС (p, Т, v, s, u...), являющихся в общем случае функциями пространственных координат и времени, определяет ТД состояние ТС. Неравновесные ТД состояния характеризуются наличием потоков вещества и энергии в пределах ТС. Особое значение в термодинамике имеют состояния ТД равновесия, в которых ТД переменные остаются неизменными во времени, а потоки вещества и энергии в ТС отсутствуют. Классическая термодинамика основывается на принятии следующих двух постулатов.
Первый постулат: изолированная ТС, независимо от своего исходного состояния, с течением времени приходит в состояние ТД равновесия. Это исходное положение термодинамики, основанное на обобщении опыта, справедливо только для изолированной ТС.
Примечание. Состояние ТД равновесия ТС не исключает существования в малых её подсистемах флуктуации ТД переменных, которые тем более значительны, чем меньшее число частиц содержится в подсистеме. Это означает, что ТД переменные в малой подсистеме не имеют определенного значения в каждый момент времени, а состояние ТД равновесия имеет вероятностную, статистическую природу. Второй постулат: если системы А и В ‑ находятся в термодинамическом равновесии с системой С, то системы А и В находятся в термодинамическом равновесии между собой. Отсюда следует, что должна существовать некоторая интенсивная ТД переменная, характеризующая тепловое состояние и одинаковая для всех находящихся в ТД равновесии систем А, В, С. Это положение обычно называют нулевым началом термодинамики, а указанную интенсивную ТД переменную ‑ температурой.
Иногда в качестве подсистем (А, В,...) рассматриваются компоненты в многокомпонентной ТС и их взаимодействие учитывается через энтропию смешения. Такие ТС называются идеальными (идеальные растворы, смеси идеальных газов, в том числе химически реагирующих и т.д.). Принятие первого и второго постулатов ограничивает круг явлений, которые рассматриваются в линейной равновесной термодинамике. Оба постулата не применимы в неравновесной термодинамике. В самом деле, обладающие свойством самоорганизации принципиально открытые системы, например, биологические, социальные, будучи изолированными или разделенными на части, лишаются своих уникальных свойств.
1.3. Уравнения состояния Физические особенности ТС и характер ее взаимодействия с ОС накладывают ограничения на число независимых ТД переменных, которое должно быть равно числу степеней свободы ТС, т.е. числу независимых взаимодействий ее с ОС. Если состояние ТС определяется множеством независимых ТД переменных (x1,...xk), то остальные, зависимые, ТД переменные (xk+1, xk+2, ...) будут их функциями или функциями состояния ТС:
Соотношения, связывающие зависимые и независимые ТД переменные ТС, называются уравнениями состояния.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 187. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
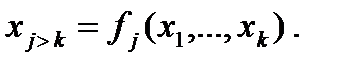 (1.1)
(1.1)