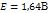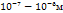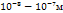Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Электролиз растворов. Совокупность окисл-восстан реакций, кот протекают на электродах в р-рах или расплавах электролитов при пропускании через них электрич тока, наз электролизом.На катоде источника тока происх процесс передачи электронов катионам из р-ра или расплава, поэтому катод является “восстановителем”. На аноде происходит отдача электронов анионами, поэтому анод является “окислителем”. При электролизе как на аноде, так и на катоде могут происхконкурирующие процессы.При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита или платины), как правило, конкурирующими являются два окислительных и два восстановительных процесса: на аноде — окисление анионов и гидроксид-ионов, на катоде — восстановление катионов и ионов водорода. При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими реакциями на электродах являются:на аноде — окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода; на катоде — восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода. При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии Окисл-восстан св-ва воды В воде возможны протекания 2ух процессов:1. Восстановление ионов водородом или молекул воды:
2. Окисление гидроксид анионов или молекул воды:
Уравнение Нертнса для восстановления ионов в воде:
Если pH=7, то Это значит, что система с потенциалом меньшем чем -0,41В => не устойчива в воде. (вода выступает как восстановитель) Классификация дисперсных систем. По размеру: глубодисп -  Среднедисперсные - Низкодисперсные - По агрегатному состоянию: |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 436. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
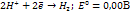


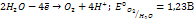
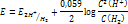
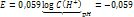

 (при рН=7)
(при рН=7)