
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Реальные газы. Уравнение состояния реальных газов.
Реальные газы. Чем больше плотность газа (чем ниже температура и больше давление), тем сильнее отклоняются свойства реальных газов от свойств идеального. Примером реального газа является воздух, широко применяемый в технике в качестве рабочего тела (в компрессорах, двигателях внутреннего сгорания и т. д.) . На рис. представлена зависимость отношения В реальных газах нельзя пренебречь собственным объемом молекул и силами межмолекулярного взаимодействия. Поэтому состояние реальных газов не может быть описано уравнением Клапейрона — Менделеева. Одним из уравнений, учитывающих свойства реальных газов, является уравнение Ван-дер-Ваальса
PV= m/ M × RT
Смеси идеальных газов и их свойства. Определение состава смеси. Смесь идеальных газов представляет собой механическую смесь отдельных газов, не вступающих между собой в химические реакции. Полагаем, что отдельные газы и смесь в целом подчиняются уравнению состояния Клапейрона — Менделеева. Содержание компонентов смеси обычно задается массовыми или объемными долями (чаще всего в процентах). Массовой долей  Объемная доля — отношение приведенного объема i-го газа к общему объему смеси: Под приведенным объемом понимается такой объем, который занимал бы газ при температуре и давлении смеси и при отсутствии других газов. Смесь идеальных газов подчиняется законам поведения идеальных газов (законам Авогадро, Клапейрона, Бойля— Мариотта и т. д.). Учитывая это обстоятельство, определим соотношение между массовыми и объемными долями. Формула перехода от массовых долей к объемным и наоборот имеет следующий вид: определении газовой постоянной Rи средней молярной массы смеси идеальных газов В смеси идеальных газов каждый i-й газ ведет себя так, как и при отсутствии других газов, т. е. равномерно заполняет весь объем V. Запишем уравнение Клапейрона для i-го газа:
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 357. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
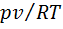 для некоторых газов от давления р при температуре T = 273,15 К. Отношение рv/(RТ) называется коэффициентом сжимаемости. Для идеального газа рv = RТ, откуда
для некоторых газов от давления р при температуре T = 273,15 К. Отношение рv/(RТ) называется коэффициентом сжимаемости. Для идеального газа рv = RТ, откуда 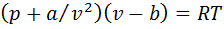 , в котором содержатся две поправки к уравнению идеального газа:
, в котором содержатся две поправки к уравнению идеального газа: 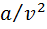 учитывает внутреннее давление, обусловленное силами взаимного притяжения молекул; b— объем молекул (несжимаемый объем). Значения а и bдля каждого газа различны.
учитывает внутреннее давление, обусловленное силами взаимного притяжения молекул; b— объем молекул (несжимаемый объем). Значения а и bдля каждого газа различны.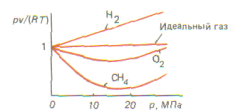
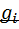 называется отношение массы i-го газа, входящего в смесь, к массе смеси:
называется отношение массы i-го газа, входящего в смесь, к массе смеси: 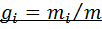 . Масса смеси из пкомпонентов
. Масса смеси из пкомпонентов 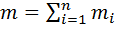 , а сумма их массовых долей
, а сумма их массовых долей 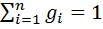 .
.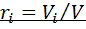
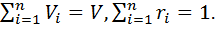
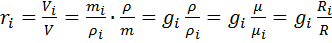
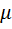 .
.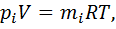 где
где 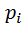 — парциальное давление.
— парциальное давление.