Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Теория Н. Бора для водородоподобных атомовСтр 1 из 5Следующая ⇒ Занятие 11 Атомная и ядерная физика В 1906 году Э.Резерфорд предложил применить метод зондирования атома с помощью α-частиц, которые возникают при радиоактивных превращениях.
В 1911 году возникла ядерная (планетарная) модель Резерфорда: в центре атома расположено плотное положительное ядро, диаметр которого 10-15-10-14 м и масса не менее 99,95% массы атома; вокруг ядра, подобно планетам, под действием силы Кулона вращаются электроны, образуя электронную оболочку атома (рисунок 2.1.4). Атом в целом нейтрален. Заряд ядра атома равен суммарному заряду электронов, входящих в его состав.
Теория Н. Бора для водородоподобных атомов В 1913 году датский физик Нильс Бор предложил отказаться от многих представлений классической физики и сформулировал постулаты, на основе которых должна строиться новая теория строения атома: 1. Постулат стационарных состояний: В атоме существуют стационарные орбиты, находясь на которых электрон обладает дискретным значением энергии Еn (n - номер орбиты); в стационарном состояние атом не поглощает и не излучает энергию. 2.Правило частот: При переходе электрона со стационарной орбиты с номером n на стационарную орбиту с номером k происходит (рисунок 4.2): – излучение фотона с энергией hνnk, если n > k (например, переход с уровня Е3 на Е2); – Энергия фотона равна разности энергии электрона на орбитах: Еф = hνnk = En-Ek.
Новая теория строения атома позволила: 1. Рассчитать радиус орбиты электрона в атоме водорода (Z = 1; n = 1) - первый боровский радиус 
где mе = 9,11∙10-31 кг - масса электрона; е = 1,6·10–19 Кл – заряд электрона; e0 = 8,85·10–12 Ф/м – электрическая постоянная; ħ = h/2π = 6,63·10–34 Дж/с - постоянная Планка; а также рассчитать радиус n-ой орбиты электрона для водородоподобных систем (состоящих из ядра с зарядом Ze и одного электрона)
т. е. тем самым подтвердить, что радиусы стационарных орбит электрона rn имеют дискретные значения и пропорциональны квадратам целых чисел.
2. Рассчитать энергию электрона на орбите в атоме водорода (Z = 1; n = 1)
а также рассчитать энергию электрона на n-ой орбите для водородоподобных систем
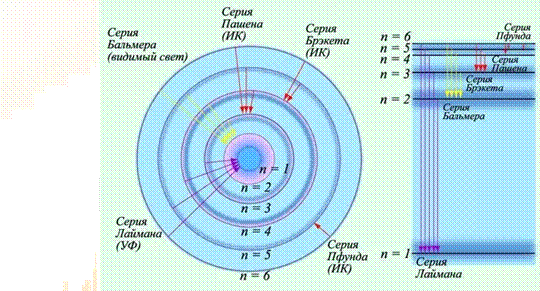
т. е. тем самым подтвердить, что энергия электрона Еn на n-ой стационарной орбите принимает дискретные значения. Знак «-» означает, что электрон связан в атоме силой притяжения к ядру. Целое число n в выражениях называется главным квантовым числом. Энергетическое состояние с n = 1 является основным состоянием, а соответствующий ему энергетический уровень - основным уровнем. Состояния с n > 1 и соответствующие им энергетические уровни называются возбуждёнными. Экспериментальным подтверждением теории Н. Бора является спектральный анализ. Спектральный анализ - это исследование спектров излучения (поглощения) различных веществ. Спектральный анализ был открыт в 1860 г. немецкими физиками Г. Кирхгофом и Р. Бунзеном.
Оптическим спектром называется распределение по частотам (или длинам волн) интенсивности оптического излучения некоторого тела (спектр излучения) или интенсивности поглощения при его прохождении через вещество (спектр поглощения). Спектры делятся на три вида – линейчатые, полосатые и сплошные (рисунок 4.3).
На основе экспериментальных спектральных исследований (ещё до создания квантовой теории атомов) в 1885 г. швейцарский физик И. Бальмер подобрал эмпирическую формулу, определяющую закономерность расположения спектральных линий атома водорода в видимой области:
где R=1,10∙107 м-1 - постоянная Ридберга. Опыт показал, что спектральные линии атома водорода в видимой области спектра представляют собой группу (серию) линий, называемую серией Бальмера. В дальнейшем (начало ХХ века) в спектре атома водорода было обнаружено еще несколько серий, например, в ультрафиолетовой области спектра - серия Лаймана, в инфракрасной области спектра - серия Пашенаи другие. Все серии линий в спектре атома водорода могут быть описаны – обобщенной формулой Бальмера:
где k = 1; 2; 3; ¼ - число, определяющее серию линий; n > k - число, определяющее отдельные линии серии.
Разложение излучения источников света в спектр осуществляется с помощью специальных оптических приборов – спектральных аппаратов.
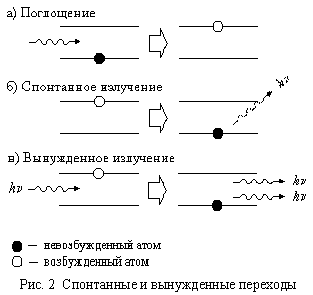
В состоянии термодинамического равновесия число невозбуждённых атомов в веществе много больше, чем число возбуждённых, поэтому фотоны (излучение) чаще взаимодействуют с невозбуждёнными атомами, т.е.поглощаются веществом. Но если в среде создать инверсную населенность (инверсию),
то вероятность встречи фотона с невозбуждённым атомом уменьшается, и усиление излучения с частотой ν =(En - Em)/h будет преобладать над поглощением. Среду с инверсной населенностью называют также активной. Такая среда представляет собой оптический квантовый усилитель (ОКУ), усиливающий свет указанной частоты, но не вырабатывающий его сам. Чтобы превратить ОКУ в лазер, то есть генератор излучения, активную среду помещают в оптический резонатор - систему отражателей, возвращающих в активную среду прошедшее сквозь нее излучение.
|
||
|
Последнее изменение этой страницы: 2018-05-31; просмотров: 655. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |



 поглощение фотона с энергией hνnk, если n < k (например, переход с уровня Е1 на Е2).
поглощение фотона с энергией hνnk, если n < k (например, переход с уровня Е1 на Е2).
 ,
, ; n = 2, 3, …,
; n = 2, 3, …,
 ; n = 2, 3, …,
; n = 2, 3, …,


 ,
,