
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Опыты Резерфорда по рассеиванию альфа-частиц. Ядерная модель атома. Квантовые постулаты Бора.
Слово «атом» в переводе с греческого означает «неделимый». Под атомом долгое время, вплоть до начала XX в., подразумевали мельчайшие неделимые частицы вещества. К началу XX в. в науке накопилось много фактов, говоривших о сложном строении атомов. Большие успехи в исследовании строения атомов были достигнуты в опытах английского ученого Эрнеста Резерфорда по рассеянию Резерфорд предположил, что атом устроен подобно планетарной системе. Суть модели строения атома по Резерфорду заключается в следующем: в центре атома находится положительно заряженное ядро, в котором сосредоточена вся масса, вокруг ядра по круговым орбитам на больших расстояниях вращаются электроны (как планеты вокруг Солнца). Заряд ядра совпадает с номером химического элемента в таблице Менделеева.  Планетарная модель строения атома по Резерфорду не смогла объяснить ряд известных фактов: электрон, имеющий заряд должен за счет кулоновских сил притяжения упасть на ядро, а атом — это устойчивая система; при движении по круговой орбите, приближаясь к ядру, электрон в атоме должен излучать электромагнитные волны всевозможных частот, т. е. излучаемый свет должен иметь непрерывный спектр, на практике же получается иное: электроны атомов излучают свет, имеющий линейчатый спектр. Разрешить противоречия планетарной ядерной модели строения атома первым попытался датский физик Нильс Бор. В основу своей теории Бор положил два постулата. Первый постулат: атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует своя энергия; в стационарном состоянии атом не излучает. Это означает, что электрон (например, в атоме водорода) может находиться на нескольких вполне определенных орбитах. Каждой орбите электрона соответствует вполне определенная энергия. Второй постулат: при переходе из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения. Энергия фотона равна разности энергий атома в двух состояниях: При переходе электрона с ближней орбиты на более удаленную атомная система поглощает квант энергии. При переходе с более удаленной орбиты электрона на ближнюю орбиту по отношению к ядру и томная система излучает квант энергии. Теория Бора позволила объяснить существование линейчатых спектров.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 441. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
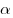 -частиц при прохождении через тонкие слои вещества. В этих опытах узкий пучок
-частиц при прохождении через тонкие слои вещества. В этих опытах узкий пучок  ;
;  , где
, где 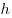 — постоянная Планка.
— постоянная Планка.