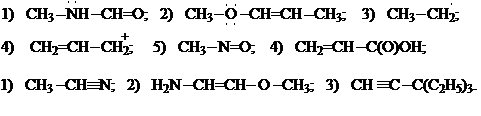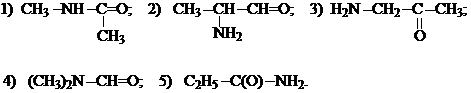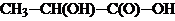Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Галогенопохідні вуглеводнівЗаняття 2. 27.02.2013 Типи хімічних зв'язків в органічних сполуках: йонні, ковалентні, донорно-акцепторні, водневі зв'язки. Квантово-механічні уявлення про природу s- та p-зв'язків. Типи гібридизації атома карбону. Основні характеристики ковалентних звязків атома карбону.
8. Поняття про йонний та ковалентний зв'язки. Вплив природи зв`язків на фізичні властивості речовин. 9. Поняття про полярність та поляризовність ковалентних зв'язків. Їх взаємозвязок з електронегативністю атомів, що утворюють зв'язок та способом перекривання атомних орбіталей. Запишіть часткові заряди на атомах позначеного зв`язку в сполуках:
10. Донорно-акцептерний зв'язок (координаційний зв"язок). Його різновидності. Семиполярний зв'язок та його вплив на фізичні властивості сполук. Які із наведених реакцій ведуть до утворення сполук з семіполярним зв'язком?
11. Поняття про водневий звязок та його прояв у фізичних властивостях сполук. Види водневого зв'язку. Які з наведених сполук здатні утворювати водневі зв`язки: а) між власними молекулами, а також з молекулами води; б) тільки з молекулами води?
12. Електронна будова атома карбону. Основний та збуджений стани. Поняття про гібридизацію АО карбону (Л.Полінг,1934). Типи гібридизації атома карбону. Форма, розміри та просторова напрямленість гібридних орбіталей. 13. Електронна характеристика σ- та π- зв`язків атома карбону. Наведіть дані про геометрію, довжину та енергію ординарного та кратних карбон-карбонових зв`язків.
Заняття 3. 06.03.2013 Взаємний вплив атомів у молекулі. Індукційний та мезомерний ефекти. Ефект надспряження (гіперкон’югації). Структурна теорія будови органічних сполук. Ізомерія органічних сполук. Стереохімічні уявлення в органічній хімії. Просторова ізомерія. Її види. 
14. Поняття про взаємний влив атомів в молекулі. Індукційний ефект. Природа його виникнення та розповсюдження в молекулі. Наведіть приклади атомів та груп, які проявляють а) позитивний інд.ефект (+І-еф); б) негативний інд.ефект (-І-еф). Наведені насичені кислоти запишіть в порядку зростання їх кислотних властивостей:
15. Поняття про взаємний вплив атомів, які в молекулі безпосередньо не зв`язані. Ефект спряження. Наведіть по декілька атомів та груп, які проявляють а) позитивний; б) негативний ефект спряження. В наведених прикладах покажіть стрілками наявність ефекту спряження, назвіть його тип:
1. Природний та попутний нафтові гази. Їх склад та хімічна переробка. Нафта, її склад та переробка. Світлі та темні нафтопродукти. Кам'яне вугілля. Коксування кам'яного вугілля та хімічна переробка продуктів коксування. 2. Значення теорій радикалів і типів, а також робіт А.Кекуле, А.Кольбе, А.Купера та Е.Франкланда для створення “Cтруктурної теорії хімічної будови”(О.М.Бутлеров, 1861). 3. Структурна теорія хімічної будови (О.М.Бутлєров, 1861 р.). Основні положення структурної теорії. Які з наведених сполук є структурними ізомерами?
4. Асиметричний атом карбону і оптична ізомерія. Поняття про енантіомери, відмінність їх властивостей. Способи позначення абсолютної конфігурації за допомогою спеціальних формул (клиноподібні зв’язки, проекційні формули Е.Фішера). Правила написання проекційних формул для оптичних ізомерів. Напишіть проекційні формули для сполук:
5. Просторова ізомерія та її види. Геометрична ізомерія. Які з наведених сполук мають геометричні ізомери? Напишіть проекційні формули їх геометричних ізомерів і назвіть їх за Z, E- та цис-транс- системами позначень:
6. Види просторової ізомерії. Оптична ізомерія. Поняття про відносну конфігурацію молекули. D-, L-Система позначення відносної конфігурації. Для тих з наведених сполук, які мають асиметричний атом карбону, напишіть проекційні формули їх енантіомерів:
7. Асиметричний атом карбону. Абсолютна конфігурація молекули. Система Кана-Інгольда-Прелога позначення абсолютної конфігурації молекули. Віднесіть наведені нижче речовини до R- або S-ряду, використовуючи “Обернене правило Потапова”.
Заняття 4. 13.03.2013 Механізми органічних реакцій. Інтермедіати в реакціях: вільні радикали, карбокатіони, карбаніони. Їх електронна характеристика. Взаємозв'язок між будовою та стабільністю. Реагенти в органічних реакціях. 1. Класифікація органічних реакцій за характером хімічних перетворень та механізмом. Символи позначень різних типів реакцій. Умови, які сприяють протіканню а) вільнорадикальних; б) йонних реакцій.
2. Поняття про активні проміжні частинки, що утворюються в умовах реакцій: вільні радикали, та карбени. Охарактеризуйте їх з електронної точки зору. Чим визначається їх відносна стійкість, яка сприяє швидшому їх утворенню. Залежність їх стабільності від будови. Назвіть стабілізуючі фактори; покажіть їх стрілками та відповідним перекриванням електронних хмар:
3. Поняття про карбени. їх просторова та електронна будова.
4. Поняття про карбаніони. Їх електронна будова та просторова конфігурація зв'язків. Чим визначається їх відносна стійкість та фактори, що їх стабілізують. Для наведених карбаніонів наявні стабілізуючі фактори зобразіть відповідним перекриванням електронних хмар та зміщенням електронної густини:
5. Поняття про карбокатіони. Електронна будова та просторова напрямленість звязків.Чим визначається їх відносна стійкість. Які фактори стабілізують наведені карбокатіони? Покажіть їх стрілками та перекриванням електронних хмар:
6. Поняття про органічні йони з зарядом на некарбоновому атомі. Утворіть оксонієві та амонієві йони зі сполук:
7. Органічні реагенти, їх класифікація. Наведіть приклади (не менше 5-ти) електрофільних, нуклеофільних та вільнорадикальних реагентів. Чим визначається реакційна здатність електрофільних, нуклеофільних та вільнорадикальних реагентів? В кожній парі визначте найбільш реакційноздатний реагент:
Покажіть стрілками та перекриванням електронних хмар стабілізуючі фактори. Назвіть їх.
8. Кислотність і основність органічних сполук. Визначення за Бренстедом-Лоурі та за Льюїсом (1923 р.). Наведіть приклади С-Н, О-Н, S-Н та N-Н-бренстедівських кислот, а також кислот і основ Льюїса. Як змінюється кислотність сполук під впливом електроноакцептерних та електронодонорних замісників?
9. Вкажіть, які з наведених сполук можуть виступати як: а) кислоти Льюїса, б) основи Льюїса?
Заняття 5. 20.03.2013 Алкани. Алкени 24. Галогенування алканів. Механізм процесу. В якому порядку зростає швидкість моногалогенування метану, етану, пропану та ізобутану? Що відбувається з більшою швидкістю - хлорування чи бромування? Чому? 25. Наведіть реакції сульфохлорування та сульфоокиснення для пропану. Поясніть просторове обмеження реакції при сульфохлоруванні різних за природою С–Н-зв’язків. 26. Особливості нітрування алканів. Напишіть реакції нітрування пропану нітратною кислотою та оксидами азоту. 27. Термічний крекінг алканів. Наведіть механізм термічного крекінгу. Поняття про b-розпад і диспропорціювання вільних радикалів у процесі термічного крекінгу. Поясніть, чому гази крекінгу містять значні кількості алкенів (20-30% етилену та 8-10% пропілену)? 28. Каталітичний крекінг алканів. Поняття про октанове число бензину. 29. Наведіть рівняння реакцій перетворення метану в 1) сажу; 2) ацетилен; 3) метансульфохлорид; 4) метилхлорид; 5) метанол; 6) нітрометан; 7) HCN; 8) формальдегід. 30. Особливості будови p-зв’язку на прикладі етену (тип гібридизації, просторова напрямленість, довжина та енергія, здатність до поляризації). До яких реакцій схильні алкени? Чи вступають вони в реакції нуклеофільного приєднання? Чому? Відповідь обгрунтуйте. 31. Методи одержання олефінів на прикладі пропену. 32. Які алкени ( С2Н4, пропен, ізобутилен) будуть найлегше вступати в реакцію з Cl2 за йонним механізмом? Поясніть відповідь з урахуванням стабільності проміжних карбокатіонів. 33. Розглярьте механізм електрофільного приєднання НBr до пропену. Правило Марковнікова та його сучасне трактування. Поясніть стабільність інтермедіатів (проміжних частинок) при цьому. 34. Розглярьте механізм приєднання HBr до пропену в присутності кисню (пероксидний ефект Хараша-Майо). Порівняйте стабільність інтермедіатів (проміжних частинок), що утворюються при цьому. Сучасне трактування пероксидного ефекта Хараша-Майо. 35. Гідратація алкенів. Напишіть реакції гідратації етену та ізобутилену в присутності H2SO4. 36. Напишіть реакції окиснення пропену : 1) р-ном KMnO4 при кімн. темп.; 2) киснем повітря в присутності каталізатора та без нього; 3) р-ном KMnO4 при нагріванні; 4) озоном (Гаррієс); 5) пероксидними сполуками (Прилежаєв). З якого алкену при озонуванні (після гідролізу) утворюєься оцтовий альдегід та ацетон? 37. Напишіть реакції, за допомогою яких можна отримати з пропену наступні сполуки: СН3–СН(ОН)–СН3; 2) CH3CH2CH2Br; 3) CH3–CH(OH)–CH2–OH; 4) CH2=CH–CHO; a. CH2=CH–CH2OH; 6) СН2О та СН3С(О)Н. 38. Напишіть реакції взаємодії ізобутилену з: 1) HBr; 2) HBr в присутності кисню (пероксидів); 3) Cl2; 4) водним p-ном KMnO4 при кімн. темп. ; 5) p-ном KMnO4 або хромовою сумішшю при нагріванні.
Заняття 6. 27.03.2013 Алкадієни. Алкіни 39. Поняття про алкадієни зі спряженими p-зв’язками. Особливості будови спряжених алкадієнів. Поняття про енергію спряження (резонансу). 40. Поняття про S-цис-транс-ізомерію алкадієнів з кон’югованими подвійними зв’язками Напишіть структурні формули всіх структурних і геометричних ізомерів алкадієнів С5Н8. Назвіть їх за правилами IUPAC. 41. Наведіть всі відомі Вам методи синтезу бутадієну-1,3. Наведіть будову стереорегулярного бутадієнового каучука. 42. Наведіть всі відомі Вам схеми синтезу ізопрену. Напишіть реакцію взаємодії ізопрену з акрилонітрилом, акролеїном СН2=СН–СНО, акриловою кислотою СН2=СН–СООН. 43. Наведіть схеми синтезу хлоропрену. Реакція полімеризації хлоропрену з утворенням хлоропренового каучуку. Напишіть будову натурального, бутадієн-стирольного та бутадієн-нітрильного каучуків. 44. Напишіть реакцій електрофільного приєднання брому та бромоводню до 1,3-бутадієну. Поняття про напрямок (1,2- або 1,4-) реакцій приєднання реагентів до спряжених алкадієнів. 45. Поняття про реакції циклодимеризації алкадієнів та дієнового синтезу (Дільс-Альдер). Напишіть реакції взаємодії дивінілу з акрилонітрилом, акролеїном СН2=СН–СНО, акриловою кислотою СН2=СН–СООН, метилвінілкетоном СН2=СН–С(О)–СН3 та метилвініловим етером СН2 =СН–О–СН3. Поняття про дієнофіли. 46. Електронна будова ацетилену (тип гібридизації атомів вуглецю, просторова напрямленість зв’язків, довжина та енергія потрійного зв’язку, здатність до поляризації). 47. Промислові методи одержання ацетилену. Синтезуйте на його основі: 1) вінілацетилен; 2) вінілметиловий етер; 3) акрилонітрил; 4) вінілацетат; 5) пропінол; 6) спирт Фаворського; 7) оцтовий альдегід; 8) 1,4-бутандіол. 48. Хімічні властивості алкінів. Напишіть реакції ацетилену з: 1) Н2О за умов реакції Кучєрова; 2) HCN; 3) H2C=O; 4) HCl; 5) C2H5OH; 6) NaNH2; 7) [Ag(NH3)2]ОН; 8) CH3COOH. 49. Обгрунтуйте, чому алкіни вступають у реакції нуклеофільного приєднання на відміну від алкенів. Наведіть відповідні реакції. 50. Синтезуйте з етину: 1,1-дихлоретан; вінілбромід; пропаргіловий спирт; хлоропрен; 1,3-бутадієн; вінілацетат і вінілпропіловий етер. 51. Обгрунтуйте, чому ацетилен має кислотні властивості? Напишіть рівняння реакцій, що підтверджують кислотні властивості ацетилену. 52. Напишіть реакції полімеризації ацетилену (димеризація, олігомеризація та полімеризація). Заняття 7. 03.04.2013 Циклоалкани. Арени
53. Напишіть загальні і спеціальні методи одержання циклоалканів. Які сполуки можна одержати в результаті дієнового синтезу ізопрену з: 1) акрилонітрилом, 2) вінілметилкетоном, 3) малеїновим ангідридом. Назвіть ці сполуки. 54. Використовуючи різні методи одержання циклопарафінів одержіть: 1) циклопентанкарбонову кислоту, 2) етилциклопентан, 3) циклопропан, 4) циклогептанон. 55. Методи одержання циклоалканів з дигалогенопохідних, піролізом солей двоосновних кислот, метод Ружички, естерна конденсація за Дікманом. 56. Аліциклічні сполуки, будова, класифікація, номенклатура. Хімічні властивості циклоалканів: гідрування, приєднання та заміщення, окиснення. Залежність реакційної здатності циклу від його розміру. Теорія напруження Байера. Поняття про “бананоподібний” зв’язок у циклопропані.
57. Будова бензену. Енергія резонансу, поняття про “ароматичний характер” сполук. Правило Хюккеля. Наведіть приклади небензоїдних ароматичних систем. 58. Хімізм і механізм реакції алкілювання бензену та його гомологів. Поняття про π- і σ - комплекси. 59. Хімізм та механізм реакцій галогенування та нітрування ароматичного ядра та бічного ланцюга. Поняття про π - та σ - комплекси. 60. Хїмічні властивості бензену: реакції електрофільного заміщення. Реакції приєднання хлору, водню, озону. Реакції окиснення. 61. Правила орієнтації вступаючих в бензенове ядро нових груп вже наявними в ядрі замісниками. Наведіть всі відомі Вам замісники першого та другого роду та напишіть по три реакції нітрування бензену із замісниками кожного роду, вкажіть умови та назвіть продукти реакцій.
Заняття 9. 17.04.2013 Галогенопохідні вуглеводнів 62. Методи одержання галогенопохідних насичених вуглеводнів. 63. Механізми реакцій нуклеофільного заміщення SN1 та SN2 для галогенопохідних. Вплив будови алкільної групи та розчинника на механізм та стереохімію реакцій SN. 64. Поняття про реакції відщеплення (елімінювання) для галогенопохідних. Напишіть реакції відщеплення HBr від СН3СН2Br та 2-метил-2-бромопентану у лужному середовищі. За якими механізмами (Е1 або Е2) відбуваються ці реакції. 65. Виходячи з етилброміду синтезуйте: 1) нітроетан; 2) діетиловий етер (ефір); 3) етиламін; 4) етилацетат. 66. Флуоропохідні вуглеводнів. Методи одержання фреонів, флуоропластів та тефлону. Чим пояснити хімічну інертність флуоропохідних алканів. 67. Напишіть схему реакцій ізопропілхлориду з: 1) Na; 2) натрій ацетатом; 3) NaCN; 4) водним р-ном NaOH; 5) спирт. р-ном KOH. 68. Напишіть схеми реакцій ізобутилброміду з: 1) водним роз-ном NaOH; 2) спирт. розчином NaOH; 3) Na; 4) натрій ацетатом; 5) KCN. 69. Галогенування алкенів. Аномальне хлорування пропену. Напишіть реакції утворення з пропену алілхлориду та 1,2-дихлоропропану. 70. Напишіть схеми реакцій одержання хлороформу з етанолу та з ацетону. 71. Виходячи з дихлоропропанів С3Н6Cl2 синтезуйте: 1) пропіленгліколь (1,2-пропандіол); 2) триметиленгліколь (1,3-пропандіол); 3) ацетон; 4) пропін; 5) пропан. 72. Розгляньте механізми галогенування бензенового ядра і бокового ланцюга алкіларенів. Напишіть реакції хлорування бензену і толуену хлором: 1) при освітленні, 2) в присутності FeCl3. Як можна відрізнити бензилхлорид від п-хлоротолуену? 73. Напишіть для хлоробензену реакції заміщення хлору на гідроксильну та аміногрупи. Вкажіть умови їх протікання. Розгляньте вплив електроноакцепторних замісників в бензиновому ядрі на швидкість цих реакцій. 74. Порівняйте реакційну здатність атома хлору в хлорбензені та бензилхлориді. Відповідь обгрунтуйте. Напишіть рівняння реакцій взаємодії бензилхлориду з: 1) розчином лугу, 2) С2Н5ОNа, 3) АgNO2, 4) КСN, 5) NH3. Назвіть одержані продукти.
|
||||||||
|
Последнее изменение этой страницы: 2018-05-31; просмотров: 566. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |