Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
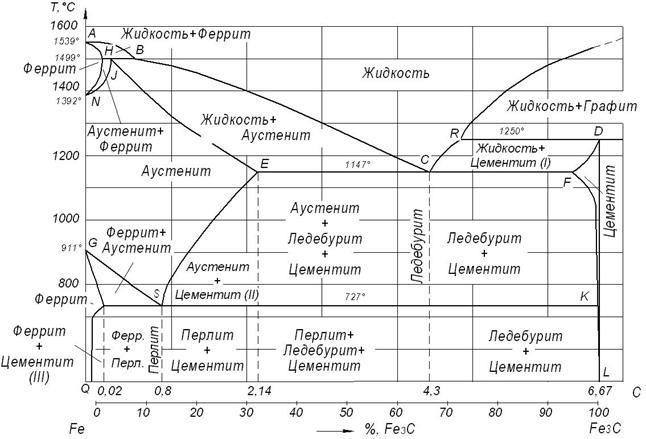
Диаграмма состояния для сплавов, образующих химические соединения.Такая диаграмма получается (рис. 3.1, д), когда сплавляемые компоненты образуют устойчивое химическое соединение АnВm, не диссоциирующее при нагреве вплоть до температуры плавления и образующее промежуточную фазу постоянного состава. Химическое соединение считается устойчивым, если оно плавится без разложения. При концентрации, соответствующей химическому соединению АnВm, отмечается характерный перелом на кривой свойств. Это объясняется тем, что некоторые свойства химических соединений обычно резко отличаются от свойств образующих их компонентов. Обычно такие диаграммы состояния характерны для систем, образованных металлами и элементами, которые обладают и металлическими, и неметаллическими свойствами. В ряде диаграмм состояния сплавов, образующих химические соединения (рис. 3.1, е), могут возникать промежуточные фазы переменного состава Помимо устойчивых химических соединений, которые плавятся (кристаллизуются) при постоянной температуре, в диаграммах могут образовываться и неустойчивые химические соединения, распад которых происходит еще до достижения температуры плавления. 6. Диаграмма состояния для сплавов с полиморфным превращением одного из компонентов. Простейшая диаграмма состояния системы с рядом γ-твёрдых растворов между высокотемпературной модификацией компонента А и компонентом В показана на рисунке 3.1, ж. Линии CE и CD – линии начала и конца полиморфного превращения γ → α. В сплавах участка Е–D подобное превращение до конца не доходит, и при комнатной температуре они сохраняют двухфазную структуру (γ + α). Сплавы, лежащие правее точки D, полиморфного превращения не испытывают и при всех температурах ниже солидуса имеют структуру  Диаграмма состояния сплавов с полиморфными превращениями компонентов и эвтектоидным превращением. Диаграмма состояния сплавов, у которых высокотемпературные модификации компонентов γ обладают полной взаимной растворимостью, а низкотемпературные αF, βN – ограничены, приведена на рисунке 3.1, з. По аналогии с линией эвтектического превращения DCE и эвтектической точкой C на рисунке 3.1, в линию СDE называют линией эвтектоидного превращения, а D – эвтектоидной точкой. Смесь кристаллов ограниченных растворов α (на основе низкотемпературной модификации полиморфного компонента А) и β (на основе низкотемпературной модификации полиморфного компонента В), которая образуется в твердом состоянии по реакции γD → αC + βE, получила название эвтектоида. Сплавы, расположенные левее эвтектоидной точки D, называют доэвтектоидными, а сплавы, расположенные правее D, – заэвтектоидными. Компоненты, фазы и структурные составляющие Железоуглеродистых сплавов Диаграммы состояния систем конкретных компонентов (например, «Железо – углерод», «Медь – алюминий» и др.) редко являются простейшими (типовыми) диаграммами. Они, как правило, являются сложными (комбинированными) диаграммами, в строении которых нужно уметь выделить простейшие (типовые) части их. Рассмотрим диаграмму состояния «Железо – углерод (цементит)»
Рис. 3.2. Диаграмма «Железо – углерод (цементит)»
Углерод имеет ряд полиморфных модификаций: графит, алмаз, карбин, фуллерен, графен и другие. Графит – минерал из класса самородных элементов. Структура слоистая, состоят из шестиугольных слоев атомов углерода. Графит хорошо проводит электрический ток. В отличие от алмаза обладает низкой твёрдостью (1–2 по шкале Мооса). Плотность 2,08–2,23 г/см³. Цвет серый, блеск металлический. Устойчив при нагревании в отсутствие воздуха (температура плавления графита под давлением свыше 100 атм. – около плюс 4000 °C). Главные отличительные черты алмаза – высочайшая среди минералов твёрдость, наиболее высокая теплопроводность среди всех твердых тел. Алмаз является диэлектриком. У алмаза очень низкий коэффициент трения по металлу на воздухе – всего 0,1, что связано с образованием на поверхности кристалла тонких пленок адсорбированного газа, играющих роль своеобразной смазки. Когда такие пленки не образуются, коэффициент трения возрастает и достигает 0,5–0,55. Низкий коэффициент трения обусловливает исключительную износостойкость алмаза на стирание. Для алмаза также характерны самый высокий (по сравнению с другими известными материалами) модуль упругости и самый низкий коэффициент сжатия. Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9–2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу. Карбин – линейный полимер углерода. Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано его практическое применение – в фотоэлементах. Другой модификацией элементарного углерода является фуллере́н – молекулярное соединение, представляющее собой выпуклые замкнутые многогранники, составленные из чётного числа трёхкоординированных атомов углерода. Применяются фуллерены как полупроводники (при легировании как сверхпроводники), в оптической технике, при создании лекарств и искусственных алмазов. Графе́н − двумерная полиморфная модификация углерода, образованная слоем атомов углерода толщиной в один атом, соединенных в гексагональную двумерную кристаллическую решётку. Его можно представить как одну плоскость графита, отделённую от объёмного кристалла. Графен обладает большой механической жёсткостью и хорошей теплопроводностью (~1 ТПа и ~5×103 Вт/(м·К) соответственно). Высокая подвижность носителей заряда делает его перспективным материалом для использования в самых различных приложениях, в частности, как будущую основу наноэлектроники и возможную замену кремния в интегральных микросхемах. Железо с углеродом образует растворы внедрения. Растворимость углерода в железе зависит от температуры и от того, в какой кристаллической форме существует железо. Твердый раствор углерода в Feα называется ферритом,а в Feγ – аустенитом. Содержание углерода в диаграмме «Железо – углерод» ограничивается 6,67 %, так как при этой концентрации образуется химическое соединение Fe3C –цементит. Так как на практике применяют железоуглеродистые сплавы с содержанием углерода не более 5 %, то цементит является вторым компонентом рассматриваемой диаграммы. Цементит – неустойчивое химическое соединение, и при определенных условиях он распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение для получения высокоуглеродистых сплавов – серых чугунов. Координаты характерных точек диаграммы «Железо – цементит» приведены в таблице 3.1 Превращения в сплавах системы «Fe – Fe3C» происходят как при затвердевании жидкой фазы, так и в твердом состоянии. Первичная кристаллизация идет в интервале температур, определяемых линиями ABCR (ликвидус) и AHIECFD (солидус). Вторичная кристаллизация вызвана превращением железа одной модификации в другую и переменной растворимостью углерода в аустените и феррите, при понижении температуры растворимость уменьшается. Избыток углерода из твердых растворов выделяется в виде цементита. Линии ES и PQ характеризуют изменение концентрации углерода в аустените (ES) и феррите (PQ). Таблица 3.1 |
||
|
Последнее изменение этой страницы: 2018-05-30; просмотров: 208. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |