
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Какой термодинамический процесс является обобщающим для идеального газа.А) PVk = const адиабатный; В) P = const изобарный; С) T = const изотермический; D) V = const изохорный; Е) PVn = const политропный. 6. Как рассчитать величину изменения энтропии в изотермическом процессе: А) ∆S = CVln D) ∆S = Rln 7. Определите теплоёмкость газа при постоянном давлении, если его теплоёмкость при постоянном объёме равна 2,46 кДж/м3К, а величина К = 1,4 (условия нормальные): А) 1,757 кДж/м3К; В) 0,86 кДж/м3h; С) 3,44 кДж/м3h; D) 2,46кДж/м3К; Е) –2,46 кДж/м3 · К.
8. Как рассчитать теплоёмкость газовой смеси? А) рассчитать нельзя, определяется только экспериментальным путём; В) определяется как сумма произведений долей на теплоёмкость каждого компонента Ссм = С) определяется как сумма теплоёмкостей каждого компонента, умножаемая на общее давление смеси: Ссм = Робщ D) Ссм = Е) Ссм = 0. 9. При давлении 3 атм. газ занимает объем равный 0,5 м3. Рассчитать какой объем будет занимать этот же газ при давлении равном 1,5 атм. A) 1м3; 10. Газ находится при температуре 298К и занимает объем 6м3. При какой температуре этот же газ будет занимать объем 3м3? Ответ указать в 0 С. A) – 1980С; 11. Газовая смесь содержит 25% СО2. Общее давление газовой смеси составляет 1,5 атм. Каково парциальное давление СО2 в смеси? A) 6 атм; Какой процесс называется адиабатным? А) при постоянной внутренней энергии В) изменение энтропии равно нулю С) при постоянном давлении D) изменение температуры процесса равно нулю Е) работа процесса равна нулю 13. Что показывает площадь под кривой термодинамического процесса на TS- диаграмме:  А) изменение энтропии процесса; В) изменение теплоёмкости вещества в ходе процесса; С) количество теплоты; участвующее в процессе; D) кол-во работы; участвующее в процессе; Е) не имеет физического смысла.
14. С введением новой функции энтальпии 1-ый закон термодинамики можно записать: А) dq = dh; B) dq = dh - vdp; C) dh = CpdT D) dq = dh - Td; Е) dh = 0.
Из приведенных выражений укажите аналитическую формулировку энтальпии А) dl = pdV; В) С) H = u + pV; D) dq = dU = pdV; Е) dU = CvdT.
16. Энтальпия любой термодинамической системы представляет собой: А) отношение количества теплоты к температуре на бесконечно малом участке процесса; В) изменение внутренней энергии и связанное с этим изменение кол-во теплоты; С) внутреннюю энергию системы и потенциальную энергию внешних сил; D) кол-во теплоты и связанное с этим изменение энтропии; Е) изменение внутренней энергии.
Какие термодинамические циклы называются обратными? A) в которых работы сжатия и расширения равны. B) в которых работа сжатия больше работы расширения. C) в которых работа сжатия меньше работы расширения. D) в которых не происходит изменения энтропии. E) в которых не происходит изменения энтальпии. Чему равно изменение энтальпии для изобарного процесса, если количество подведённой в процессе теплоты составляет 186 кДж. A) dh = 0; B) dq = dh; Þ dh = 186 кДж; C) dq = - dh Þ dh = -186 кДж; D) dq = dh + ∞ Þ dh = ∞; E) ответить нельзя, мало информации.
19. PVn = const. Это основное уравнение политропного процесса. Чему равно n? А) n = D) n = В каких единицах измеряется массовая теплоемкость? А) дж; В) дж/ (кг С о); С) Вт/м2 ·оС; D) Па; Е) Вт.
Преподаватель каф ТЭ Прокурат Ф.Ш. Зав.каф. ТЭ Баубеков К. Т.
Дисциплина: Теплотехника Язык обучения: русский Рубежный контроль 1 ВАРИАНТ №5
1. Совокупность материальных тел, находящихся в тепловом и механическом взаимодействии друг с другом называется: А) окружающей средой В) термодинамическим процессом С) термодинамической системой Е) рабочим телом D) состоянием равновесия 2. Термодинамическая система по характеру взаимодействия с окружающей средой может быть: А) равновесной В) неравновесной С) обратимой Е) необратимой D) изолированной 3. Отличительным признаком термодинамической системы от других объектов является наличие: А) внутренней энергии В) параметров состояния С) температуры Е) избыточное давление D) контрольная поверхность 4. Взаимосвязь параметров системы, характеризующих термодинамическую систему, называется: А) функцией состояния В) функцией процесса С) уравнением состояния Е) состоянием рабочего тела D) термодинамическим процессом 5. Любое изменение термодинамической системы называется: А) релаксацией В) термодинамическим процессом С) движением Е) расходом рабочего тела D) неравновесностью системы 6. Условием равновесности термодинамического процесса является выполнение условия: А) D) такого условия нет 7. В условии равновесности термодинамического процесса А) скорость изменения температуры В) скорость изменения давления С) скорость изменения какого-либо параметра Е) расход рабочего тела D) скорость изменения внутренней энергии 8. В условии равновесности термодинамического процесса А) скорость изменения температуры В) скорость изменения давления С) скорость изменения какого-либо параметра Е) скорость изменения какого-либо параметра в процессе релаксации D) скорость изменения внутренней энергии
9. Самопроизвольный переход изолированной термодинамической системы в состояние равновесия называется: А) термодинамическим процессом В) процессом релаксации С) скоростью изменения какого-либо параметра Е) движением системы D) дросселированием
10. Укажите верное утверждение: А) все реальные медленные процессы являются равновесными В) все реальные медленные процессы являются обратимыми С) все реальные процесс являются неравновесными и необратимыми Е) в реальных процессах силой трения можно пренебречь D) реальные газы полностью подчиняются газовым законам 11. В уравнении Ван-дер-Ваальса для реальных газов А) влияние объема реальных молекул В) силы взаимодействия между молекулами С) не имеет физического смысла Е) силу трения между молекулами D) влияние внешней среды 12. В уравнении Ван-дер-Ваальса для реальных газов А) влияние объема реальных молекул В) силы взаимодействия между молекулами С) не имеет физического смысла Е) силу трения между молекулами D) влияние внешней среды 13. Уравнение Ван-дер-Ваальса А) использовано только для идеальных газов В) не может быть использовано для газовых смесей С) не имеет физического смысла для газовых систем Е) использовано для водяных паров, т.к. последние далеки от состояния идеальных газов D) использовано для любых реальных систем, в том числе и для жидкостей
14. Механическая смесь газовых компонентов, химически инертных по отношению друг к другу в состоянии эксплуатации, называется: А) смесью Дальтона В) равновесной системой С) неравновесной системой Е) смесью Томпсона D) газовой смесью 15. Укажите неверное утверждение: А) реальные процессы являются неравновесными В) газовые законы полностью выполняются только для идеальных газов С) газовые смеси подчиняются только закону Дальтона Е) реальные газы по свойствам отличаются от идеальных газов D) универсальная газовая постоянная имеет физический смысл
16. Какой из газов по свойствам приближается к состоянию идеального газа: А) газовая смесь при высоком давлении В) ненасыщенный водяной пар С) насыщенный водяной пар Е) влажный воздух D) перегретый пар
|
||
|
Последнее изменение этой страницы: 2018-05-30; просмотров: 237. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 ; В) ∆S = Cpln
; В) ∆S = Cpln  ; С) ∆S = Rln
; С) ∆S = Rln  ;
;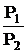 ; Е)
; Е)  S = 0.
S = 0. ;
;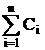 ;
; ;
; ;
; ; В) n =
; В) n =  ; С) n =
; С) n =  ;
;  Е) n = k
Е) n = k В)
В)  С)
С)  Е)
Е) 
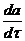 означает:
означает: величина b учитывает:
величина b учитывает: учитывает:
учитывает: