Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
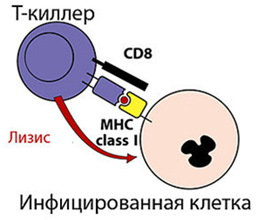
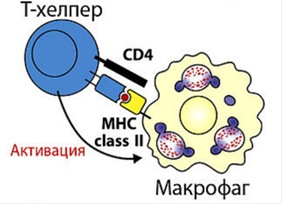
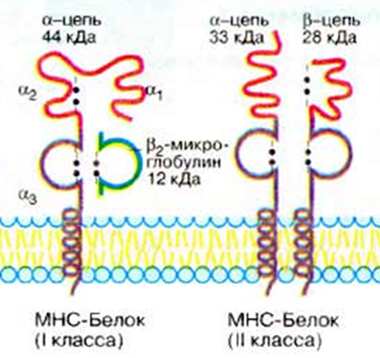
Экспрессия на мембране клеткиГены MHC кодоминантны, т.е. одновременно экспрессируются гены материнской и отцовской хромосом. Генов MHC-I по 3 (А, В, С) в каждой из гомологичных хромосом, генов MHC-II - также по 3 (DP, DQ, DR); следовательно, если у матери и отца нет одинаковых аллелей, то каждый человек имеет как минимум 12 различных основных аллелей каждого гена MHC классов I и II, вместе взятых. МНС I классасостоит из 2-х цепей. Тяжелой α-цепи и легкой β2-микроглобулина α-цепь, включает три фрагмента: внеклеточный, трансмембранный и цитоплазматический. Внеклеточный содержит 3 домена - α1, α2 и α3. Связывание антигенного пептида происходит в щели, образованной α1- и α2-доменами. Экспрессия и функции МНС 1 класса Экспрессия:антигены представлены на всех клетках, тканях и органах, поэтому они являются главными трансплантационными антигенами. РИСУНОК 1!! Функции:Р-ция отторжения трансплантата;Рестрикция акт-ти цитотоксических р-ций Т-киллеров. Презентация АГ MHC-I «обслуживают» зону цитозоля, сообщающегося через ядерные поры с содержимым ядра. Здесь происходит фолдинг синтезированных белковых молекул. При возникновении ошибок (в том числе и при синтезе вирусных белков) белковые продукты расщепляются в мультипротеазных комплексах (протеосомы). Образующиеся пептиды связываются с молекулами MHC-I, которые представляют T-лимфоцитам внутриклеточно образующиеся пептидные АГ. Поэтому CD8+ T-лимфоциты, которые распознают комплексы АГ с MHC-I, участвуют в первую очередь в защите от вирусных, а также внутриклеточных бактериальных инфекций. Этапы подготовки вирусных белков к взаимодействию с молекулами I класса главного комплекса гистосовместимости:  I этап - разрушение вирусных белков, находящихся в цитозоле, с помощью протеазного комплекса - протеосомы. II этап - транспорт образовавшихся пептидов во внутреннее пространство эндоплазматического ретикулума с помощью ТАР-1 и ТАР-2, образующих гетеродимер на эндоплазматической мембране. III этап - встреча транспортируемых пептидов с молекулами I класса МНС. Взаимодействие пептида с молекулой I класса приводит к отсоединению калнексина. Образовавшийся комплекс пептид: молекула I класса готов к дальнейшему транспорту к плазматической мембране. IV этап - комплекс через аппарат Гольджи транспортируется к клет. поверхности, вирусн.пептид в комплексе с молекулой МНСI становится доступным для его распознавания TCR. МНС II класса: гетеродимер из двух нековалентно связанных цепей α и β, каждая из которых включает два домена: α1, α2 и β1, β2 (соответственно). Антигенсвязывающую область образуют α1- и β1-домены. Экспрессия: антигены представлены на макрофагах, В-лимфоцитах и активированных Т-лимфоцитах. РИСУНОК 2!! Функции: Реакция трансплантат против хозяина, Рестрикция взаимодействий: Т-h1 и Т-h2. Презентация АГ MHC-II: Зона «обслуживания» связана с внеклеточной средой и с клеточными органоидами (аппарат Гольджи, ЭПС, лизосомы, эндосомы и фагосомы). Пептиды, образующиеся в данной зоне, имеют внеклеточное происхождение - это продукты протеолиза белков, захваченных клеткой посредством эндоцитоза или фагоцитоза. Молекулы MHC-II с помощью кальнексина экспонируются внутрь везикул (эндосом или фаголизосом) и только здесь, связавшись с пептидным АГ, принимают необходимую конформацию для дальнейшей экспрессии на мембране клетки. Таким образом, молекулы MHC-II осуществляют представление АГ при развитии иммунных реакций на внеклеточные инфекции. Главную роль в этих реакциях играют CD4+ T-лимфоциты, распознающие АГ в комплексе с MHC-II. Этапы подготовки вирусных белков к взаимодействию с молекулами II класса главного комплекса гистосовместимости: I этап - поглощение бактерий или их токсинов фагоцитирующей, способной к презентации антигена клеткой и разрушение захваченного материала до отдельных пептидов в фаголизосомах. II этап - во внутреннем пространстве ЭПР происходит сборка молекул II класса, которые до встречи с пептидом комплексированы со с инвариантной цепью (Ii). Этот белок защищает молекулу II класса от случайной встречи с бактериальными пептидами в эндоплазматическом ретикулуме. Комплекс молекулы II класса с Ii покидает эндоплазматический ретикулум в составе вакуоли. III этап - вакуоль, содержащая комплекс молекулы II класса с Ii, сливается с фаголизосомой. Протеазы разрушают Ii белок и снимают запрет на взаимодействие МНС II с бактериальными пептидами. Комплекс пептид + МНС II в составе секреторной вакуоли перемещается к мембране. Результат – экспрессия АГ пептида в комплексе с МНС II класса на клеточной поверхности. Это обеспечивает доступность АГ пептида для TCR Т-клеток.
РИСУНОК 1 РИСУНОК 2 РИСУНОК 3 (строение МНС I и МНС II)
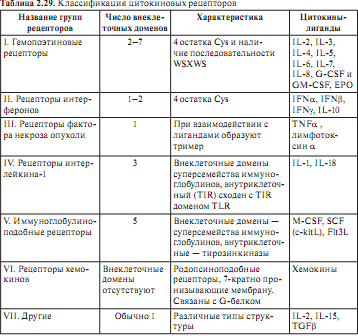
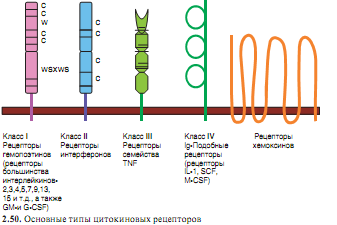
Билет 19 1.Традиционная классификация отражает историю изучения цитокинов. выяснилось, что четко разграничить лимфокины и монокины нельзя, и был введен общий термин — «цитокины». В 1979 г. на симпозиуме по лимфокинам в Интерлакене (Швейцария) установили правила идентификации факторов этой группы, которым присвоили групповое название «интерлейкины» (IL). Тогда же свои названия получили два первых члена этой группы молекул — IL-1 и IL-2. С тех пор все новые цитокины получали обозначение IL и порядковый номер. Цитокины с противовирусной активностью — интерферонов (IFN), колониестимулирующих факторов — CSF и факторов некроза опухоли — TNF. еще одна группа цитокинов — хемокины. по особенностям их вторичной структуры выделяют несколько групп: Молекулы с преобладанием α-спирализованных тяжей, Молекулы с преобладанием β-складчатых структур, Короткая α/β-цепь — хемокины, Смешанные мозаичные структуры, например, IL-12 Есть классификацию, основанная на принадлежности цитокинов к структурно-функциональным семействам. Действие цитокинов осуществляется через рецепторы. В состав С-концевой цитоплазматической части некоторых цитокиновых рецепторов (относящихся к суперсемейству Ig) входит домен, обладающий активностью тирозинкиназы. Рецепторы, обладающие собственной киназной активностью, запускают передачу сигнала непосредственно, поскольку их киназа обусловливает фосфорилирование как самого рецептора, так и прилежащих к нему молекул. Наиболее типичный вариант проявления активности характерен для рецепторов гемопоэтинового (цитокинового) типа, содержащих 4 α-спиральных домена. К цитоплазматической части таких рецепторов примыкают молекулы тирозинкиназ группы Jak-киназ. В состве Jak-киназ нет информационного домена. Особенности работы: работает только с рецепторами к IL, работают всегда в паре, их всегда 2 у одного рецептора, активируются аутофосфорелируя друг друга. В норме цитокиновые рецепторы в собранном состоянии, на клетке их нет. Они состоят из 2 или 3-х субъедениц, если цитокина вблизи нет. Когда появляется цитокин он связывается с главной субъеденицей, после заряда изменяется конформация и присоединяется вторая субъединица. Заряд передается в цитоплазматическую часть каждой субъединицы рецептора. С каждой субъединицей связывается своя Jak-киназа. Она получает заряд, меняет конформацию, открывается каталитический центр. Они фосфорелируют друг друга. На наих сразу садятся факторы транскрипции STAT белки. сразу 2 STAT белка получают заряд, открываются тирозины, они фосфорелируются Jak-киназами. Дальше STAT идуд в ядро. Принципы работы рецепторв хемакинов. G-белок состоит из 3-х субедениц. Альфа, бета, гамма. 2 якоря на альфа и гамма. Суперсемейство – серпентированное семейство. Серпентированные рецепторы состоят из одной полипептидной цепи, которая 7 раз пересекает мембрану. Внизу на петлях живет G-белок. Меняет конформацию, распадается на 2 субъединицы альфа, бета и гамма. Открывают собственные каталитические центры. Цитокиновая сеть при активации клеток чужеродными агентами индуцируется как синтез цитокинов, так и экспрессия их рецепторов. Это создает условия для локального проявления эффектов цитокинов. Свойство близкодействия отличает цитокины от гормонов — дальнодействующих факторов. Для системы цитокинов характерна избыточность. Это означает, что практически любую выполняемую конкретным цитокином функцию дублируют другие цитокины. Помимо избыточности, в системе цитокинов проявляется и другая закономерность: цитокины плейотропны (действуют на различные мишени) и полифункциональны (вызывают различные эффекты). Столь же разнообразны вызываемые ими эффекты, участвующие в формировании комплексных реакций: воспаления, некоторых этапов гемопоэза, нейротропных и других реакций. Еще одна важная черта, свойственная системе цитокинов, — взаимосвязь и взаимодействие цитокинов. одни цитокины усиливают или подавляют действие других цитокинов. Описаны синергизм (например, внутри группы провоспалительных цитокинов) и антагонизм цитокинов. ни один из цитокинов не существует и не проявляет своей активности изолированно — на всех уровнях цитокины испытывают влияние других представителей этого класса молекул. Наличие множественных перекрестных взаимодействий в системе цитокинов послужило причиной создания понятия «цитокиновая сеть». Цитокины — ключевые гуморальные факторы воспаления, необходимые для реализации защитных функций врожденного иммунитета. В развитии воспаления участвуют три группы цитокинов — воспалительные, или провоспалительные цитокины, хемокины, колониестимулирующие факторы, а также функционально связанные факторы IL-12 и IFNγ. Основная их роль — «организация» воспалительной реакции. Один из наиболее важных и ранних эффектов провоспалительных цитокинов — усиление экспрессии молекул адгезии на эндотелиальных клетках, а также на самих лейкоцитах, что приводит к миграции в очаг воспаления лейкоцитов из кровяного русла. Кроме того, цитокины индуцируют усиление кислородного метаболизма клеток, экспрессии ими рецепторов для цитокинов и других факторов воспаления, стимуляцию выработки цитокинов, бактерицидных пептидов и т.д. Провоспалительные цитокины оказывают преимущественно местное действие. Попадание избыточно секретируемых провоспалительных цитокинов в циркуляцию способствует проявлению системных эффектов воспаления, а также стимулирует выработку цитокинов клетками, отдаленными от очага воспаления. На системном уровне провоспалительные цитокины стимулируют продукцию белков острой фазы, вызывают повышение температуры тела, действуют на эндокринную и нервную системы, а в высоких дозах приводят к развитию патологических эффектов (плоть до шока, подобного септическому).
2.Дендритные клетки – это отросчатые ветвистые клетки, основные представители АПК. Морфологически это крупные клетки (15-20 мкм) с эксцентрически расположенным ядром и многочисленными отростками мембраны, имеют довольно большое количество митохондрий. Локализуются в лимфотических органах и барьерных тканях. ДК костномозгового происхождения делят на миелоидные (1 тип) и лимфоидные (2тип). Популяции ДК. 1) ДК образуются из кроветворных клеток-предшественников в ответ на действие ФНО-альфа, ИЛ-4, ГМ-КСФ. В ответ на действие ФНО-альфа образуются кл. Лангерганса (экспрессирует АГ CD1a+), она имеет гранулы Бирбека, возможно участвующими в захвате АГ. После захвата АГ в коже и в ответ на выделение цитокинов ФНО-альфа кл.Ланг. созревают и переносятся в Т-клеточную область лимфоузла, где активируют АГ-специфичные Т-лимфоциты. 2) Зрелые моноциты экспрессируют АГ (CD11c+,13+,33+14+,1c+) способны к дифференцировке в интерстициальные ДК в различных органах. Моноциты перемещаются сквозь эндотелий, где взаимод с адгезионными молекулами и хемотаксинами. Образовавшиеся ДК и интерстициальные ДК перемещаются в зарод.центры лимфоузлов, где активируют Т и В-клетки. 3) Так же существуют предшественники ДК 1 типа (Миелоидные ДК), которые экспрессируют миелоидные АГ CD13+, 11c+, 11c, BDCA3+. Происходят из общего миелоидного гемопоэтического предшественника. Локализованы в различных органах и тканях, где захватывают чужеродные антигены путем пино- и фагоцитоза, после чего экспрессируют антигенную детерминанту в комплексе с молекулами MHC II класса. В условиях in vitro на сигнал ИЛ-4, ГМ-КСФ и ФНО-альфа они превращаются в типичные ДК. Секретируют большое кол-во ИЛ-12. Специфическими маркерами миелоидных дендритных клеток крови являются молекулы BDCA-1 (CD1c) и BDCA-3 (CD141). 4) Некоторые одноядерные клетки крови реагируют на образование ИЛ-3, Flt3L давая начало предшественникам ДК-2(лимфоидные предш). Эти клетки — лимфоидного происхождения и морфологически напоминают плазматические клетки. pDCs экспрессируют TLR-9, лигандами которого являются CpG-олигонуклеотиды бактериальной ДНК. Эти клетки мигрируют паракортикальную область лимфоузла, входя в контакт с эндотелиальными венулами. В ответ на ИЛ-3 и на связывание CD40 они преобретают морфологические признаки ДК и секретируют альфа-ИФ и ИЛ-10. К маркерам плазмацитоидных дендритных клеток относят молекулы BDCA-2 (CD303), BDCA-4 (CD304). Жизненный цикл миелоидных ДК. Миелоидные ДК высоко мобильны. В коже представлены клетками Лангерганса и дермальными ДК. Захватив и переработав АГ, кл.Лангерганса перемещаются из базальных и супрабазальных слоев эпидермиса кожи по афферентным лимфатическим сосудам в виде вуалевидных клеток в парокортикальные тимусзависимые зоны лимфоузлов, где они становятся интердигитирующими (переплетенными отростками) клетками. Интердигитирующие клетки с помощью МНС презентируют АГ наивным Т-лимфоцитам. Такую же миграцию перетерпивают и другие лимфоидные клетки.
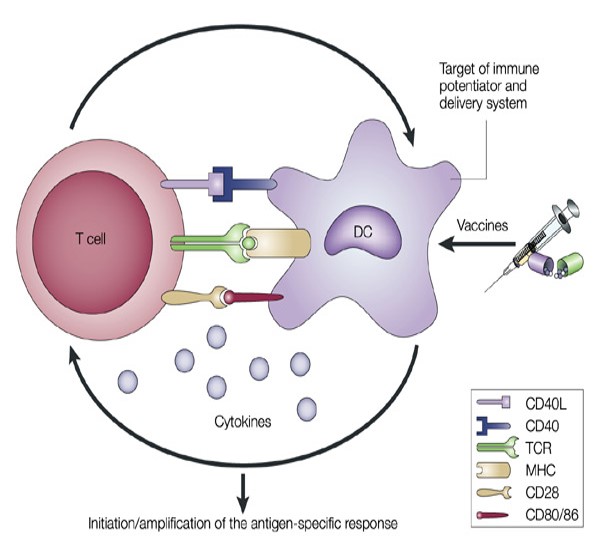
ДК некостномозгового происхождения (фолликулярные ДК) находятся в первичных и во вторичных фолликулах лимфоузлов, селезенки и лимфоидной ткани слизистых оболочек. Они несут поверхностные иммунные комплексы АГ-АТ(без поглащения) и презентируют АГ В-лимфоцитам с помощью Fc-рецептора для IgG и рецепторов к комплементу CR1(CD25) и CR2 (CD21), связанных с мембраной FDC. FDC не имеют молекул MHC 2 класса и не мигрируют из мест своего расположения, соединяясь отростками, они образуют стабильную сеть. Рекрутирование предшественников ДК и миграция ДК. Эпителий миндалин и пищеварительного канала секретирует хемокин MIP-3альфа, являющийся лигандом хемокинового рецептора CCR6 на незрелых ДК. Синтез MIP-3альфа индуцируется при восполительном процессе, он способствует хемотаксису незрелых ДК и клеток Лангерганса. При созревании ДК перестают экспрессировать CCR6, они избегают локального действия MIP-3альфа и обзаводятся хемотаксиновым рецептором CCR7. В результате зрелые ДК начинают реагировать на хемокины MIP-3бетта и SLC, которые выделяются и связываются лимфатическими сосудами, эндотелиальными клетками и стромальными клетками лимфоузлов. Под действием данного хемокинового градиента Т-клетки так же перемещаются в лимфатические узлы. В Т-зоне лимфоузла ДК могут взаимодействовать с АГ-специфичными Т-клетками. Собственные ДК лимфоузла сами производят ЫSLC и MIP-3-бетта, что способствует дополнительному рекрутированию Т-клеток и ДК, приводящему к усилению иммунного ответа. Молекулы, учавствующие во взаимодействии Т-клеток с ДК.Взаимодействие CD40 с лигандом CD40 провоцирует созревание ДК и синтез ими большого количества ИЛ-12. Взаимодействие CD28 и CD 80/86 оказывает стимулирующий эффект. Узнавание АГ Т-клеточным рецептором обеспечивает 1-ый сигнал активации Т-клеток. Второй сигнал подаётся при взаимодействии АГ CD28 c CD80(или 86) на АПК. АГ CTLA4 является наиболее высоко аффинным рец-ом для CD80(86). Он конкурирует с CD28и ингибирует развитие клеточного цикла. Этот неготивный сигнал, подаваемый CTLA-4, возможно, служит сигналом для прекращения активации Т-клеток с целью предотвращения слишком сильного им.ответа. После активации Т-клеток с участием TCR-комплекса привлекается манозный костимулятор ICOS, который может опосредовать мощную костимуляцию Т-клеток и способствовать их пролиферации. Последние исследования показывают что стимуляция с помощью ICOS может индуцировать дифференцировку и Тн1 и Тн2.
Билет 20 1.Лиганд - молекула, специфически взаимодействующая с участком определенной структуры другой молекулы. Связывание лиганда с рецептором обычно происходит при помощи сил межмолекулярного взаимодействия, таких, как ионные связи, водородные связи, силы Ван дер Ваальса. Селективные и неселективные лиганды. Бивалентные лиганды состоят из двух соединённых молекул, каждая из которых является лигандом для определённого подтипа рецепторов (одного и того же или разных), причём в силу особенностей пространственного строения обе части молекулы способны одновременно связываться с двумя частями «составного» гомо- или гетеродимерного рецепторного комплекса. Бивалентные лиганды используются в научных исследованиях с целью обнаружения и исследования рецепторных гомо- и гетеродимерных комплексов и изучения их свойств. TLR - рецепторы экспрессированы на поверхности и в цитоплазматических гранулах различных клеток организма. Больше всего экспрессируют миелоидные клетки (моноциты и макрофаги). Цитоплазматическая (C-концевая) часть рецептора представлена TIR-доменом, ответственным за взаимодействие с адаптерными молекулами сигнальных путей. TIR-домен состоит из центрального β-слоя , окруженного 5 α-спиралями. Число вариантов TLR у человека оно составляет 10.TLR: гомо и гетеродимеры. Внеклеточная часть состоит из лейцин богатых доменов, из них форми-ся лигандраспознающий и лигандсвязывающий части- LRR-домен. На внутр части 3,7,8,9- распознают нуклеиновые паттерны. Все остальные на ЦП.TLR 1,2,6 распознают паттерны, в состав которого входят липиды.4 распознает патт, в состав которого входит полисахарид. Сигналинг При связывании PAMP с мембранным TLR возникают конформационные изменения внеклеточной части рецептора,передающиеся на внутриклеточный домен TIR. В передаче активацион-ного сигнала от TIR-домена ТLR участвует несколько адапторных белков(MyD88, TIRAP, TRIF, TRAM), активирующих 2 основных сигнальных пути — MyD88-зависимый и TRIF-зависимый. MyD88-зависимый путьучаствует в передаче сигнала от всех ТLR, кроме TLR-3, использущегоTRIF-зависимый путь. Передача сигнала от TLR-4 происходит с участиемобоих сигнальных путей. MyD88 (при участии TIRAP) играет роль «мости-ка» между активным димером TLR и первой сигнальной киназой — серин-треониновой киназой IRAK-4. Активированная IRAK-4 запускает каскадреакций активации сигнальных ферментов: киназы IRAK-1, убиквитин-лигазы TRAF6 и киназы ТАК1. На этом этапе передача сигнала может идти по двум путям. Один из них — активация тирозинфосфатазы IKK. Активация IKK происходит также при поступлении сигналов от эндолизосомального TLR-3 при посредстве адапторного белка TRIF и киназы RIP1. Основная мишень IKK — IκB (ингибирующая цепь неактивного комплекса, содержащего транскрипционный фактор NF-κB). Фосфорилирование IκB вызывает ее связывание с убиквитином, после чего она подвергается расщеплению в протеасоме. Освобожденный от IκB комплекс содержит активный димер NF-κB, миг-рирущий в ядро и связывающийся с промоторными участками многих провоспалительных генов (цитокинов, молекул адгезии, бактерицидных пептидов, ферментов и т.д.). Таким образом достигается главная цель активации — превращение клеток в эффекторы, обеспечивающие развитие воспалительной реакции и реализацию защитных функций врожденного иммунитета. 2.Фагоцитоз -поглощение клеткой частиц размером более 0,5 мкм. выделяют 8 стадий фагоцитоза : приближение к объекту фагоцитоза в результате хемотаксиса; адгезия; активация мембраны; погружение; образование фагосомы; слияние фагосомы и лизосомы; киллинг и расщепление объектов фагоцитоза; выброс продуктов деградации. моноцитопоэз идет в костном мозге. Продукция моноцитов в костном мозге находится под контролем целой группы ростовых факторов: ИЛ-3 и колониестимулирующие факторы (ГМ-КСФ, M-КСФ) стимулируют митотическую активность предшественников моноцитов, а простагландин Е (ПГE) и интерфероны (IFN-α, IFN-β) ингибируют деление этих клеток. Образовавшиеся в костном мозге моноциты менее чем через сутки мигрируют в периферическую кровь. Часть из них остается в костном мозге, превращаясь в резидентные макрофаги костного мозга. В крови моноциты распределяются на пристеночный и циркулирующий пулы. В ткань – макрофаг. стволовая клетка; монобласт; промоноцит; моноцит костного мозга; моноцит периферической крови; тканевой макрофаг. Макрофаги локализуются в определённых участках лимфоидной ткани: медуллярных тяжах лимфатических узлов, красной и белой пульпы селезёнки. Клетки, производные моноцитов, присутствуют практически во всех нелимфоидных органах: клетки Купфера в печени, микроглия нервной системы, альвеолярные макрофаги, клетки Лангерганса кожи, остеокласты, макрофаги слизистых оболочек и серозных полостей, интерстициальной ткани сердца, поджелудочной железы, мезангиальные клетки почек (на рисунке не показаны). Макрофаги способствуют поддержанию гомеостаза, очищая организм от стареющих и апоптотических клеток, восстанавливая ткани после инфекции и травмы. Активация см TLR Сигнальные пути, запускаемые связыванием рецепторов для опсонинов
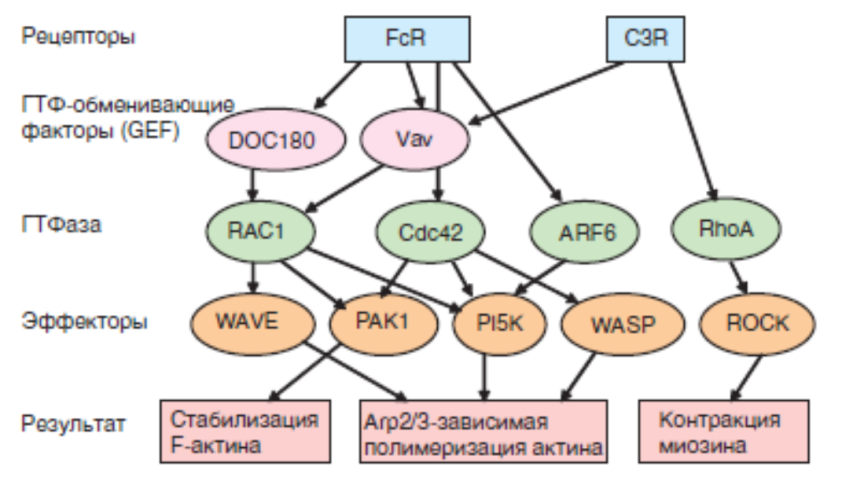
Распознавание мишеней фагоцитоза через различные мембранные рецепторы фагоцитов приводит к запуску процессов активации и к погружению и последующему разрушению частицы( Fc-рецепторов и рецепторы системы комплемента) Это приводит (за счет конформационных изменений) к активации прилежащих к цитоплазматической части рецепторовтирозинкиназ семейства Src. Эти киназы фосфорилируют цитоплазматические участки рецептора, в том числе остатки тирозина в мотиве ITAM, Далее активационная волна передается на ряд ферментов. На данном этапе наиболее важна активация двух ферментов: PI3K и PLC. Следующий этап активации направлен на образование продуктов, участвующих в полимеризации актина — процесс, на котором основан фагоцитоз. Для реализации этого этапа необходимо участие ГТФаз — Rac-1,Cdc42 (их активность преобладает при FcγR-зависимом фагоцитозе) и Rho (задействована преимущественно в комплемент-зависимом поглощении частицы). Таким образом, полимеризация актина в сочетании с погружением частиц составляет основу формирования фагоцитарной чаши — главного результата рассмотренных процессов и исходной позиции следующего этапа фагоцитоза. На мембране макрофагов экспрессированы различные рецепторы для захвата микроорганизмов: макрофагальный маннозный рецептор (ММR), scavenger-рецептор (MSR), рецепторы для бактериального липополисахарида (CD14). MMR опосредует захват многих микроорганизмов: Mycobacteria, Leishmania, Legionella, Pseudomonas aeruginosa и др. Через MSR идет эндоцитоз модифицированных липопротеинов при превращении макрофага в пенистую клетку. Через те же MSR мгут фагоцитироваться большинство бактерий как Грам-положительных, так и Грамотрицательных. Однако влияние бактериального липополисахарида (ЛПС) на макрофаги опосредовано специальным рецептором CD14. Экспрессия этого рецептора повышается на макрофагах при воспалении и иммунном ответе. Рецепторы для комплемента - CR3 (интегрин CD11b/CD18) и CR4 (интегрин CD11c/CD18). Помимо комплемента они связывают и ряд бактериальных продуктов: ЛПС, липофосфогликан Leishmania, гемагглютинин из филаментов Bordetella, поверхностные структуры дрожжевых клеток Candida и грибков Histoplasma. - CD64 - рецептор для Fc-фрагментов IgG - FcγRI (Fcy-рецептор первого типа), обеспечивающий фагоцитоз макрофагами иммунных комплексов. Сила связывания FcyRI с иммуноглобулинами различных изотипов убывает в ряду: IgG3 > IgG1 > IgG4 > CD40, B7, MHC-II - мембранные молекулы для контактов с комплементарными мембранными молекулами лимфоцитов, т.е. для непосредственных межклеточных взаимодействий. Кислороднезависимые механизмы внутриклеточной цитотоксичности фагоцита обеспечиваются действием лизосомальных ферментов, разрушающих объект фагоцитоза. 1. Лизоцим разрушает клеточную стенку бактерий. 2. Катионные белки повреждают бактериальную цитоплазматическую мембрану. 3. Рибонуклеаза разрушает РНК микроорганизмов. Дезоксирибонуклеаза разрушает ДНК микробов. 4. Лактоферрин активно связывает железо, необходимое для размножения бактерий. Б. Кислородзависимые механизмы внутриклеточной цитотоксичности фагоцита описываются как «респираторный взрыв» при активации НАДФ Н2 1. После поглощения объекта фагоцитоза у фагоцита возрастает потребность в кислороде, вследствие которой происходит интенсификация метаболизма О2. 2. В результате резко повышается синтез токсических кислородных продуктов, обладающих микробоцидной активностью (ведущий из них – синглетный кислород; кроме него к этой группе веществ относятся супероксидный радикал, перекись водорода и катализирующая ее токсическое воздействие на микроорганизмы миелопероксидаза, гидроксильный радикал, хлорноватистая кислота). Существует два вида фагоцитоза: завершенный и незавершенный. А. При завершенном фагоцитозе осуществляются все стадии, и объект фагоцитоза полностью уничтожается. Б. При незавершенном фагоцитозе отсутствует или не завершается полным уничтожением объекта фагоцитоза. Функции моноцитов - макрофагов (система фагоцитирующих мононуклеаров): фагоцитарная защита организма против микробной инфекции; токсический эффект метаболитов макрофагов на паразитов в организме человека; участие в иммунном ответе организма и воспалении; регенерация тканей и противоопухолевая защита; регуляция гемопоэза; фагоцитоз старых и поврежденных клеток крови, регуляция продукции острофазных белков печенью. Презентация анттигена TCR расспознает антигенную детерминанту(эпитоп), экпресс-ю на поверхности АПК вместе с молекулой MHC II класса.участвуют CD4. В результате взаимодействия АПК секрктируют IL1, стиму-е в Th синтез и секрецию цитокинов. Показаны CD40/CD40L и CD28/B7- участвуют в проведение костимулирующих сигналов, нужных для активации клеток. Моноцитопоэз идет в костном мозге. Продукция моноцитов в костном мозге находится под контролем целой группы ростовых факторов: ИЛ-3 и колониестимулирующие факторы (ГМ-КСФ, M-КСФ) стимулируют митотическую активность предшественников моноцитов, а простагландин Е (ПГE) и интерфероны (IFN-α, IFN-β) ингибируют деление этих клеток. Образовавшиеся в костном мозге моноциты менее чем через сутки мигрируют в периферическую кровь. Часть из них остается в костном мозге, превращаясь в резидентные макрофаги костного мозга. В крови моноциты распределяются на пристеночный и циркулирующий пулы. В ткань – макрофаг. стволовая клетка; монобласт; промоноцит; моноцит костного мозга; моноцит периферической крови; тканевой макрофаг . Макрофаги локализуются в определённых участках лимфоидной ткани: медуллярных тяжах лимфатических узлов, красной и белой пульпы селезёнки. Клетки, производные моноцитов, присутствуют практически во всех нелимфоидных органах: клетки Купфера в печени, микроглия нервной системы, альвеолярные макрофаги, клетки Лангерганса кожи, остеокласты, макрофаги слизистых оболочек и серозных полостей, интерстициальной ткани сердца, поджелудочной железы, мезангиальные клетки почек (на рисунке не показаны). Макрофаги способствуют поддержанию гомеостаза, очищая организм от стареющих и апоптотических клеток, восстанавливая ткани после инфекции и травмы. Презентация анттигена TCR расспознает антигенную детерминанту(эпитоп), экпресс-ю на поверхности АПК вместе с молекулой MHC II класса.участвуют CD4. В результате взаимодействия АПК секрктируют IL1, стиму-е в Th синтез и секрецию цитокинов. Показаны CD40/CD40L и CD28/B7- участвуют в проведение костимулирующих сигналов, нужных для активации клеток. Фагоцитоз -поглощение клеткой частиц размером более 0,5 мкм. выделяют 8 стадий фагоцитоза : приближение к объекту фагоцитоза в результате хемотаксиса; адгезия; активация мембраны; погружение; образование фагосомы; слияние фагосомы и лизосомы; киллинг и расщепление объектов фагоцитоза; выброс продуктов деградации Распознавание мишеней фагоцитоза через различные мембранные рецепторы фагоцитов приводит к запуску процессов активации и к погружению и последующему разрушению частицы( Fc-рецепторов и рецепторы системы комплемента) Это приводит (за счет конформационных изменений) к активации прилежащих к цитоплазматической части рецепторовтирозинкиназ семейства Src. Эти киназы фосфорилируют цитоплазматические участки рецептора, в том числе остатки тирозина в мотиве ITAM, Далее активационная волна передается на ряд ферментов. На данном этапе наиболее важна активация двух ферментов: PI3K и PLC. Следующий этап активации направлен на образование продуктов, участвующих в полимеризации актина — процесс, на котором основан фагоцитоз. Для реализации этого этапа необходимо участие ГТФаз — Rac-1,Cdc42 (их активность преобладает при FcγR-зависимом фагоцитозе) и Rho (задействована преимущественно в комплемент-зависимом поглощении частицы). На мембране макрофагов экспрессированы различные рецепторы для захвата микроорганизмов: макрофагальный маннозный рецептор (ММR), scavenger-рецептор (MSR), рецепторы для бактериального липополисахарида (CD14). MMR опосредует захват многих микроорганизмов: Mycobacteria, Leishmania, Legionella, Pseudomonas aeruginosa и др. Через MSR идет эндоцитоз модифицированных липопротеинов при превращении макрофага в пенистую клетку. Через те же MSR мгут фагоцитироваться большинство бактерий как Грам-положительных, так и Грамотрицательных. Однако влияние бактериального липополисахарида (ЛПС) на макрофаги опосредовано специальным рецептором CD14. Экспрессия этого рецептора повышается на макрофагах при воспалении и иммунном ответе. Рецепторы для комплемента - CR3 (интегрин CD11b/CD18) и CR4 (интегрин CD11c/CD18). Помимо комплемента они связывают и ряд бактериальных продуктов: ЛПС, липофосфогликан Leishmania, гемагглютинин из филаментов Bordetella, поверхностные структуры дрожжевых клеток Candida и грибков Histoplasma. - CD64 - рецептор для Fc-фрагментов IgG - FcγRI (Fcy-рецептор первого типа), обеспечивающий фагоцитоз макрофагами иммунных комплексов. Сила связывания FcyRI с иммуноглобулинами различных изотипов убывает в ряду: IgG3 > IgG1 > IgG4 > CD40, B7, MHC-II - мембранные молекулы для контактов с комплементарными мембранными молекулами лимфоцитов, т.е. для непосредственных межклеточных взаимодействий. Кислороднезависимые механизмы внутриклеточной цитотоксичности фагоцита обеспечиваются действием лизосомальных ферментов, разрушающих объект фагоцитоза. 1. Лизоцим разрушает клеточную стенку бактерий. 2. Катионные белки повреждают бактериальную цитоплазматическую мембрану. 3. Рибонуклеаза разрушает РНК микроорганизмов. Дезоксирибонуклеаза разрушает ДНК микробов. 4. Лактоферрин активно связывает железо, необходимое для размножения бактерий. Б. Кислородзависимые механизмы внутриклеточной цитотоксичности фагоцита описываются как «респираторный взрыв» при активации НАДФ Н2 1. После поглощения объекта фагоцитоза у фагоцита возрастает потребность в кислороде, вследствие которой происходит интенсификация метаболизма О2. 2. В результате резко повышается синтез токсических кислородных продуктов, обладающих микробоцидной активностью (ведущий из них – синглетный кислород; кроме него к этой группе веществ относятся супероксидный радикал, перекись водорода и катализирующая ее токсическое воздействие на микроорганизмы миелопероксидаза, гидроксильный радикал, хлорноватистая кислота). Функции моноцитов - макрофагов (система фагоцитирующих мононуклеаров): фагоцитарная защита организма против микробной инфекции; токсический эффект метаболитов макрофагов на паразитов в организме человека; участие в иммунном ответе организма и воспалении; регенерация тканей и противоопухолевая защита; регуляция гемопоэза; фагоцитоз старых и поврежденных клеток крови, регуляция продукции острофазных белков печенью.
Билет 21 1. Теория врожденного иммунитета.Теория паттерн распознования – второй закон иммунологии. Суть – в процессе эволюции микроорганизмы любого происхождения сформировали индивидуальные поверхностные защитные структуры, утрата которых приводит к гибели организма от воздействия факторов окр. ср. Эти структуры являются общими для крупных таксонов микроорганизмов. Таким образом, распознавая эти поверхностные структуры мы можм идентифицировать этот таксон микроорганизма. Например, наличие в клеточной стенке тейхоевых кслот характерно для грамм+, хитин для грибов. Данная теория была предложена Ч. Дженеуэем и Р. Меджитовым. Эти поверхностные структуры называются патогенассоциированные паттерны. Они обладают следующими свойствами: 1. Эволюционно консервативен (не меняется в ходе эволюции). Если организм откажется от этой структуры он погибнет. 2. Общий для большого таксона микроорганизмов. 3. Такой структуры не должно быть в организме хозяина. Патогенассоциированный паттерн наша имм.сис. распознает паттерн – распознающими рецепторами. Патогенраспознающие рецепторы: 1. Находящиеся на поверхности мембран § Цитоплазматические § На всех внутр. Мембранах клетки 2. Находящиеся в цитоплазме каждой клетки и во всех жидких средах организма. 3. Секретируемые. Группы рецепторов: 1. TLR – универсальная группа рецепторов.Нах. на внутр. И наружной поверхностях мембран.Распознают паттерны белков, углеводов, жиров, нуклеин.кислот. 2. Scavenger рецепторы (рецепторы мусорщики) – распознают липидные паттерны в чистом виде или в связанном. 3. Лектиновые рецепторы – распознают паттерн, в состав которых входит сахар в чистом виде или в комплексе. TLR рецепторы всегда состоят из 2 субъединиц и делятся на гомодимеры (состоят их 2 одинаковых) и гетеродимеры (их 2 разных субъединиц). По строению их наружная часть состоит из лейцинбогатых доменов (из них формируются лигандраспозн. И связывающ. Части) и цитоплазматического домена (TIR домен). TLR 3, 7, 9 – рецепторы на внутренней мембране. Они распознают нуклеиновый паттерн (бактерии и вирусы). Гетерорецепторы 1, 2, 6 распознают паттерн, в состав которых входят липиды в чистом виде или в комплексе. TLR 4 – распозн. Липополисахариды TLR 5 – только белки, из которых состоят жгутики и реснички TLR11 – белки, характерные для клеточной стенки грибов. TLR находятся на всех клетках миелоцитарного и лимфоцитарного ряда. Но оснащены ими все клетки по – разному. Все TLR имеет макрофаг ДК миелоцит. Происхождения. Несколько меньше у В – лимфоцитов. Еше меньше у нейтрофилов. И совсем немного у Т – лимфоцитов. Сигналинг от TLR осуществл. С помощью древней системы каскадов в несколько этапов: взаимодействие контактных поверхностей групп адаптерных белков TIR и TRAF домена и MyD88. Это приводит к образованию docing сайта для IRAK киназы (сериновая протеинкиназа), которые аутофосфорилируют друг друга. IRAK киназы фосфорилируют киназу ингибитора NFкаппа –b. TLR – самое сильное активирующее семейство Scavenger рецепторы – только мембранные (тип А и В). Тип А – три полипепт.цепи, переплет. Как α – спирали между собой. Каждая заканчивается лиганд связывающим доменом. Тип В – состоит из одной полипептидной цепи, закрепленной по концам в цитоплазматической мембране. Распознают патогенассоциированые паттерны липидной природы, распознают и связывают апоптот. Тельца и спосбствуют их удалению. Участвую в процессах клеточной адгезии. Сигналинг от тих рецепторов осуществляется через Ras белок. Лектиновые рецепторы –самая большая группа (около 6о видов). Лектиновые могут быть мембранные и растворимые. Распознают остатки сахаров. Главная часть их структуры – углеводраспознающий домен в виде букета тюльпанов. Наиболее важные лектиновые рецепторы на цитоплазме мембраны: § Дектиновые – состоят из1 субъединицы и цитоплазмат. Домена на внутренней части (здесь находится ITAM последовательность) и на внешней части – углеводраспознающий домен. § Пентраксены – растворимые (синтетич. И секретир. Иммунными клетками). Находятся в жидкой среде. Состоят из 5 углеводраспоз. доменов. (СРБ, сывороточный амилоидный протеин). Механизм действия углеводраспознающих паттернов – запуск лектинового пути активации комплемента. § Сурфактантные белки – находятся в сурфактантной жидкости легких. Их активация приводит к запуску лектинового пути системы комплемента. § Маннансвязывающий лектин – состоит из 5 или 8 углеводраспознающих доменов и запускает систему комплемента по лектиновому пути.
2. CD4 – Т – лимфоциты. Т-лимфоциты — единственные клетки крови, развитие которых не может осуществляться в микроокружении костного мозга — основные этапы дифференцировки они проходят в специальном органе - тимусе. Тимус содержит эпителиальные клетки, отсутствующие в костном мозгу. Они и являются тем уникальным и ключевым фактором микроокружения, который способен обеспечить развитие Т-лимфоцитов. Из кроветворных органов в тимус мигрируют ранние лимфоидные предшественники ELP (от Earlylymphoidprogenitors) — клетки с широким потенциалом дифференцировки, включая миелоидный путь.ELP попадают в тимус через венулы кортикомедуллярного сочленения тимуса, откуда они мигрируют в наружные слои коры. Затем начинается их возвратное движение в сторону кортикомедуллярного сочленения. В ходе этих перемещений происходит созревание Т-клеток. Уже на 1-м этапе (движение в сторону коры) клетки последовательно утрачивают способность дифференцироваться в В-лимфоциты, миелоидные клетки, естественные киллеры и дендритные клетки. Вероятно, на этом этапе внутри тимуса от клеток-предшественнков Т-линии ответвляются предшественники перечисленных «не-Т-клеток». На этом отрезке миграции проходят первые этапы развития самих Т-лимфоцитов. Для маркирования стадий развития Т-лимфоцитов чаще используют экспрессию на их поверхности корецепторов CD4 и CD8, а также рецепторного комплекса CD3—TCR. Наиболее ранние представители Т-клеточного ряда имеют фенотип CD4-CD8-, в связи с чем их называют дважды отрицательными или дважды негативными (DN — от Doublenegative) клетками. Поскольку они лишены также CD3, эти клетки иногда называют трижды негативными клетками. Более зрелая популяция αβ-тимоцитов экспрессирует оба корецептора и обозначается как дважды положительные клетки — CD4+CD8+ (дважды позитивные, DP — от Doublepositive). Они уже экспрессируют на своей поверхности (как правило, слабо) CD3. Наконец, зрелые тимоциты, как и периферические Т-клетки, экспрессируют один из корецепторов и поэтому их называют моноположительными клетками (SP — от Single-positive). Фенотип CD4+CD8- характерен для Т-хелперов и регуляторных Т-клеток, а CD4-CD8+ — для цитотоксических Т-лимфоцитов. Основные события при Т-лимфопоэзе — перестройка рецепторных V-генов и формирование TCR с последующей селекцией клонов Т-лимфоцитов, обеспечивающей формирование антигенраспознающего репертуара. Перестройка V-генов TCR и другие события, приводящие к экспрессии рецептора, происходят на стадии дважды отрицательных тимоцитов в поверхностных слоях коры тимуса. В процессе перестройки V генов TCR клетка должна решить вопрос о формировании TCR в сторону αβ – типа или γδ – типа. К концу фазы дважды отрицательных тимоциты приобретают фенотип СD44-СD25+. На заключительном этапе фазы DN3 на клетках экспрессируется корецептор СD4 (стадия ISP — от Immaturesingle-positive, т.е. незрелых моноположительных тимоцитов). Селекция тимоцитов и формирование субпопуляций CD4+ и CD8+ клеток. Положительная селекция. Дважды положительные клетки очень чувствительны к апоптозу (в связи с низкой экспрессией ими антиапоптотических факторов, таких, как Bcl-2 и Bcl-XL). Положительная селекция обеспечивает отбор только тех тимоцитов, которые экспрессируют TCR, обладающие сродством к молекулам MHC. Положительной селекции подвергаются дважды положительные тимоциты фенотипа CD4+ CD8+. В качестве «отбирающего фактора» выступают кортикальные эпителиальные клетки, экспрессирующие цитокератин СК8 и молекулы MHC обоих классов, но лишенные костимулирующих молекул. Тимоциты, перемещаясь от периферии коры к кортикомедуллярной зоне, тесно контактируют с эпителиальным ретикулумом, образующим трехмерный каркас тимуса. При этих механических контактах TCR тимоцитов взаимодействуют с экспрессированными на поверхности эпителиальных клеток молекулами MHC как I, так и II классов, содержащими фрагменты различных эндогенных молекул. Если TCR обладает сродством к молекуле MHC, тимоцит получает поддерживающий сигнал, основными результатами которого служат повышение экспрессии антиапоптотического фактора Bcl2и продвижение тимоцита по клеточному циклу. Внешний признак успешного прохождения тимоцитом положительной селекции — экспрессия маркера активации клетки CD69. Т-лимфоциты, рецепторы которых лишены сродства к МНС, подвергаются апоптозу «по умолчанию», т.е. не в силу сигнала извне, передаваемого через мембранные рецепторы, а вследствие срабатывания внутренних (митохондриальных) механизмов. Поскольку сродством к молекулам MHC обладают TCR лишь незначительной части клонов образующихся тимоцитов, на этапе положительной селекции погибает 90% CD4+ CD8+ тимоцитов. Отрицательная селекция Тимоциты, прошедшие положительную селекцию, мигрируют в кортикомедуллярное сочленение и в мозговой слой тимуса, где они проходят следующий этап отбора — отрицательную селекцию. На этом этапе тимоциты представлены дважды положительными клетками фенотипа СD4+/CD8+. Отрицательную селекцию осуществляют медуллярные дендритные и эпителиальные клетки. Те и другие клетки экспрессируют молекулы MHC обоих классов и костимулирующие молекулы CD80, CD86, CD40). На этом этапе происходит дискриминация тимоцитов по степени сродства к комплексу MHC—пептид. Клетки, обладающие высоким сродством, подвергаются апоптозу как потенциально опасные (поскольку они хорошо распознают пептидные фрагменты аутологичных белков в составе аутологичных молекул MHC, они могут индуцировать аутоиммунные реакции). В результате жизнеспособность сохраняют только тимоциты, рецепторы которых обладают умеренным (промежуточным) сродством к аутологичным комплексам MHC—пептид. Именно такие клетки мигрируют в периферический отдел иммунной системы и участвуют в развитии иммунного ответа и реализации антигенспецифической иммунной защиты. На этапе отрицательной селекции гибнет почти 50% тимоцитов, прошедших положительную селекцию (около 5% от числа незрелых дважды положительных тимоцитов). Однако в действительности достаточно много аутоспецифических Т-клеток не элиминируется в процессе отрицательной селекции и пополняет пул зрелых Т-лимфоцитов, создавая угрозу аутоагрессии. Дифференцировка CD4+ и CD8 тимоцитов Одновременно с селекцией тимоцитов происходит разделение их на субпопуляции, основанное на избирательной экспрессии корецепторов CD4 или CD8. Дифференцировка Т-клеток регулируется как внутренними (дифференцировочные факторы), так и внешними (сигналы, генерируемые при контактах между клетками) стимулами. Установлено, что на CD4+CD8+ клетках в определенный момент ослабляется экспрессия корецептора CD8. Если TCR специфичен к MHC-II, как и доминирующий корецетор (CD4), то в клетке генерируется сильный сигнал, и она переходит на стадию CD4+CD8-. Если TCR обладает более высоким сродством к комплексупептид-МНС-I, т.е. специфичность TCR и CD4 не совпадает, формируется слабый сигнал. Это приводит к усилению экспрессии CD8 и утрате CD4, т.е. к развитию CD4-CD8+ Т-клеток. CD8+ T-клетки (Т-киллеры) приобретают способность формировать цитолитический молекулярный комплекс, что обеспечивает функционирование такой Т-клетки в качестве цитотоксического Т-лимфоцита. В CD4+ T-лимфоцитах (Т-хелперах) формируются внутриклеточные механизмы, необходимые для выполнения «хелперной» функции, прежде всего — способность активно вырабатывать цитокины при активации. В результате Т-клетки дифференцируются в функционально полноценные субпопуляции цитотоксических и хелперных Т-лимфоцитов. В ходе иммунного ответа CD4+ Т-клетки дифференцируются в нескольких направлениях, в результате чего выделяют субпопуляции CD4+ Т – лимфоцитов: Th1, Th2,Th17 и регуляторные Т – лимфоциты. На этапе активации CD4+ Т-клетки обозначаются как Th0-клетки. Ранее других образуются 2 субпопуляции Т-хелперов — Th1 и Th2 (Th — от T-helper). При дифференцировке Т-хелперов происходит супрессия одних и усиление экспрессии других цитокиновых генов, прежде слабо экспрессированных в Th0-клетках. Th1-клетки продуцируют IFNγ, IL-2, TNFα, TNFβ, IL-3, GM-CSF, Th2-клетки — IL-4, IL-13, IL-5, IL-6, IL-9, IL-11, IL-21, IL-25, IL-10, IL-3, GM-CSF.К настоящему времени установлено, что основным индуктором Th1-клеток служит IL-12. Развитию и поддержанию Th1-ответа способствуют также IFNγ, IL-18, IL-23 и IL-27.. Цитокином, определяющим развитие Th2-клеток, служит только IL-4. Основной источник цитокинов, обеспечивающих дифференцировку Th1-лимфоцитов, — дендритные клетки. Они выделяют IL-12 уже при первом контакте с CD4+ Т-клетками. При взаимодействии с активированными Тh0-лимфоцитами дендритные клетки секретируют весь набор цитокинов, необходимых для развития Th1-клеток. Для Th2-клеток выработка цитокинов в той или иной степени свойственна тучным клеткам, NK-, NKT-клеткам, эозинофилам, базофилам, но четко не показано, в какой степени она реализуется при иммунном ответе. Помимо свойств цитокинов, вырабатываемых Th1- и Th2-клетками, их функция зависит от прямых контактных взаимодействий с клетками-мишенями, выступающими в качестве исполнителей эффекторных функций при иммунном ответе. Для Th1-клеток такими мишенями служат макрофаги, для Th2-клеток — В-лимфоциты. Th1 в итоге обеспечивают реакции Т-клеточного иммунитета – стимулируют иммунный ответ против внутриклеточных бактерий, противовирусный, противоопухолевый, трансплантационный иммунитет. Th2 стимулируют синтез антител, способствуют развитию гуморального иммунного ответа против внеклеточных бактерий, их токсинов, а также образование IgE-антител. Субпопуляция Th17-лимфоцитов, названных так по их ключевому цитокину IL-17, дифференцируется из активированных CD4+ клеток независимо от Th1- и Th2-лимфоцитов. Их развитие направляют другие цитокины — IL-6, TGFβ, IL-23. Цитокины, секретируемые Th1- и Th2-клетками, подавляют равитие Th17-лимфоцитов. Основным дифференцировочным (транскрипционным) фактором, ответственным заразвитие Th17-клеток человека — ROR-C. Эти клетки секретируют IL-21, IL-22 и 2 цитокина семейства IL-17 — IL-17A и IL-17F. Th17 - клетки способны привлекать и активировать нейтрофилы. Это свойство Th17-клеток обусловлено IL-22: он усиливает выработку G-CSF, стимулирующего образование нейтрофилов. Мобилизуя нейтрофилы, Th17-клетки участвуют в защите от грамотрицательных бактерий и в то же время могут способствовать повреждению тканей при хроническом воспалении. Для участия в аутоиммунных процессах необходима присущая Th17-клеткам провоспалительная активность, проявляемая в поддержании хронического, но не острого воспаления, развитие которого ThH-клетки скорее подавляют. Некоторые CD4+ Т-клетки, экспрессирующие внутриклеточный фактор FOXP3 и мембранные молекулы CD25 и CTLA-4 (CD152), образуют самостоятельную субпопуляцию естественных регуляторных Т-клеток (Т). Их основная функция — предотвращение реакции других Т-клеток на аутоантигены, а также ограничение (супрессия) любых форм иммунного ответа. Выделяют еще адаптивные Т – регуляторные клетки: Trl-клетки, продуцирующие ИЛ-10, развиваются из наивных CD4+ Т-лимфоцитов в ответ на активацию через TCR и CD28 при участии ИЛ-10 и ИФН-α.Trl-клетки играют ключевую роль в периферической толерантности на пищевые антигены и антигены комменсалов. При участии Trl-лимфоцитов ограничивается повреждение тканей в процессе воспалительного ответа на патогенны. Тh3-клетки супрессируют преимущественно функцию Thl и соответственнно развитие Thl- воспалительного ответа. Билет 22 1. МНС (MajorHistocompatibilityComplex)– главный комплекс гистосовместимости – система генов, кодирующих антигены, определяющих функционирование иммунной системы. HLA (HumanLeucocyteAntigen) –главный комплекс гистосовместимости человека. Природная функция белков MHC - представление пептидных Аг T-лимфоцитам. Характеристика MHC: Гены комплекса MHC (в отличие от генов TCR и Ig) не подвергаются рекомбинации. Механизм их приспособления к вариабельности (неограниченному множеству потенциальных АГ) заключается в их генетическом полиморфизме, полигенности и кодоминантном типе наследования. Полиморфизм: существование большого количества различных специфичностей HLA-генов в пределах каждого локуса. Гены отличаются между собой по нуклеотидным последовательностям, входящим в вариабельный участок ДНК. Полигенность:наличие нескольких неаллельных близкосцепленных генов, белковые продукты которых сходны в структурном отношении и выполняют идентичные функции. Кодоминантность:одновременно экспрессируются гены материнской и отцовской хромосом. |
||
|
Последнее изменение этой страницы: 2018-05-30; просмотров: 310. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |