
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Обсуждение результатов исследования3.1 Ингибиторный анализ токсических соединений Во многих сферах деятельности человека возникает необходимость анализа и контроля содержания токсических соединений в различных объектах. В частности, решение таких задач важно для обнаружения боевых отравляющих веществ, в производстве для соблюдения техники безопасности и промсанитарии, при контроле атмосферы промзоны и т.д. В последние годы появилась глобальная задача контроля состояния и ООС, существенные изменения которой связаны с все ускоряющейся индустриальной деятельностью человека. В связи с этим в нашей стране принят ряд законодательных актов и систематически проводится работа по повышению качества компонентов ОС, прежде всего атмосферы и гидросферы, и совершенствованию методов ее контроля. В области биологического и химического контроля состояния ОС существует две основные задачи. Первая состоит в обнаружении загрязнений ОС, которые отрицательно влияют на биосферу. Однозначным тестом на такое загрязнение является патологическое ее воздействие на биоорганизм. Чаще всего только в случае обнаружения такого влияния целесообразно решение более сложной задачи - определение химической природы соединений, вызывающих патологическое воздействие (идентификация токсических соединений), и источников загрязнения ОС. Решение этой задачи предусматривает наличие суммы аналитических методов обнаружения большого числа токсических ингредиентов [130]. В настоящее время наметилось отставание в решении первой задачи при относительно быстром возрастании числа индивидуальных токсических ингредиентов, поддающихся аналитическому контролю. Такое положение соответствует сложившейся системе оценки качества атмосферного воздуха и вод, основным и единственным критерием которого является предельно допустимые концентрации (ПДК) индивидуальных веществ и их комбинаций [130].  Такое узкое понимание проблемы контроля ОС, подразумевающее, что разработка аналитических методов обнаружения официально утвержденных токсических компонентов автоматически снимает с повестки дня первую задачу, в настоящее время в корне не верно. Во-первых, разработка, тем более техническая реализация методов обнаружения всей гаммы токсических ингредиентов, требует чрезвычайно больших затрат. Учитывая, что список токсических компонентов постоянно пополняется, а интенсивная индустриальная деятельность человека приводит к появлению в ОС все новых и новых компонентов, следует признать, что развитие только этого направления не способно угнаться за требованиями в области ООС. Это относится в полной мере и к вновь создаваемым потенциальным противником боевым отравляющим веществам с неизвестной для нас структурой и физико-химическими свойствами. Следует также отметить, что решение чисто аналитической задачи по отдельным компонентам и даже их комбинациям не позволяет однозначно предсказать интегральное токсическое воздействие на биосферу. К тому же экономически нецелесообразно постоянно привлекать весь дорогостоящий арсенал аналитической химии по всем точкам контроля без предварительного теста на общую токсичность. В связи с вышесказанным очевидна необходимость быстрейшего решения задачи создания технически совершенных тестов обнаружения общей токсичности различных объектов окружающей среды, которые в отличие от чисто биологических методов отличались бы быстротой и высоким уровнем автоматизации. В связи с этим следует обратить внимание на возможности ингибиторного ферментативного метода анализа для обнаружения токсических соединений различного происхождения в ОС и проведении комплексной экологической экспертизы. Учитывая механизм воздействия токсических соединений на биологические объекты, в большинстве случаев связанные с ингибированием метаболитических превращений в клетках, контролируемых ферментами [131], можно прийти к выводу о целесообразности в качестве аналитического сигнала при определении различных токсичных соединений использовать ингибирующее действие этих соединений на ферментативные системы. Используя ключевые ферменты, контролирующие важнейшие метаболитические пути, можно создать физико-химический анализатор для количественного дифференциального и интегрального определения различных типов ядов, токсичных веществ и их смесей. В конечном счете, используя мультиферментные системы, катализирующие широкий набор параллельно и последовательно идущих реакций, можно разработать автоматический анализатор, достаточно точно моделирующий суммарное воздействие загрязнений атмосферного воздуха или воды на биологические объекты и тем самым дающий результат определения токсичности, однозначно коррелирующийся с воздействием на биосферу. Преимуществом такого анализатора является возможность его использования в едином аппаратурном оформлении для анализа широкого набора индивидуальных токсических веществ и выполнения общей экологической экспертизы, для чего потребуется только замена используемых реагентов. По своей сути предлагаемый метод определения токсических веществ и общей токсичности относится к кинетическим методам количественного анализа с использованием катализаторов, являющимся относительно новой областью аналитической химии [132,133]. Функционирование ферментативного анализатора в режиме непрерывной подачи ингибитора. Блок-схема ферментативного проточного анализатора токсичности приводится на рис.6. Возрастание продукта реакции в растворе, вследствие протекания ферментативного процесса, регистрируется потенциометром (6). При определении продукта реакций фоновая линия совпадает с осью на диаграмме рис.7. Вид кривой на диаграмме можно объяснить тем, что в результате ферментативной реакции, протекающей в капиллярном реакторе, происходит превращение субстрата, вследствие чего на выходе из реактора фоновая концентрация
Рисунок 6 -Схема проточного ферментативного анализатора. 1 - капилляры для подачи фермента (Е), субстрата (S), ингибитора (i), 2- перистальтический насос, 3- смеситель, 4- термостатируемый реактор, 5- детектор, 6- потенциометр
Рассмотрим теорию функционирования вышеописанного анализатора. Подробный обзор современного состояния теории функционирования проточных, в том числе и аналитических, ферментативных реакторов представлен в работе [134]. В то же время следует отметить, что теории проточного ингибиторного анализа нами в литературе не обнаружено.
Рисунок 7 - Диаграмма регистрации продукта ферментативной реакции при непрерывной (а)и импульсной (б) подаче ингибитора (i)
Согласно [134] концентрированное поле субстрата в проточном реакторе с учетом продольной дисперсии описывается уравнением:
где: Cs = [S] концентрация субстрата, t – время, U-линейная скорость потока, X - расстояние вдоль реактора,Ds - эффективный коэффициент диффузии, характеризующий продольное размывание, r - объемная скорость реакции. При описании непрерывных динамических методов анализа, в которых реагенты и анализируемый раствор непрерывно подаются в проточный реактор, в случае, когда концентрация анализируемого компонента меняется плавно, можно пренебречь продольным размыванием и использовать вместо (1) уравнение:
В случае стационарного состояния, которое имеет место при смешении потоков постоянного состава, справедливо более простое уравнение:
В предельном случае субстрат и продукт реакции движутся совместно с линейной скоростью потока без размывания и время пребывания всех компонентов реакционной смеси одинаково и равно:
где: L - длина трубчатого реактора. Что касается концентраций субстрата и продукта на выходе из реактора, определяющих чувствительность метода, то они равны концентрациям, которые имеют место при проведении процесса в статических условиях с перемешиванием, U-линейная скорость потока. При этом проточный реактор выполняет роль транспортера реакционной смеси и устройства, задающего время инкубации, равное t*. Следовательно, в этом случае теория аналитического сигнала может базироваться на кинетике ферментативного процесса без учета динамических эффектов.
3.2 Исследование электроферментативного анализатора токсичности, включающего предреактор Проточный анализатор с предреактором был использован при разработке макетной установки, представленной на рис. 8.
Рисунок 8 - Схема проточного электроферментативного анализатора токсичности,включающего предреактор 1 - перистальтический насос, 2 - цредреактор, 3 - дозатор, 4 - реактор, 5 - электрохимический проточный детектор, 6 - универсальный полярограф
Перистальтическим насосом (1) в термостируемый фторопластовый предреактор (2) подавали буферный раствор (БР), ацетилхолинэстеразу (Е), дозатором (3) вводили модельный ингибитор прозерин в количестве от 10 до 50 мкл. Время нахождения фермента с ингибитором в предреакторе составляло около 5-6 мин. После прохождения предреактора смесь поступала в реактор (4), где и происходило ее смещение с раствором ацетилхолинйодида (S). Регистрацию тиохолинйодида осуществляли в электрохимическом детекторе при потенциале 0,4 В (н.к.э.), типичный профиль кривой при записи работы анализатора приводится на рис. 9.
Рисунок 9 - Характер записи аналитического сигнала при определенииконцентрации прозерина: 1-1∙10-3и 2-1∙10-4 мг/мл
Перед введением в предреакторхолинэстеразы предварительно производили запись сигнала тока, связанного с окислением тиохолинйодида, образующегося в результате самопроизвольного гидролиза ацетилтиохолинйодида в процессе хранения субстрата. При введении в предреактор фермента по истечении примерно 10 мин начиналось формирование фоновой линии Рф. Столько же времени было необходимо для проявления сигнала тока, указывающего на действие ингибитора, вызывающего инактивацию биокатализатора в аналитической системе. На рис.9 приводится запись регистрации прозерина с концентрациями 10-3 и 10-4 мг/мл. Получено, что с уменьшением на порядок количества введенного прозерина величина аналитического сигнала падает в 4 раза. Полный вывод пробы ингибитора из реакторов анализатора завершается по истечении 5 мин. Учитывая, что полный промежуток времени, необходимый для анализа пробы, составляет 15 мин, можно заключить, что образец ингибитора размывается в реакторах аналитической системы на 1/3 их суммарной длины. Следует обратить внимание на дрейф исходной фоновой линии (Рф), вызванной, вероятно, пассивацией платинового электрода, частичной инактивацией исходного раствора фермента, сорбцией фермента на стенках капиллярных реакторов. В связи с последним проводились исследования изменения аналитического сигнала во времени при регистрации тиохолинйодида на платиновом электроде (рис.10). Наиболее значительный дрейф фоновой линии наблюдался в течение 2-3 часов непрерывной эксплуатации датчика, а уже затем происходила относительная стабилизация аналитического сигнала. Кроме того, последний зависел от температуры проведения анализа: при 4 °С за пять часов работы анализатора сигнал тока уменьшался лишь на 23 %, тогда как при 20 °С - на 46 % относительно исходного фонового сигнала тока. Надо отметить, что температура существенно влияет и на работу электроферментативного анализатора токсичности. Получены данные определения прозерина с концентрацией 10-4 мг/мл при 25 и 37 °С. При 37°С аналитический сигнал возрастал на 44 % относительно его величины при 25 °С.
Рисунок 10 - Кинетическая зависимость изменения аналитического сигнала при регистрации тиохолинйодида на платиновом электроде (1-4 °С и 2-20 °С) Условия эксперимента: CE = 1,0 мг/мл, Сs=1,44∙10-3 моль/л, время ферментативной реакции 3,5 мин.
При оптимизации работы анализатора в зависимости от концентрации ацетилхолинэстеразы было получено, что в условиях анализа, приведенных в подписи к рис.9, следует использовать АХЭ с концентрацией 2∙10-2 мг/мл и с удельной активностью 2 Е/мг.
Рисунок 11 - Зависимость сигнала тока от длины предреактора при определении:1 - хлорофоса (С1=10-1 мг/мл), 2 – прозерина (C1 = 3,74·10-4 мг/мл). Условия эксперимента: CE=3,33·10-2 мг/мл, Cs=5,85·I0-4 моль/л, время ферментативной реакции - 2 мин, объем вводимой пробы ингибитора 10 мкл. Растворы приготавливали в 0,015 М фосфатном буферном растворе с ph=7,5, содержащем 0,1 н хлорид натрия и 1·10-3 моль/л йодида калия
Изучая изменение величины сигнала от длины предреактора при определении прозерина с концентрацией 3,75∙10-4 мг/мл и хлорофоса - 1∙10-1 мг/мл (рис.11), установили, что для этих двух ингибиторов длина предреактора должна быть чуть более 100 см.
Рисунок 12 - Градировочная характеристика аналитического сигнала от концентрации прозерина (импульсный ввод). Условия эксперимента: СE=3,3·10-2 мг/мл, СS =5,85·10-4 моль/л, длина реактора 2,2м., время ферментативной реакции 4,5 мин, объем вводимой пробы 10 мкл
Из приведенной на рис.12градуировочной характеристики для определения прозерина можно сделать вывод, что разработанный метод позволяет устойчиво определять концентрации ингибитора в диапазоне 10-4-10-3 мг/мл.
Заключение В представленной дипломной работе осуществлен сбор информации и проведен анализ текущего состояния ЭАК в Республике Казахстан. Детально изучены существующие проблемы ЭАК в области правовой регламентации, нормативно-технического, методического, метрологического, а также аппаратурного обеспечения. В результате анализа состояния правовой регламентации было установлено, что принятые нормативные правовые акты, регулирующие отношения в области охраны ОС и ЭАК, не противоречат основным документам: Экологическому и Водному Кодексам Республики Казахстан. Следует отметить, что ряд задач, намеченных в «Концепция развития эколого-аналитического контроля в области охраны ОС в Республике Казахстан на 2005 - 2007 гг. (Приказ Министра охраны окружающей среды РК от 02.02.2005 г. № 32-п), были выполнены не полностью. В этой связи в настоящее время требуется усовершенствование ЭАК в соответствии с текущими сложившимися условиями в РК. Нормативно-техническое обеспечение и правовая регламентация, разработаны в системе Министерства охраны ОС РК и Министерства здравоохранения РК, а также в ряде отраслевых и научных институтов в области охраны ОС. К наиболее важным нормирующим документам ЭАК относят: предельно-допустимые концентрации (ПДК), разработанные для индивидуальных веществ; санитарные правила и нормы (СанПиН); гигиенические нормативы (ГН); нормы радиационной безопасности СанПиН № 565 от 29.07.2010г. (НРБ-99). Кроме того, на территории Казахстана используется нормирующий документ, получивший название ориентировочный безопасный уровень воздействия (ОБУВ). Для действующих предприятий нормирование ЗВ производится путем установления нормативов предельно-допустимых выбросов (ПДВ) в атмосферу и нормативов предельно-допустимых сбросов (ПДС) в водные объекты, на поля фильтрации, пруды-испарители. Нормативы ПДВ и ПДС утверждаются территориальными природоохранными органами с учетом замечаний органов Госсанэпиднадзора. Методическое обеспечение ЭАК в Казахстане имеет аббревиатуры: СТ РК ИСО, ГОСТ Р ИСО, ПНД Ф, РД, МИ, МР, МУК. Согласно закона РК "Об обеспечении единства измерений" методики выполнения измерений (МВИ), применяемые при аналитическом контроле и мониторинге, должны быть метрологически аттестованы и внесены в Государственный Реестр (ГР) МВИ РК. В этой связи используемые международные стандарты и национальные стандарты зарубежных государств также должны проходить обязательную учетную регистрацию в РГП "Казахстанский институт метрологии". Следует отметить сложную ситуацию с ввозимыми на казахстанский рынок зарубежных и российских высокоточныхсовременных средств измерений, т.к. их применение на территории РК правомочно только после их внесения Государственный реестр СИ РК. Дилеры ведущих зарубежных фирм-производителей СИ зачастую вносят их в ГР СИ РК, но без их привязки к методическому обеспечению, т.е. к МВИ и это связано со значительным количеством используемых МВИ при проведении ЭАК в РК. Для проведения правомочного ЭАК в РК в обязательном порядке необходимо совместно и параллельно решать эти две взаимосвязанные задачи, т.е. требуется одновременное использование МВИ, внесенных в ГР МВИ РК, в обязательной привязке с применяемыми к ним СИ, также внесенных в ГР СИ РК, что требует значительных временных и финансовых затрат для казахстанских эколого-аналитических служб. В вышеупомянутой «Концепции ЭАК в РК…» планировалось создание метрологической службы (МС) при МООС РК, которая централизованно осуществляла бы проведение работ по гармонизации нормативных документов в области ЭАК РК с международными и национальными стандартами других государств. Метрологическая служба должна была бы осуществлять целенаправленную координацию работ по метрологическому обеспечению единства и требуемой точности результатов измерений, контроль достоверности эколого-аналитической информации о состоянии ОС, внедрения современных методов и средств измерений при проведении ЭАК, принимать непосредственное участие при проведении аккредитации эколого-аналитических лабораторий.В Казахстане действуют 115аккредитованных лабораторий в области охраны ОС, отвечающих требованиям СТ РК ИСО/МЭК 17025-2001 «Общие требования к компетентности испытательных и калибровочных лабораторий». В соответствии с Технической спецификацией в дипломе описаны существующие в мире концепции ЭАК, использующие современные образцы аналитического оборудования. В рамках международных соглашений Казахстан признает нормативно-методологические документы в области ЭАК и мониторинга, разработанные в бывшем СССР, а также в РФ, но при условии прохождения в установленном порядке процедуры признания их правомочности на территории РК. В связи с этим была рассмотрена существующая нормативно-техническая и правовая регламентация ЭАК, а также методическое, метрологическое и аппаратурное обеспечение, которые были представлены 807 наименованиями методик и документов. Исследование правовой, а также нормативно-техническойдокументации, регламентирующей ЭАК показало, что ряд документов разработаны в системе Казгидромета, другие - в системе по водным ресурсам, в рамках Казэпиднадзора и т.д. Ведомственная разобщенность выявила отрицательное влияние существующей в Казахстане системы разработки нормативно-технических документов для выработки общей государственной политики в области ЭАК. Рассмотрен вопрос о целесообразности проведения предварительного биотестирования сложных смесей ЗВ в объектах ОС на суммарную токсичность. Преимуществами предварительного биотестирования является: - возможность обнаружения и определения суммарной токсичности неизвестных отравляющих веществ с неустановленной структурой и физико-химическими свойствами; - экономическая целесообразность применения предварительного биотестирования до процедуры использования в ЭАК дорогостоящего химико-аналитического оборудования и затратного по времени проведения химанализа с учетом, зачастую, сложной предварительной пробоподготовки. При проведении предварительного биотестирования используется принцип воздействия токсических веществ на люминесцирующие бактерии Photobacteriumphosphoreum, который заложен в основу работы приборов Микротокс 5ТМ (Beckman, США) и Биотокс-10М (Россия). Другим перспективным биотестом, показывающим на присутствие токсических веществ в объектах ОС, может быть ингибирование ферментативных реакций. Ферментативные методы анализа обладают групповой специфичностью, высокой чувствительностью, обеспечивая определение токсичных веществ в диапазоне концентраций от 10-4 до 10-7 мг/мл., время отклика аналитической системы от 15 до 30 сек. В дипломной работе рассмотрены принципы ингибиторного анализа токсических соединений, описываются существующие ферментативные методы анализа ЗВ, а также приводится перечень промышленных биосенсоров, используемых в ЭАК. Принцип действия ферментативных анализаторов основывается на ингибировании биокаталитических систем токсичными веществами. Были разработаны проточные электроферментативные анализаторы токсичности на основе фермента холинэстеразы. Анализаторы в качестве основного узла включали ферментативный реактор и регистрирующий блок, фиксирующий кинетику протекания ферментативных процессов. Для проточных ферментативных анализаторов нами была разработана теория ингибиторного ферментативного анализа. Были изучены закономерности изменения величины сигнала в ферментативной аналитической системе в зависимости от условий проведения анализа и концентраций ЗВ. Разработана схема проточного анализатора токсичности с электрохимической регистрацией.
|
|||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 201. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 уменьшится до
уменьшится до  (рис.7 а,б). При вводе в поток фермента токсического вещества происходит ингибирование биокаталитической реакции, в связи с этим концентрация субстрата на выходе из реактора возрастает относительно фоновой линии до уровня
(рис.7 а,б). При вводе в поток фермента токсического вещества происходит ингибирование биокаталитической реакции, в связи с этим концентрация субстрата на выходе из реактора возрастает относительно фоновой линии до уровня  является однозначной функцией концентрации ингибитора в потоке
является однозначной функцией концентрации ингибитора в потоке  и может служить в качестве аналитического сигнала.
и может служить в качестве аналитического сигнала.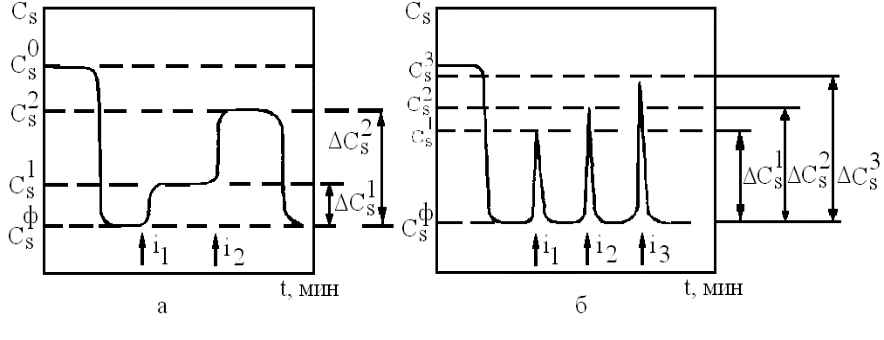
 (1)
(1) (2)
(2) (3)
(3) (4)
(4)



