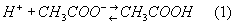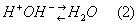Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Общая характеристика буферных системБуферные системы, буферные растворы, буферные смеси, системы, поддерживающие определённую концентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним некоторых количеств кислотили оснований.
Наоборот, при подщелачивании буферной системы, то есть при добавлении сильного основания (например, NaOH), ионы OH- связываются Н+-ионами, имеющимися в буферной системе благодаря диссоциацииуксусной кислоты; при этом образуется очень слабый электролит — вода:
По мере расходования Н+-ионов на связывание ионов OH- диссоциируют всё новые и новые молекулыCH3COOH, так что равновесие (1) смещается влево. В результате, как в случае добавления Н+-ионов, так и в случае добавления ОН--ионов, эти ионы связываются и потому кислотность раствора практически не меняется. Кислотность растворов принято выражать так называемым водородным показателем pH (для нейтральных растворов pH=7, для кислых — pH меньше, а для щелочных — больше 7). Приливание к 1 л чистой воды 100 мл 0,01 молярного раствора HCl (0,01 М) изменяет pH от 7 до 3. Приливание того же раствора к 1 л буферной системы CH3COOH + CH3COONa (0,1 М) изменит pH от 4,7 до 4,65, то есть всего на 0,05. В присутствии 100 мл 0,01 М раствора NaOH в чистой воде pH изменится от 7 до 11, а в указанной буферной системе лишь от 4,7 до 4,8. Кроме рассмотренного, имеются многочисленные другие буферные системы (примеры см. в табл.). Кислотность (и, следовательно, pH) буферной системы зависит от природы компонентов, их концентрации, а для некоторых буферных систем и от температуры. Для каждой буферной системы pH остаётся примерно постоянным лишь до определённого предела, зависящего от концентрации компонентов.  Примеры буферных систем
Буферные системы широко используются в аналитической практике и в химическом производстве, так как многие химические реакции идут в нужном направлении и с достаточной скоростью лишь в узких пределах pH. Буферные системы имеют важнейшее значение для жизнедеятельности организмов; они определяют постоянство кислотности различных биологических жидкостей (крови, лимфы, межклеточных жидкостей). Основные буферные системы организма животных и человека: бикарбонатная (угольная кислота и её соли), фосфатная (фосфорная кислота и её соли), белки (их буферные свойства определяются наличием основных и кислотных групп). Белки крови (прежде всего гемоглобин, обусловливающий около 75% буферной способности крови) обеспечивают относительную устойчивость pH крови. У человека pH крови равен 7,35—7,47 и сохраняется в этих пределах даже при значительных изменениях питания и др. условий. Чтобы сдвинуть pH крови в щелочную сторону, необходимо добавить к ней в 40—70 раз больше щёлочи, чем к равному объёму чистой воды. Естественные буферные системы в почве играют большую роль в сохранении плодородия полей. При сдвигах содержания ионов Н+ в крови и других средах организма (как при увеличении, так и при снижении их количества) сначала срабатывают быстродействующие и мощные химические буферные системы плазмы и эритроцитов (гемоглобиновая, бикарбонатная, фосфатная, белковая). Гемоглобиновая буферная система является основным буфером эритроцитов крови и составляет около 75% всей буферной ёмкости крови. Гемоглобин, как и другие белки, — амфолит, то есть, гемоглобиновая буферная система состоит из кислого компонента (оксигенированногоНb, т.е. НbО2) и основного компонента (неоксигенированного, т.е. восстановленного Нb). Показано, что гемоглобин — более слабая кислота (примерно в 70 раз), чем оксигемоглобин. Кроме того, Нb поддерживает постоянство рН благодаря связыванию С02 и переносу его из ткани в лёгкие и далее — во внешнюю среду. Бикарбонатная (гидрокарбонатная) буферная система является основным буфером плазмы крови и внеклеточной жидкости и составляет примерно 15% общей буферной ёмкости крови. Она представлена во внеклеточной среде угольной кислотой (Н2СОз) и гидрокарбонатом натрия (NaHCO3). Концентрация водородных ионов в данном буфере равна [H+] = К [ Н2С03 / NaHC03 = 1/20, где К — константа диссоциации угольной кислоты. Эта буферная система обеспечивает, с одной стороны, образование NaHC03, с другой — образование угольной кислоты (H+ + НСОз —» Н2С03) и распад последней (Н2С03 —» Н20 + С02) под влиянием фермента карбоангидразы до Н20 и С02. Углекислый газ удаляется лёгкими при выдохе, при этом сдвига рН не происходит. Данная буферная система препятствует сдвигам рН при внесении в биологическую среду сильных кислот и оснований в результате превращения их либо в слабые кислоты, либо в слабые основания. Гидрокарбонатный буферная систем — важный индикатор КОС. Это система открытого типа, которая ассоциирована с функцией как системы внешнего дыхания, так почек и кожи Фосфатная буферная система представлена одно- и двузамещённым фосфорнокислым натрием (NaH2P04 и Na2HP04). Первое соединение ведёт себя как слабая кислота, второе — как слабое основание. Образовавшиеся в организме и поступившие в кровь кислоты взаимодействуют с Na2HP04, а основания — с NaH2P04. В итоге рН крови сохраняется неизменным. Фосфаты выполняют буферную роль главным образом во внутриклеточной среде (особенно клеток канальцев почек) и поддерживают исходное состояние бикарбонатного буфера. Белковая буферная система выполняет роль внутриклеточной буферной системы. Обладая амфолитными свойствами, в кислой среде они ведут себя как основания, а в щелочной среде — как кислоты. Белковая буферная система состоит из слабодиссоциирующего белка с кислым свойствами (белок-СООН) и белка в комплексе с сильными основаниями (белок-COONa). Эта буферная система также способствует предупреждению сдвига рН крови. Позже (через несколько минут и часов) срабатывают физиологические (органные и системные) механизмы компенсации и устранения сдвигов КОС (осуществляемые лёгкими — с выдыхаемым воздухом, почками — с мочой, кожей — с потом, печенью и другими органами пищеварительного тракта — с калом). Литература https://dommedika.com/phisiology/528.html |
||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 192. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |